文章信息
- 晚期食管癌患者营养状态与化疗疗效及生存的相关性
- Correlation of Baseline Nutritional Status with Response to Chemotherapy and Survival of Advanced Esophageal Cancer Patients
- 肿瘤防治研究, 2017, 44(9): 612-617
- Cancer Research on Prevention and Treatment, 2017, 44(9): 612-617
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0158
- 收稿日期: 2017-02-16
- 修回日期: 2017-05-10
食管癌是常见的消化道恶性肿瘤之一,在世界范围内食管癌发病率在所有恶性肿瘤中位居第八,死亡率居第六[1-3]。食管癌患者预后很差,分期早的患者行根治术后90%会出现复发转移,5年生存率17%~36%[4-5],不同研究中生存数据差异较大可能与患者不同的手术方式或治疗模式有关。约50%的患者在诊断时即为晚期,接受姑息化疗后的中位生存期仅8~13月[6-7],对于这种晚期食管癌患者,放化疗是主要治疗方法,但临床上大多数食管癌患者由于食欲下降、进食梗阻等问题而存在不同程度的营养不良,甚至恶病质。不仅生活质量差,而且对放化疗的耐受性很差。食管癌患者的基线营养状态是否影响治疗疗效及生存尚不明确,也没有客观判断指标,基于此,本项研究的目的是分析晚期食管癌患者一线化疗前基线营养状态与化疗疗效、耐受性及生存期的相关性,以期指导临床实践。
1 资料与方法 1.1 一般资料2011年3月至2013年4月56例食管癌患者入选本中心临床试验“尼妥珠单抗联合紫杉醇和顺铂用于不可手术的局部进展期或转移性食管癌患者一线治疗的单中心Ⅱ期研究”。患者入选标准:(1)治疗前经内镜病理证实为原发性食管鳞癌;(2)局部进展不能手术、有远处转移的晚期患者或术后复发者既往未接受过化疗或距辅助化疗间隔至少6月;既往未行放疗或距放疗间隔至少3月出现放疗野之外新发病灶者;(3)按照RECIST 1.1标准有可测病灶。
所有患者均接受紫杉醇+顺铂+尼妥珠单抗方案化疗。回顾性收集患者临床资料及化疗前营养状况资料:卡式评分(karnofsky performance status, KPS)、体重下降百分数、体重指数(body mass index, BMI)、总蛋白(total protein, TP)、白蛋白(albumin, Alb)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、血红蛋白(hemoglobin, Hb)、外周血淋巴细胞计数(lymphocyte count, Lymph)。
56例患者中,男性46例,女性10例(男女比例4.6:1);中位年龄61.5(42~75)岁;食管原发灶位于上段者5例(8.9%),中段者32例(57.1%),下段者19例(34.0%);高分化者1例(1.8%),中分化者26例(46.4%),低分化者29例(51.8%)。所有患者Hb均≥90 g/L,其中90~130 g/L者18例(32.1%),> 130 g/L者38例(67.9%)。患者转移灶情况及其他各营养指标情况具体见表 1。其中TP、Alb、TG、TC、Lymph分界值均为各指标均值。需指出的是,有些患者个别营养指标数值不详,其中8例患者体重下降程度不详,1例患者缺乏TP、Alb、TG、TC数值,因此分析体重下降程度、TP、Alb、TG、TC这5项指标时患者不足56例。
根据RECIST 1.1实体瘤疗效统一评价标准将疗效分为:完全缓解(complete response, CR),部分缓解(partial response, PR),病情稳定(stable disease, SD)和疾病进展(progressive disease, PD),每2周期评价1次,若出现可能为疾病进展的表现可提前评价。客观缓解率(objective response rate, ORR)计算方法:(CR+PR)/患者总数。疾病控制率(disease control rate, DCR)计算方法:(CR+PR+SD)/患者总数。同时依据国际肿瘤化疗药物不良反应评价标准CTCAE 3.0版对所有患者进行不良反应分级。
1.3 统计学方法采用SPSS16.0软件进行统计学分析。应用卡方检验和Spearman相关分析法分析营养指标(KPS、BMI、体重下降百分数、TP、Alb、TG、TC、Hb、Lymph)与化疗疗效及不良反应相关性。定义无进展生存期(progression free survival, PFS)为患者开始化疗至疾病进展或死亡的时间, 总生存期(overall survival, OS)为患者开始化疗至死亡或末次随访时间。采用Kaplan-Meier方法计算生存率,两组生存率的比较用Log rank检验,应用Cox回归法分析生存时间的影响因素。P < 0.05为差异具有统计学意义。
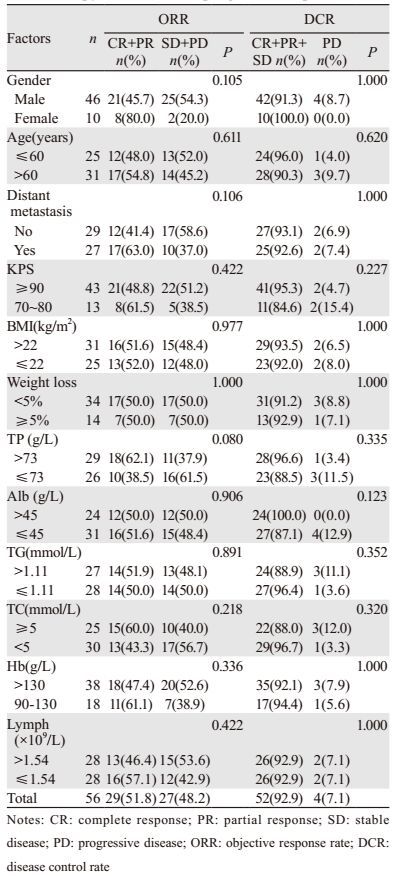
2 结果 2.1 营养状态与化疗疗效的相关性接受治疗的56例患者中,无CR病例,29例(51.8%)为PR,23例(41.1%)为SD,4例(7.1%)为PD;总有效率为51.8%(29/56);疾病控制率为92.9%(52/56)。
未观察到性别、年龄、分期、KPS、BMI、体重下降、TP、Alb、TG、TC、Hb、Lymph与患者一线化疗有效率及疾病控制率相关(均P > 0.05),见表 2。
 |
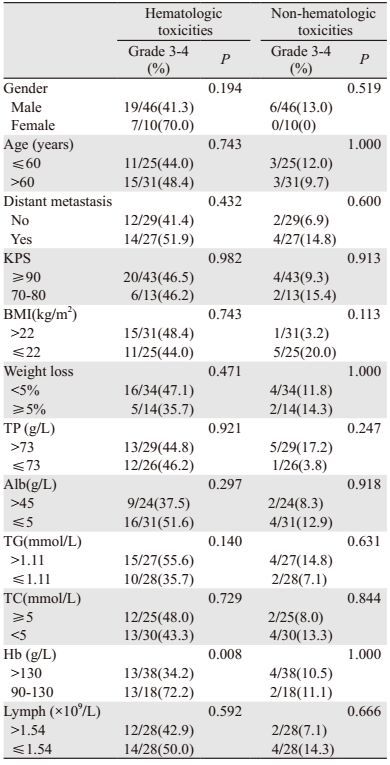
56例患者中,发生3级以上血液学毒性者26例(46.4%),包括3级粒细胞减少19例,4级粒细胞减少7例;3级以上非血液学毒性者6例(10.7%),包括3级血尿1例,3级便秘1例,3级食欲下降2例,3级神经毒性2例。
Hb的水平与患者3级以上血液学毒性明显相关,其中Hb > 130 g/L者较90~130 g/L者3级以上血液学毒性的发生率显著降低(34.2% vs. 72.2%,P=0.008),但两者在3级以上非血液学毒性上并无差别(P > 0.05)。
未观察到性别、年龄、有无远处转移、KPS、BMI、体重下降程度、TP、Alb、TG、TC、Lymph与患者3级以上血液学或非血液学毒性相关(均P > 0.05),见表 3。其中,56例患者中发生3级以上血液学毒性者共26例。但因8例患者体重下降程度不详,1例患者缺乏TP、Alb、TG、TC数值,故分析体重下降程度、TP、Alb、TG、TC这5项指标时发生3级以上血液学毒性者总数不足26例。如:TP > 73g/L者共29例,其中13例发生了3级以上血液学毒性(44.8%);TP≤73 g/L者共26例,其中的12例发生了3级以上血液学毒性(46.2%);另有1例患者TP数值不详。故在分析TP指标时发生3级以上血液学毒性的总人数为25例。
 |
此外,本研究也应用Spearman相关分析法分析了年龄、BMI、体重下降程度、TP、Alb、TG、TC、Hb、Lymph与患者化疗疗效和不良反应的相关性,所得结果相同。
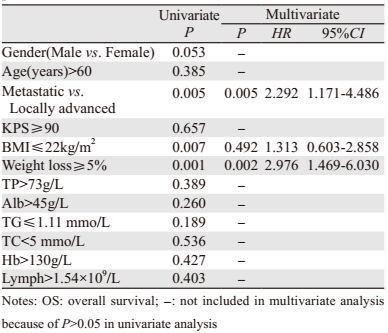
2.3 营养状态与生存期所有患者的中位总生存期(OS)为19.2月。单因素分析显示患者的BMI和体重下降程度与OS有关,BMI≤22 kg/m2和体重下降≥5%者的OS均明显缩短(P值分别为0.007和0.001)。除此之外,与局部进展期患者相比,远处转移者的OS也明显缩短(P=0.005)。
多因素分析中,有无远处转移、体重下降程度是患者的独立预后因素,有远处转移(P=0.005)、体重下降≥5%(P=0.002)与患者预后差相关,见表 4。
 |
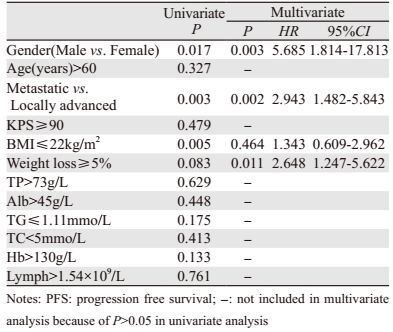
所有患者的中位无进展生存期(PFS)为10.7月。单因素分析显示患者的BMI与PFS有关,BMI≤22 Kg/m2者的PFS明显缩短(P=0.005)。除此之外,男性与女性相比、远处转移与局部进展期患者相比PFS均明显缩短(P值分别为0.017和0.003)。
多因素分析中,性别、有无远处转移、体重下降程度是患者PFS独立影响因素,男性(P=0.003)、有远处转移(P=0.002)、体重下降≥5%(P=0.011)与较短PFS相关,见表 5。
 |
60%~85%的食管癌患者在治疗前存在不同程度的营养不良,居所有肿瘤第一位,约22%的患者甚至直接死于营养不良[8-9],因此很多学者致力于研究食管癌患者的营养问题,这些研究大多关注的是患者术后的营养状况及术后营养支持治疗的方式等问题,关于不能手术食管癌患者营养状况的研究较少,与其他国家相比,我国的食管癌发病率高,每年的新发病例约占全世界50%[10],且大多数患者在诊断时已无手术机会,故进一步研究营养状况在这类患者中的作用显得尤为重要,有利于优化食管癌患者的综合治疗策略,使患者最大程度地获益。
关于晚期食管癌患者营养状况与单纯一线化疗疗效及不良反应的相关性,目前尚无研究报道,既往Di等[11]曾分析了行根治性放化疗的局部进展期食管癌患者中基线营养状态与放化疗疗效的关系,结果示白蛋白 > 35 g/L是放化疗有效的独立预测因素(P=0.009, HR=5.26, 95%CI: 1.50~18.41),而体能状况评分(performance status, PS)、体重下降程度、BMI、Hb均与疗效无明显相关。本研究是首次在不可手术的局部进展期或转移性食管癌患者中分析营养状况与一线化疗疗效及不良反应的相关性,结果显示Hb的水平与患者3级以上血液学毒性明显相关,即Hb > 130 g/L者较90~130 g/L者3级以上血液学毒性的发生率显著降低(34.2% vs. 72.2%, P=0.008)。
贫血不仅导致肿瘤患者对化疗的耐受性降低,而且会引起肿瘤组织乏氧,诱导多种生长因子促进肿瘤浸润和转移,同时降低对化疗的敏感度,最终影响患者预后,因此中重度贫血的患者不适宜行全身化疗[12],故目前国内外大多数临床试验及日常临床诊疗均限定化疗适应证为Hb≥90 g/L。但在Hb≥90 g/L并接受化疗的患者中,尚无明确界值可将这类患者进一步分层以预测患者对化疗的耐受性,在食管癌领域未见相关研究报道。本研究结果显示,Hb > 130 g/L者较90~130 g/L者3级以上血液学毒性的发生率显著降低,首次为临床提供了可参考的具体量化指标。
在食管癌营养状态与患者预后相关性方面,研究最多的指标是体重下降和BMI。体重下降是食管癌患者的常见症状,57%~69%的食管癌患者在诊断时有体重下降[13-14],且食管癌体重下降的程度高于其他癌种[15],平均下降程度为13%~16%[16]。关于体重下降、BMI与食管癌预后相关性的研究同样多集中于行食管癌手术的患者,且结论也不一[17-26],如van等[17]证实食管癌术前体重下降 > 10%的患者术后5年生存率明显下降(HR=1.34, 95%CI: 1.02~1.74),另一项来自日本的回顾性分析也显示体重下降 > 2%对患者生存期有负性影响(HR=1.64, 95%CI: 1.09~2.46,P=0.001)[18]。一项包含2 031例患者的Meta分析显示BMI高与术后并发症发生率增高有关,但同时BMI高者生存期明显延长[19]。Skipworth等[20]的研究则得出了相反的结果,即术前体重下降与患者预后并无相关。因临床研究数目较少,在不可手术的局部进展期或晚期食管癌中体重下降及BMI有无预后作用更不确切。Di等[11]分析了行根治性放化疗的局部进展期食管癌患者营养状态与预后的关系,结果显示BMI > 18 kg/m2是患者的独立预后因素。本研究中,体重下降≥5%者较 < 5%者PFS、OS均明显缩短,多因素分析显示不仅是患者PFS的独立预测因素(P=0.011),也是患者的独立预后因素(P=0.000)。本研究中体重下降的界值与既往研究不同,考虑与不同研究纳入的患者类别及样本量不同有关。
本项研究结果提示,对于不可手术的局部进展期或转移性食管癌患者,在治疗前有必要评估患者的基线营养状态,虽然不能预测化疗疗效,但在预测患者化疗不良反应及评估患者预后方面有一定的作用,从而优化患者的整体治疗策略。如营养状况好者化疗耐受性及预后均相对较好,在治疗上应采取较为积极的方式,应用包括化疗、放疗、介入、射频消融等在内的多学科综合治疗,为患者提供更多的获益机会。营养状况差者化疗耐受性及预后差,因此在临床上更应关注患者的生活质量及化疗不良反应,化疗时不宜一味追求高剂量,并要密切随访患者的疗效,如患者一旦化疗疗效差或出现不可耐受的不良反应则应立即停止后续化疗,避免过度治疗。另外对于这类患者,还应考虑在化疗前或化疗同时给予一定的营养支持以改善营养状态。
本研究虽是一项回顾性研究,且样本量较少,但首次为晚期食管癌患者营养评估、治疗决策的制定提供了可参考的具体量化指标,且研究结果统计学意义显著,如Hb≤130 g/L者化疗后3级以上血液学毒性的发生率高、体重下降≥5%者预后差,提高了临床可操作性,为今后进一步扩大样本量研究奠定了基础。希望这些研究的结果能为今后晚期食管癌患者的个体化治疗带来帮助。
| [1] | Cools-Lartigue J, Spicer J, Ferri LE. Current status of management of malignant disease: current management of esophageal cancer[J]. J Gastrointest Surg, 2015, 19(5): 964–72. DOI:10.1007/s11605-014-2701-3 |
| [2] | Gupta B, Kumar N. Worldwide incidence, mortality and time trends for cancer of the oesophagus[J]. Eur J Cancer Prev, 2017, 26(2): 107–18. DOI:10.1097/CEJ.0000000000000249 |
| [3] | Global Burden of Disease Cancer Collaboration, Fitzmaurice C, Dicker D, et al. The Global Burden of Cancer 2013[J]. JAMA Oncol, 2015, 1(4): 505–27. DOI:10.1001/jamaoncol.2015.0735 |
| [4] | Allum WH, Stenning SP, Bancewicz J, et al. Long-term results of a randomized trial of surgery with or without preoperative chemotherapy in esophageal cancer[J]. J Clin Oncol, 2009, 27(30): 5062–7. DOI:10.1200/JCO.2009.22.2083 |
| [5] | Pennathur A, Gibson MK, Jobe BA, et al. Oesophageal carcinoma[J]. Lancet, 2013, 381(9864): 400–12. DOI:10.1016/S0140-6736(12)60643-6 |
| [6] | Cunningham D, Starling N, Rao S, et al. Capecitabine and oxaliplatin for advanced esophagogastric cancer[J]. N Engl J Med, 2008, 358(1): 36–46. DOI:10.1056/NEJMoa073149 |
| [7] | Liu Y, Ren Z, Yuan L, et al. Paclitaxel plus cisplatin vs. 5-fluorouracil plus cisplatin as first-line treatment for patients with advanced squamous cell esophageal cancer[J]. Am J Cancer Res, 2016, 6(10): 2345–50. |
| [8] | Bozzetti F, Mariani L, Lo Vullo S, et al. The nutritional risk in oncology: a study of 1, 453 cancer outpatients[J]. Support Care Cancer, 2012, 20(8): 1919–28. DOI:10.1007/s00520-012-1387-x |
| [9] | Cong MH, Li SL, Cheng GW, et al. An Interdisciplinary Nutrition Support Team Improves Clinical and Hospitalized Outcomes of Esophageal Cancer Patients with Concurrent Chemoradiotherapy[J]. Chin Med J (Engl), 2015, 128(22): 3003–7. DOI:10.4103/0366-6999.168963 |
| [10] | Wang XS, Kong DJ, Lin TY, et al. A versatile nanoplatform for synergistic combination therapy to treat human esophageal cancer[J]. Acta Pharmacol Sin, 2017, 38(6): 931–42. DOI:10.1038/aps.2017.43 |
| [11] | Di Fiore F, Lecleire S, Pop D, et al. Baseline Nutritional Status Is Predictive of Response to Treatment and Survival in Patients Treated by Definitive Chemoradiotherapy for a Locally Advanced Esophageal Cancer[J]. Am J Gastroenterol, 2007, 102(11): 2557–63. DOI:10.1111/ajg.2007.102.issue-11 |
| [12] | Zhu W, Xu B. Association of pretreatment anemia with pathological response and survival of breast cancer patients treated with neoadjuvant chemotherapy: a population-based study[J]. PLoS One, 2015, 10(8): e0136268. DOI:10.1371/journal.pone.0136268 |
| [13] | Cong MH, Li SL, Cheng GW, et al. An interdisciplinary nutrition support team improves clinical and hospitalized outcomes of esophageal cancer patients with concurrent chemoradiotherapy[J]. Chin Med J (Engl), 2015, 128(22): 3003–7. DOI:10.4103/0366-6999.168963 |
| [14] | Reim D, Friess H. Feeding challenges in patients with esophageal and gastroesophageal cancers[J]. Gastrointestinal tumors, 2016, 2(4): 166–77. DOI:10.1159/000442907 |
| [15] | Bozzetti F, SCRINIO Working Group. Screening the nutritional status in oncology: a preliminary report on 1, 000 outpatients[J]. Support Care Cancer, 2009, 17(3): 279–84. DOI:10.1007/s00520-008-0476-3 |
| [16] | Bozzetti F. Nutritional support in patients with oesophageal cancer[J]. Support Care Cancer, 2010, 18(Suppl 2): S41–50. |
| [17] | van der Schaaf MK, Tilanus HW, van Lanschot JJ, et al. The influence of preoperative weight loss on the postoperative course after esophageal cancer resection[J]. J Thorac Cardiovasc Surg, 2014, 147(1): 490–5. DOI:10.1016/j.jtcvs.2013.07.072 |
| [18] | Ikeda M, Natsugoe S, Ueno S, et al. Significant host-and tumor-related factors for predicting prognosis in patients with esophageal carcinoma[J]. Ann Surg, 2003, 238(2): 197–202. |
| [19] | Zhang SS, Yang H, Luo KJ, et al. The impact of body mass index on complication and survival in resected oesophageal cancer: a clinical-based cohort and meta-analysis[J]. Br J Cancer, 2013, 109(11): 2894–903. DOI:10.1038/bjc.2013.666 |
| [20] | Skipworth J, Foster J, Raptis D, et al. The effect of preoperative weight loss and body mass index on postoperative outcome in patients with esophagogastric carcinoma[J]. Dis Esophagus, 2009, 22(7): 559–63. DOI:10.1111/des.2009.22.issue-7 |
| [21] | Miao L, Chen H, Xiang J, et al. A high body mass index in esophageal cancer patients is not associated with adverse outcomes following esophagectomy[J]. J Cancer Res Clin Oncol, 2015, 141(5): 941–50. DOI:10.1007/s00432-014-1878-x |
| [22] | Hasegawa T, Kubo N, Ohira M, et al. Impact of body mass index on surgical outcomes after esophagectomy for patients with esophageal squamous cell carcinoma[J]. J Gastrointest Surg, 2015, 19(2): 226–33. DOI:10.1007/s11605-014-2686-y |
| [23] | Kamachi K, Ozawa S, Hayashi T, et al. Impact of body mass index on postoperative complications and long-term survival in patientswith esophageal squamous cell cancer[J]. Dis Esophagus, 2016, 29(3): 229–35. DOI:10.1111/dote.2016.29.issue-3 |
| [24] | Ji W, Zheng W, Li B, et al. Influence of body mass index on the long-term outcomes of patients with esophageal squamous cell carcinoma who underwent esophagectomy as a primary treatment: A 10-year medical experience[J]. Medicine (Baltimore), 2016, 95(29): e4204. DOI:10.1097/MD.0000000000004204 |
| [25] | Pan W, Sun Z, Xiang Y, et al. The correlation between high body mass index and survival in patients with esophageal cancer after curative esophagectomy: evidence from retrospective studies[J]. Asia Pac J Clin Nutr, 2015, 24(3): 480–8. |
| [26] | Ren C, Cai XY, Qiu MZ, et al. Impact of body mass index on survival of esophageal squamous carcinoma patients in southern China[J]. J Thorac Dis, 2015, 7(3): 337–45. |
 2017, Vol. 44
2017, Vol. 44