文章信息
- 局部进展期食管胃结合部腺癌术前放化疗骨髓受照剂量参数与血液学毒性的关系
- Relationship of Irradiated Dosimetric Parameters of Bone Marrow and Hematologic Toxicities in Locally Advanced Adenocarcinoma of Esophagogastric Junction Patients Treated with Preoperative Chemoradiotherapy
- 肿瘤防治研究, 2017, 44(12): 804-810
- Cancer Research on Prevention and Treatment, 2017, 44(12): 804-810
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0133
- 收稿日期: 2017-02-13
- 修回日期: 2017-07-12
全世界范围内食管胃结合部腺癌(adenocarcinoma of the esophagogastric junction, AEG)的发病率逐年增加[1]。由于大部分患者初诊时即为局部晚期[2],直接手术切除率较低,且AEG单纯手术后局部复发率和远处转移率分别约为20%~40%和50%[3-4]。多数研究显示局部进展期食管胃结合部腺癌术前放化疗或化疗较单纯手术可明显提高R0切除率和病理完全缓解率,延长生存时间[5-11]。同期放化疗在改善预后的同时,不良反应发生率相应增加,其中最常见的为血液学毒性。严重的血液学毒性可能延迟或中断放化疗的实施,影响最终治疗效果。因此降低血液学毒性的发生率已成为目前急需解决的问题。
在盆腔恶性肿瘤的同期放化疗中,诸多学者通过降低骨盆骨髓受量从而降低严重血液学毒性的发生率[12-13]。不规则骨是成人主要造血部位[14],骨髓造血干细胞对放疗十分敏感,低剂量照射可能会损伤骨髓干细胞,而食管胃结合部位于胸腹交界处,胸腰椎、肋骨等均位于放疗照射范围之内,因此本研究回顾性分析了局部进展期食管胃结合部腺癌术前同期放化疗中骨髓受照剂量参数与≥2级血液学毒性的关系。
1 资料与方法 1.1 患者资料 1.1.1 纳入标准年龄≥18岁;PS评分0~1分;病理类型为腺癌;根据胃镜、CT或MRI证实为局部进展期(以淋巴结、浸润深度和邻近器官侵犯情况为标准),并应用CT确定TNM分期(T3~4、Nx入组);无远处转移;肝肾及心肺功能均正常;完成全部剂量放疗及2周期化疗;病例资料完整。
1.1.2 排除标准存在远处转移、严重的心肺疾病、孕妇及哺乳期妇女、存在第二原发恶性肿瘤、未完成全部剂量放疗及2周期化疗。
2013年12月至2016年5月于河北医科大学第四医院就诊行术前同期放化疗共84例局部进展期食管胃结合部腺癌患者,60例患者符合入组标准。
1.2 治疗方案患者取仰卧位,口服500~800 ml水充盈胃腔,体膜固定;扫描时静脉注射造影剂碘海醇来进行增强扫描,上界至肺尖水平,下界至肾下极水平;扫描图像经区域网传输至ADAC pinnacal 8.0治疗计划系统,在CT图像上勾画GTV,包括治疗前胃镜及CT诊断的原病灶及肿大淋巴结,CTV为GTV沿食管向上扩3 cm,沿胃壁扩1.5~2 cm,轴向外扩0.8 cm;CTV外扩0.5 cm范围为PTV。均采用6MV-X线调强放疗,95%PTV剂量为45 Gy,25次完成,单次分割剂量为1.8 Gy/d,5次/周。危及器官包括心脏、脊髓、肝脏、双肾及双肺。肝脏V30<40%,心脏V40<30%,最大脊髓量<40 Gy,双肾V20<25%,尽量使肺体积及剂量降到最低。同期行XELOX方案化疗2周期(卡培他滨1 000 mg/m2,口服,2次/日,d1~14;奥沙利铂130 mg/m2,静脉滴注,d1)。
1.3 总受照骨髓勾画勾画出照射范围内骨骼(胸腰椎、肋骨及胸骨),由骨骼外轮廓代替总受照骨髓。总受照骨髓为椎骨、肋骨及胸骨之和。根据治疗计划导出相应的剂量体积直方图数据(dose-volume histogram, DVH),计算出每例患者椎骨、肋骨、胸骨及总受照骨髓的V5~45。DVH参数中Vx=胸骨接受xGy照射的体积所占的比例。
1.4 评估指标血液学毒性根据美国国家癌症研究所常见毒性标准(NCI-CTC)4.0版分级标准判定。从放化疗开始记录每例患者的白细胞、中性粒细胞、血红蛋白及血小板等指数,确定无放化疗禁忌。自同期放化疗开始每周测定血常规,白细胞、中性粒细胞、血红蛋白、血小板计数的任何一项,均按最严重的一次血液学毒性记录分级。
1.5 统计学方法采用SPSS21.0统计软件进行统计。DVH参数采用新的Vx=原有Vx×100。简单线性和Logistic回归模型检验DVH参数、年龄、放疗天数等与粒细胞最低值及血液学毒性发生率的关系。将单因素线性相关及Logistic回归中P<0.1的因素纳入多因素分析中。ROC曲线评估为了避免血液学毒性发生的DVH参数的截点值。计量和计数资料比较分别采用Wilcoxon秩和检验和卡方检验,检验水准α=0.05。
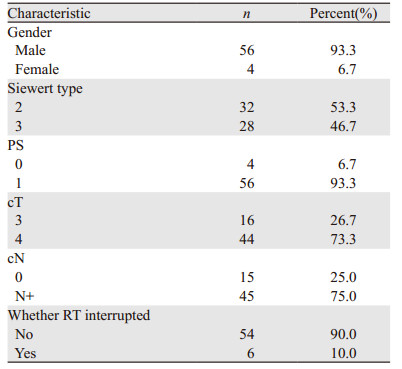
2 结果 2.1 全组患者一般资料全组患者的一般情况详见表 1。全组患者的中位年龄为61.5岁(40~82岁)。放疗前白细胞、中性粒细胞、血红蛋白和血小板中位数分别为6.43×109/L(3.5×109/L~11.5×109/L)、4.09×109/L(1.93×109/L~8.36×109/L)、132.80 g/L(90~157 g/L)、219×109/L(100×109/L~429×109/L)。放化疗结束后白细胞、中性粒细胞、血红蛋白、血小板中位数分别为4.60×109/L(2.33×109/L~19.02×109/L)、3.49×109/L(1.40×109/L~16.53×109/L)、123.51 g/L(93.2g/L-152.8 g/L)和133.44×109/L(33×109/L~275×109/L)。中位放疗天数36.13天,与血液学毒性相关的预测指标详见表 2。
|
|
全组患者中发生1~4级血液学毒性的分别有19例(31.67%)、24例(40%)、8例(13.33%)和1例(1.67%);1~4级白细胞降低分别有16例(32.66%)、21例(36.67%)、2例(3.34%)和0例(0%);1~4级中性粒细胞降低分别有20例(33.33%)、5例(8.33%)、2例(3.34%)和0例(0%);1~4级血红蛋白降低分别有31例(51.66%)、1例(1.67%)、0例(0)和0例(0);1~4级血小板降低分别有8例(13.33%)、13例(21.67%)、6例(10%)和1例(1.67%)。
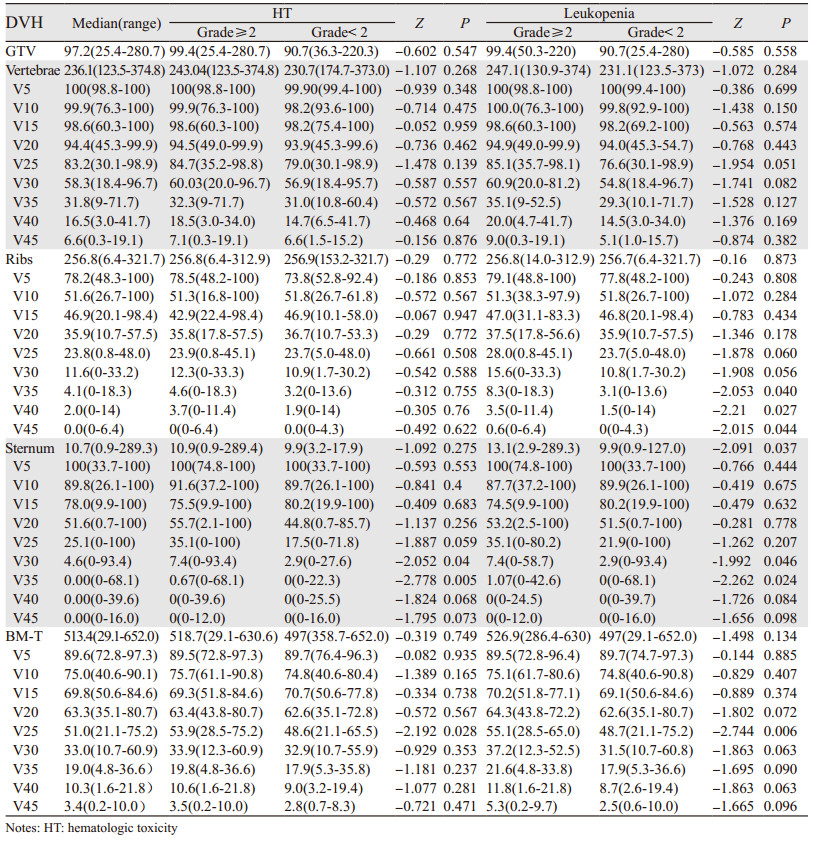
2.3 相关预测指标与急性血液学毒性发生的关系将全组患者依据是否发生≥2级白细胞降低分为两组(发生为阳性,未发生为阴性),比较两组剂量参数,结果显示阳性组在肋骨V30(P=0.004)、V35(P=0.027)、V40(P=0.044)、V45(P=0.037),胸骨V30(P=0.046)、V35(P=0.024)及总受照骨髓V25(P=0.006)明显高于阴性组;同样将全组患者依据是否发生≥2级急性血液学毒性分为两组(发生为阳性,未发生为阴性),结果显示两组在胸骨V30(P=0.04)、V35(P=0.005)及总受照骨髓V25(P=0.028)差异存在统计学意义,见表 2。
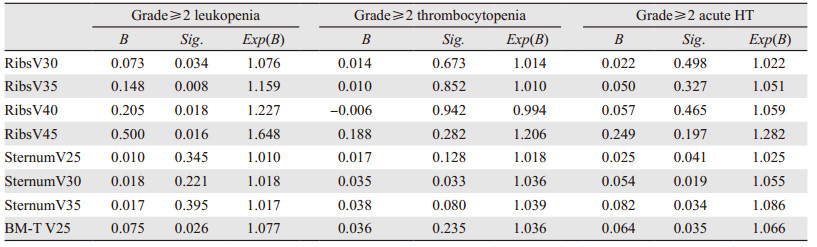
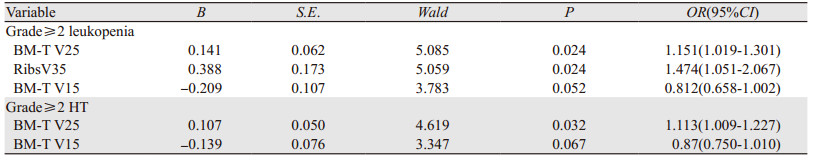
将年龄、性别等临床情况及DVH参数纳入单因素分析中,单因素Logistic回归分析结果显示,增加肋骨V30(P=0.034)、V35(P=0.008)、V40(P=0.018)、V45(P=0.016),总受照骨髓V25(P=0.026)可增加发生≥2级白细胞降低的风险;增加胸骨V30(P=0.033)可增加发生≥2级血小板降低的风险;增加胸骨V20(P=0.041)、V25(P=0.019)、V35(P=0.034),总受照骨髓的V25(P=0.035)可增加发生≥2级总受照骨髓抑制的风险,见表 3。多因素结果显示总受照骨髓V25(P=0.024, OR=1.151)和肋骨V35(P=0.024, OR=1.474)是影响≥2级白细胞降低的独立因素;总受照骨髓V25(P=0.032, OR=1.113)是影响≥2级急性血液学毒性发生的独立因素,见表 4。
|
|
采用ROC曲线分析发生≥2级白细胞降低时总受照骨髓V25和肋骨V35的截点,曲线下面积分别为0.712(P=0.006)和0.659(P=0.040),依据标准诊断正确度可行。以敏感度与(1-特异度)之差最大值为标准,得出总受照骨髓V25截点值为49.67%(敏感度为0.826,1-特异度为0.405),肋骨V35截点值为7.86%(敏感度为0.522,1-特异度为0.189)。应用同样方法得出总受照骨髓V25的截点,曲线下面积分别为0.666(P=0.028),得出总受照骨髓V25截点值为41.21%(敏感度为0.939,1-特异度为0.741),见图 1~3。以肋骨V35的截点值为界将患者分为两组,肋骨V35>7.86%组中≥2级白细胞降低发生率明显高于肋骨V35≤7.86%组(55.9% vs. 15.4%, P=0.002);以总受照骨髓V25的截点值为界将患者分为两组,总受照骨髓V25>49.67%组中≥2级的白细胞降低发生率明显高于总受照骨髓V25≤49.67%组(63.2% vs. 26.8%, P=0.007);以总受照骨髓V25的截点值为界将患者分为两组,总受照骨髓V25>41.21%组中≥2级的急性血液学毒性发生率高于总受照骨髓V25≤41.21%组(60.8% vs. 22.2%, P=0.075),但尚未达到统计学差异。
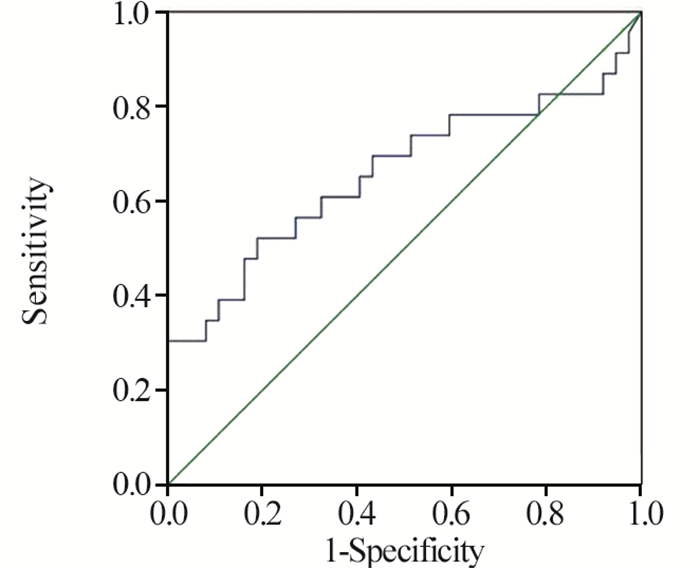
|
| 图 1 应用ROC曲线分析确定对于发生≥2级白细胞降低有预测价值的肋骨V35的截点值 Figure 1 Receiver operating characteristic curves for ribsV35 associated with grade ≥2 leukopenia |
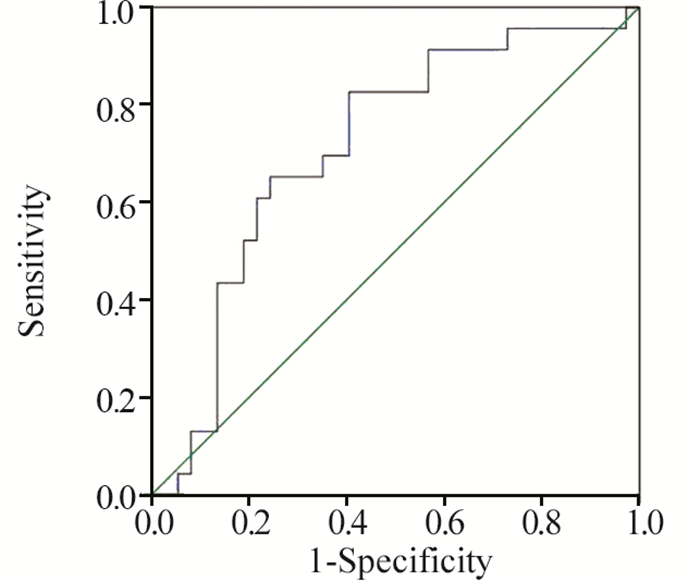
|
| 图 2 应用ROC曲线分析确定对于发生≥2级白细胞降低有预测价值的总受照骨髓V25的截点值 Figure 2 Receiver operating characteristic curves for BM-T V25 associated with grade ≥2 leukopenia |
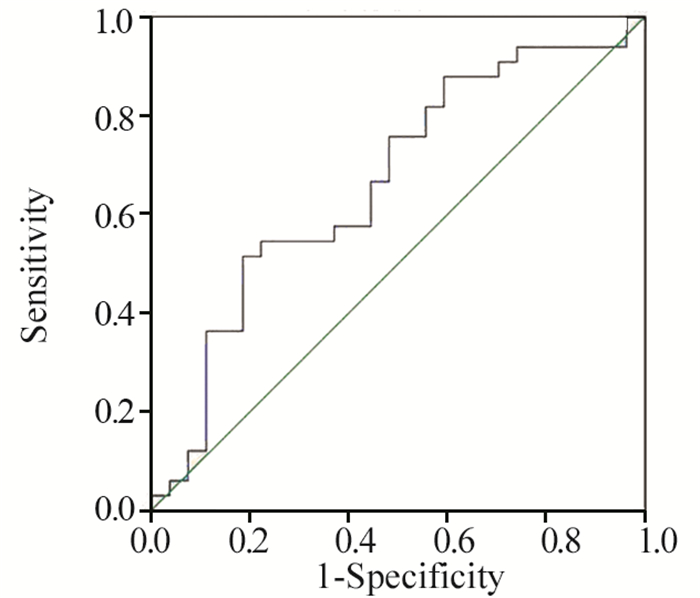
|
| 图 3 应用ROC曲线分析确定对于发生≥2级HT有预测价值的总受照骨髓V25的截点值 Figure 3 Receiver operating characteristic curves for BM-T V25 associated with grade ≥2 HT |
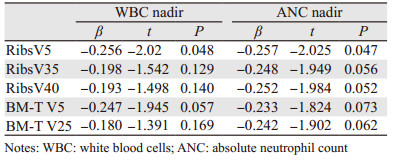
DVH参数与白细胞最低值的单因素线性相关分析结果显示肋骨V5与白细胞最低值负向相关(β=-0.256, P=0.048),总受照骨髓V5也与白细胞最低值存在负向相关倾向(β=-0.247, P=0.057),见表 5;与中性粒细胞最低值的单因素线性相关分析结果显示肋骨V5与中性粒细胞最低值存在负向相关(β=-0.257, P=0.047),肋骨V35(β=-0.248, P=0.056)、V40(β=-0.252,P=0.052)和总受照骨髓V5(β=-0.233, P=0.073)、V25(β=-0.242, P=0.062)也存在此倾向,见表 5。多因素线性相关分析中未发现与白细胞及中性粒细胞最低值存在负向相关的参数。
|
目前大部分学者认为术前放化疗联合手术较单纯手术不仅提高了R0切除率和病理完全缓解率,还能明显改善患者预后。但是同期放化疗期间,不良反应发生率明显增加,尤以血液学毒性最为常见。一旦发生严重血液学毒性,预期治疗将中断直至血细胞恢复正常。因此本文研究骨髓受照剂量与≥2级血液学毒性的关系。
骨髓对放疗十分敏感[15],部分研究证实在盆腔[12-13]和头颈部[16]限定骨髓受量可明显降低同期放化疗期间的急性血液学毒性。淋巴细胞对放疗最为敏感,可以在放疗照射数小时后达到最低点;粒细胞和血小板对放疗中度敏感,照射后2~5周达到最低点;血红蛋白可能在放疗后8~12周也不会出现最低值[17]。有学者表明对于盆腔肿瘤采用调强放疗降低骨髓高剂量受照区体积,反而增加低剂量区体积[18]。部分学者认为降低骨髓的低剂量区体积能够降低急性血液学毒性的发生[12-13, 19]。
Deek等[20]回顾性分析了行同期放化疗的52例局部晚期非小细胞肺癌患者的骨髓DVH参数与急性血液学毒性的关系,结果表明增加胸椎放疗剂量可显著增加3级及以上白细胞降低的发生率,但在胸骨、肋骨、锁骨无此差异;胸椎V20和V30分别是影响白细胞减少的独立危险因素;发现胸椎平均受照剂量<23.9 Gy、胸椎V20≤56%、胸椎V30≤52.1%均能减少3级及以上粒细胞减少的发生。Rose等[21]发现在宫颈癌盆腔放疗联合化疗中,骨髓V10>95%、V20>76%分别与3级及以上白细胞减少及急性血液学毒性发生率显著相关。Mell等[12-13, 22]表明在肛管癌同期放化疗期间提高骨盆的照射剂量会增加血液学毒性的发生率,限制骨髓照射剂量可降低其毒性反应;增加骨盆V5、V10、V15、V20可使白细胞显著减少。本研究结果显示总受照骨髓V25是影响≥2级白细胞降低和≥2级血液学毒性发生的独立危险因素。与上述研究结果基本一致,即减少低剂量区体积能够降低急性血液学毒性的发生率。
本研究还发现肋骨V35是影响≥2级白细胞降低发生的独立危险因素,表明降低骨髓高剂量区照射体积也能减少急性血液学的发生,这与RTOG 0418研究[23]结果相似。该研究纳入83例宫颈癌和子宫内膜癌术后患者,显示在宫颈癌患者中,骨髓V40>37%时约有75%发生≥2级的血液学毒性,而V40<37%仅有40%发生≥2级血液学毒性(P=0.025)。该项研究将V40作为盆腔肿瘤同期放化疗中急性血液学毒性的预测指标。需要指出的是该项研究中骨髓V10<90%仅有12例,这可能是该项研究得出与大部分研究相反结论的一个重要原因。Deek等[20]研究中发现胸骨、肋骨及锁骨与急性血液学毒性的发生无关,这可能与本研究中分析了骨髓受量与≥2级血液学毒性的关系,分析局部晚期非小细胞肺癌患者骨髓受量与血液学毒性的关系,勾画了全部患者的1~10胸椎以及1~10肋骨,且分析了≥3级血液学毒性与骨髓受照剂量的关系;而本研究分析局部进展期食管胃结合部腺癌患者骨髓受量与≥2级血液学毒性的关系,仅勾画出照射范围内的全部骨髓,这可能与本研究发现肋骨V35是影响≥2级白细胞降低发生的独立危险因素。
Deek等[20]分析了骨髓受照剂量及DVH参数与白细胞、中性粒细胞最低值的相关性,发现胸椎V20和V30与白细胞最低值存在负相关性(β=-0.003, P=0.048; β=-0.004, P=0.018),胸椎V30与中性粒细胞最低值存在负相关性(β=-0.005, P=0.031)。Mell等[13]发现增加骨盆骨髓V5-20与白细胞和中性粒细胞最低值存在负相关性。本研究尽管单因素结果发现肋骨V5与白细胞最低值存在负相关性(β=-0.256, P=0.048),肋骨V5与中性粒细胞最低值存在负相关性(β=-0.257, P=0.047),但是多因素结果中未发现与白细胞、中性粒细胞最低值存在负相关的参数。这可能与以下几方面有关:上述大部分研究中化疗方案采用了紫杉醇联合铂类的化疗方案,血液学毒性较重,本研究中治疗方案主要的不良反应为消化道反应;勾画骨髓的范围不同;本研究中大部分患者出现了2级血液学毒性,≥3级血液学毒性的发生率较低;本研究中以骨胳外轮廓代替骨髓,使骨髓的体积增加,降低了两者之间的关联。
另外本研究还存在一些不足之处。首先,本研究仅对骨髓受照剂量参数与≥2级血液学毒性发生率的关系进行的小样本回顾性分析,在患者选择中存在偏倚,两者之间的关系仍需扩大样本量进一步观察。其次,本文仅研究了骨髓受照剂量参数与≥2级血液学毒性发生率的关系,可能增加了两者之间的关联强度。最后,本研究中采用照射范围内胸骨、肋骨及椎骨的外轮廓定义骨髓,这也包含了一些非造血组织,可能也影响了本研究结果。目前此类报道不多,仍需要相关的回顾性和前瞻性研究进行进一步证实。
| [1] | DeMeester SR. Adenocarcinoma of the esophagus and cardia: a review of the disease and its treatment[J]. Ann Surg Oncol, 2006, 13(1): 12–30. DOI:10.1245/ASO.2005.12.025 |
| [2] | Siewert JR, Feith M, Stein HJ. Biologic and clinical variations of adenocarcinoma at the esophago-gastric junction: relevance of a topographic-anatomic subclassification[J]. J Surg Oncol, 2005, 90(3): 139–46. DOI:10.1002/(ISSN)1096-9098 |
| [3] | Urba SG, Orringer MB, Turrisi A, et al. Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma[J]. J Clin Oncol, 2001, 19(2): 305–13. DOI:10.1200/JCO.2001.19.2.305 |
| [4] | Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy with surgery alone for resectable gastroesophageal adenocarcinoma: to FNCLCC and FFCD multicenter phase Ⅲ trial[J]. J Clin Oncol, 2011, 29(13): 1715–21. DOI:10.1200/JCO.2010.33.0597 |
| [5] | Schuhmacher C, Gretschel S, Lordick F, et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European organisation for research and treatment of cancer randomized trial 40954[J]. J Clin Oncol, 2010, 28(35): 5210–8. DOI:10.1200/JCO.2009.26.6114 |
| [6] | Davies AR, Gossage JA, Zylstra J, et al. Tumor stage after neoadjuvant chemotherapy determines survival after surgery for adenocarcinoma of the esophagus and esophagogastric junction[J]. J Clin Oncol, 2014, 32(27): 2983–90. DOI:10.1200/JCO.2014.55.9070 |
| [7] | Zanoni, A, Verlato G, Giacopuzzi S, et al. Neoadjuvant concurrent chemoradiotherapy for locally advanced esophageal cancer in a single high-volume center[J]. Ann Surg Oncol, 2013, 20(6): 1993–9. DOI:10.1245/s10434-012-2822-4 |
| [8] | Anderson EJ, Safran H, Miner T, et al. A phase Ⅱ study of oxaliplatin, docetaxel, and capecitabine in advanced carcinoma of the esophagus and stomach[J]. J Clin Oncol, 2008, 26(15): 753–4. |
| [9] | Pera M, Gallego R, Montagut C, et al. Phase Ⅱ trial of preoperative chemoradiotherapy with oxaliplatin, cisplatin, and 5-Fu in locally advanced esophageal and gastric cancer[J]. Ann Oncol, 2012, 23(3): 664–70. DOI:10.1093/annonc/mdr291 |
| [10] | Shapiro J, van Lanschot JJ, Hulshof MC, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial[J]. Lancet Oncol, 2015, 16(9): 1090–8. DOI:10.1016/S1470-2045(15)00040-6 |
| [11] | Zhao Q, Li Y, Wang J, et al. Concurrent neoadjuvant chemoradiotherapy for siewert ii and iii adenocarcinoma at gastroesophageal junction[J]. American J Med Sci, 2015, 349(6): 472–6. DOI:10.1097/MAJ.0000000000000476 |
| [12] | Mell LK, Schomas DA, Salama JK, et al. Association between bone marrow dosimetric parameters and acute hematologic toxicity in anal cancer patients treated with concurrent chemotherapy and intensity-modulated radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2008, 70(5): 1431–7. DOI:10.1016/j.ijrobp.2007.08.074 |
| [13] | Mell LK, Kochanski JD, Roeske JC, et al. Dosimetric predictors of acute hematologic toxicity in cervical cancer patients treated with concurrent cisplatin and intensity-modulated pelvic radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2006, 66(5): 1356–65. DOI:10.1016/j.ijrobp.2006.03.018 |
| [14] | Hayman JA, Callahan JW, Herschtal A, et al. Distribution of proliferating bone marrow in adult cancer patients determined using FLT-PET imaging[J]. Int J Radiat Oncol Biol Phys, 2011, 79(3): 847–52. DOI:10.1016/j.ijrobp.2009.11.040 |
| [15] | Mauch P, Constine L, Greenberger J, et al. Hematopoietic stem cell compartment: Acute and late effects of radiation therapy and chemotherapy[J]. Int J Radiat Oncol Biol Phys, 1995, 31(3): 1319–39. |
| [16] | McGuire SM, Menda Y, Boles Ponto LL, et al. 3'-deoxy-3'-[18 F] Fluorothymidine PET quantification of bone marrow response to radiation dose[J]. Int J Radiat Oncol Biol Phys, 2011, 81(3): 888–93. DOI:10.1016/j.ijrobp.2010.12.009 |
| [17] | Eric JH, Amato G. Radiobiology for the Radiologist[M]. 5th ed. Philadelphia: Lippincott Williams & Wilkins, 2002: 512. |
| [18] | Desai NB, Stein NF, LaQuaglia MP, et al. Reduced toxicity with intensity modulated radiation therapy (IMRT) for desmoplastic small round cell tumor (DSRCT): an update on the whole abdominopelvic radiation therapy (WAP-RT) experience[J]. Int J Radiat Oncol Biol Phys, 2013, 85(1): e67–72. DOI:10.1016/j.ijrobp.2012.09.005 |
| [19] | Albuquerque K, Giangreco D, Morrison C, et al. Radiation-related predictors of hematologic toxicity after concurrent chemoradiation for cervical cancer and implications for bone marrow-sparing pelvic IMRT[J]. Int J Radiat Oncol Biol Phys, 2011, 79(4): 1043–7. DOI:10.1016/j.ijrobp.2009.12.025 |
| [20] | Deek MP, Benenati B, Kim S, et al. Thoracic vertebral body irradiation contributes to acute hematologic toxicity during chemoradiation therapy for non-small cell lung cancer[J]. Int J Radiat Oncol BiolPhys, 2016, 94(1): 147–54. DOI:10.1016/j.ijrobp.2015.09.022 |
| [21] | Rose BS, Aydogan B, Liang Y, et al. Normal tissue complication probability modeling of acute hematologic toxicity in cervical cancer patients treated with chemoradiothempy[J]. Int J Radiat Oncol Biol Phys, 2011, 79(3): 800–7. DOI:10.1016/j.ijrobp.2009.11.010 |
| [22] | Mell LK, Tiryaki H, Ahn KH, et al. Dosimetric comparison of bone marrow-sparing intensity-modulated radiotherapy versus conventional techniques for treatment of cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 71(5): 1504–10. DOI:10.1016/j.ijrobp.2008.04.046 |
| [23] | Klopp AH, Moughan J, Portelance L, et al. Hematologic Toxicity in RTOG 0418: A Phase 2 Study of Postoperative IMRT for Gynecologic Cancer[J]. Int J Radiation Oncol Biol Phys, 2013, 86(1): 83–90. DOI:10.1016/j.ijrobp.2013.01.017 |
 2017, Vol. 44
2017, Vol. 44


