文章信息
- 女性肺癌和乳腺癌患者中阿瑞匹坦与奥氮平预防多日化疗所致延迟性恶心呕吐的疗效观察
- Aprepitant versus Olanzapine for Prevention of Nausea and Vomiting Induced by Multi-day Chemotherapy in Female Lung Cancer or Breast Cancer Patients
- 肿瘤防治研究, 2017, 44(5): 356-359
- Cancer Research on Prevention and Treatment, 2017, 44(5): 356-359
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.05.009
- 收稿日期: 2016-07-02
- 修回日期: 2016-08-08
2. 434000 荆州,荆州市第三人民医院肿瘤科
2. Department Oncology, Jingzhou NO.3 People's Hospital, Jingzhou 434000, China
化疗所致恶心呕吐(chemotherapy-induced nausea and vomiting, CINV)是常见的化疗相关不良反应,严重影响肿瘤患者的生活质量,并可能导致化疗减量或停药[1]。在女性肿瘤患者中,CINV更明显。伴随5-HT3受体拮抗剂、NK-1受体拮抗剂(如阿瑞匹坦,Aprepitant)的出现,以及奥氮平(Olanzapine)的应用,单日化疗CINV的控制已大大提高[2-4],但在多日化疗中,CINV的控制仍不理想,尤其是延迟期反应。对于延迟期呕吐的处理,不同的指南有不同的推荐,NCCN推荐阿瑞匹坦或奥氮平,而ASCO和MASCC(ESMO)仅推荐阿瑞匹坦[5-6]。目前,奥氮平在化疗所致恶心呕吐中的作用受到越来越多的关注[7-8]。阿瑞匹坦联合地塞米松和5-HT3受体拮抗剂,可有效预防接受高致吐化疗诱导的呕吐,但用于多日(顺铂3天)化疗所致的恶心呕吐,尤其是女性患者的研究不多,而且与奥氮平的费用效益比也不清楚。本研究通过随机对照的方法,评估阿瑞匹坦/奥氮平联合托烷司琼和地塞米松,在3日顺铂化疗的女性肿瘤患者中,两种药物的有效性、安全性和费用效益比是否存在差异。
1 资料与方法 1.1 纳入与排除标准本研究为一项前瞻性随机对照研究。于2014年3月到2016年3月收集病例,纳入标准为接受3日顺铂[25 mg/(m2.day)]基础化疗且从未接受过阿瑞匹坦和奥氮平治疗的女性肿瘤患者。排除标准如下:(1)不能口服药物的患者;(2)脑转移患者;(3)有长期激素使用史者;(4)同时进行放疗者;(5)入组前一周内开始使用阿片类药物或长期服用阿片类药物者;(6)怀孕及哺乳期的妇女;(7)有癫痫病史者;(8)化疗前24 h内已出现呕吐者;(9)同时使用喹诺酮类抗生素者;(10)对5-HT3受体、阿瑞匹坦或奥氮平过敏者;(11)不完全性或完全性肠梗阻患者。
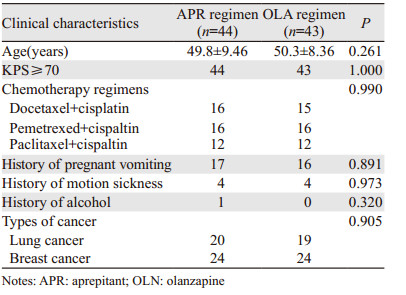
1.2 临床资料本研究共入组87例患者,采用完全随机化分组的方法将患者分为两组,其中阿瑞匹坦组44例,奥氮平组43例。病种为肺癌和乳腺癌,化疗方案包含多西他赛+顺铂、培美曲塞+顺铂、紫杉醇+顺铂。两组患者在年龄、KPS评分、既往妊娠呕吐史、晕车史、饮酒史、化疗方案组成、肿瘤类型方面差异均无统计学意义,见表 1。
阿瑞匹坦组止吐方案:托烷司琼(5 mg静脉推注d1~3)、地塞米松(10 mg静脉推注d1~2, 5 mg静脉推注d3),阿瑞匹坦(125 mg口服d3,80 mg口服d4~5);奥氮平组止吐方案:托烷司琼(5 mg静脉推注d1~3),地塞米松(10 mg静脉推注d1~3),口服奥氮平(10 mg, d3;5 mg, d4~5)。解救用药的选择由参与研究的内科医师自主决定并记录。治疗有效性根据入组患者每日记录情况而实,记录时间从化疗开始算作第1天到第8天结束,并在第8天完成呕吐生活功能指数(functional living index-emesis, FLIE)问卷,记录CINV对生活质量的影响。
1.4 研究终点本研究主要终点为CINV延迟期(化疗后4~8天)完全缓解率(complete response, CR)、两组的不良反应和费用;次要终点为急性期(化疗后0~24 h)和总的完全缓解率,无明显恶心症状患者的比例和生活质量不受CINV影响的患者比例。完全缓解(CR)定义为无呕吐且未使用解救药物。FLIE分数采用专门的测量和统计方法计算,规定总分 > 108分即认为CINV对患者生活质量影响甚微(no impact to daily life, NIDL)。恶心得分采用VAS方法记录,规定 > 3分为明显恶心。
1.5 统计学方法采用SPSS 22.0软件对主要观察指标进行统计分析,分析方法包括描述性分析、t检验,χ2检验等,P < 0.05为差异有统计学意义。
2 结果 2.1 CINV缓解率阿瑞匹坦组44例患者中,有29例(65.9%)在延迟期达到完全缓解,奥氮平组43例患者中,30例(69.8%)患者达到完全缓解,两组比较差异无统计学意义(P=0.690);阿瑞匹坦和奥氮平组未发生明显恶心的患者分别为15例(34.1%)和24例(55.8%),两组差异有统计学意义(P=0.042)。阿瑞匹坦组和奥氮平组总的缓解率分别为56.8%和60.5%,两组比较差异无统计学意义(P=0.730)。两组在急性期的恶心发生率相似,见表 2。
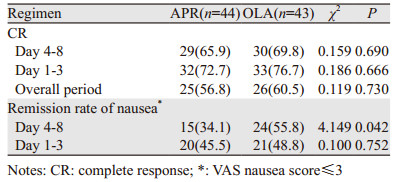 |
在对生活质量的评估方面,FLIE量表得分 > 108分的患者中,阿瑞匹坦组有30例,而奥氮平组有31例。两组中NIDL比例分别为68.2%和72.1%,差异无统计学意义(P=0.690)。
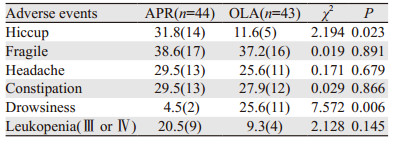
2.3 不良反应排除疾病本身,最常见(≥10%)的不良反应有呃逆、乏力、头痛和便秘。阿瑞匹坦组呃逆发生率高于奥氮平组(31.8% vs. 11.6%, χ2=2.194,P=0.023),乏力、头痛和便秘等不良反应两组之间差异无统计学意义。奥氮平组中嗜睡的发生率明显高于阿瑞匹坦组,两组之间差异有统计学意义(25.6% vs. 4.5%, P=0.006)。其他的血液学毒性两组之间差异无统计学意义,见表 3。
阿瑞匹坦每盒(药品规格:125 mg*1片,80 mg*2片)单价为650元,国产奥氮平每盒(药品规格:10 mg*7片)单价为119元,以上两种药物每周期产生的费用分别为650元和34元。基于本研究中两者CINV缓解率相似,前者的费用明显高于后者(P < 0.01),奥氮平显示出更大的优势。
3 讨论化疗所致的催吐反应可发生于外周通路和中枢通路。外周通路于化疗开始后24小时内激活,主要是引起化疗相关的急性呕吐(化疗后0~24 h发生)。中枢通路主要位于脑部,化疗的第一个24 h后启动,主要与化疗诱导的延迟呕吐相关。在中枢神经系统中,P物质是激活神经激肽-1(NK-1)受体的主要神经递质[9-10]。
奥氮平是一种非典型抗精神病药,用于治疗精神分裂症和双相情感障碍。通过与多巴胺(D1-D5、5-HT2A、5-HT2C、5-HT3、5-HT6)、毒蕈碱、α-肾上腺素和组胺H1受体高亲和力结合,参与抑制CINV。进一步研究证实,延迟性呕吐可能是由于NK-1受体与5-HT3受体之间的串扰,抑制其中一个受体-配体的活化,从而影响其他受体通路的信号,但确切机制尚不清楚[9-10]。
顺铂(DDP)是一种高度致吐风险的化疗药物,且具有显著的导致延迟性恶心呕吐的特点,在女性患者中更为突出,对其心理和生活功能产生影响[11]。在国内临床应用中,肺癌及乳腺癌含DDP的双药联合化疗中,DDP通常分次给药,以分3~4天给药多见;由于第一天到最后一天化疗之间,急性和延迟性呕吐可以重叠,因此止吐方案尚无标准。阿瑞匹坦是第一种获批的NK-1受体拮抗剂,其在高致吐风险单日化疗中预防延迟CINV的疗效已经在很多研究中被证实[12-14]。对于含DDP的多日化疗,应用阿瑞匹坦预防CINV也已有一些研究。Albany等[15]的研究中,使用阿瑞匹坦联合方案用于预防生殖细胞肿瘤5天顺铂方案的CINV。结果显示,阿瑞匹坦的完全缓解率较安慰剂组显著提高(42% vs. 13%),且在急性期、延迟期均有提高。
本研究发现,阿瑞匹坦在延迟期CINV的效果与奥氮平相似,能够显著提高CINV缓解率,并有效降低恶心的发生率,从而改善患者因CINV导致的生活质量下降,这与单日化疗中的结果相似。2014年,奥氮平被整合进入NCCN止吐指南。一项Ⅲ期临床试验,在顺铂或阿霉素加环磷酰胺治疗的患者中,比较奥氮平与阿瑞匹坦(两者与帕洛诺司琼-地塞米松联合)用于CINV的效果。奥氮平控制化疗所致的急性(0~24 h)和延迟性呕吐(25~120 h),和总时期(0~120 h)的疗效类似于阿瑞匹坦。值得注意的是,在该研究中奥氮平控制延迟期恶心更有效[16],这也与本研究结果相一致。
在安全性方面,没有观察到累积或者是非预期的药物毒性。排除疾病本身特点,当前治疗方案中最常见的不良反应有呃逆、乏力、头痛和便秘,阿瑞匹坦组呃逆发生率更高,其余不良反应两组相似;而奥氮平导致的嗜睡作用更明显。其他的血液学毒性两组之间无明显差异,临床应用较安全。在费用方面,阿瑞匹坦明显高于奥氮平,因为前者是专利进口药物,国内上市时间不长;而奥氮平可谓“老药新用”,已在国内上市多年,国内生产工艺成熟。因此,作为非发达国家,奥氮平具有更大优势。
总之,本研究显示了阿瑞匹坦与奥氮平联合托烷司琼、地塞米松在顺铂多日化疗中具有相似的有效性和安全性。但是,本研究局限于小样本量,之后我们会扩大样本量进行双盲临床试验来进一步证实。
| [1] | Yuan DM, Li Q, Zhang Q, et al. Efficacy and Safety of Neurokinin-1 Receptor Antagonists for Prevention of Chemotherapy-Induced Nausea and Vomiting: Systematic Review and Meta-analysis of Randomized Controlled Trials[J]. Asian Pac J Cancer Prev, 2016, 17(4): 1661–75. DOI:10.7314/APJCP.2016.17.4.1661 |
| [2] | 董爽, 于世英. 肿瘤化疗所致恶心呕吐现状调查[J]. 中国循证医学杂志, 2013, 13(6): 687–91. [ Dong S, Yu SY. Status survey on chemotherapy-induced nausea and vomiting[J]. Zhongguo Xun Zheng Yi Xue Za Zhi, 2013, 13(6): 687–91. DOI:10.7507/1672-2531.20130122 ] |
| [3] | Navari RM, Aapro M. Antiemetic Prophylaxis for Chemotherapy-Induced Nausea and Vomiting[J]. N Engl J Med, 2016, 374(14): 1356–67. DOI:10.1056/NEJMra1515442 |
| [4] | Grunberg SM, Dugan M, Muss H, et al. Effectiveness of a single-day three-drug regimen of dexamethasone, palonosetron, and aprepitant for the prevention of acute and delayed nausea and vomiting caused by moderately emetogenic chemotherapy[J]. Support Care Cancer, 2009, 17(5): 589–94. DOI:10.1007/s00520-008-0535-9 |
| [5] | Multinational Association of Supportive Care in Cancer.A Mascc/Esmo Antiemetic Guideline Version 1.2 2016[EB/OL].[2016-03-26].http://www.mascc.org/assets/Guidelines-Tools/masccantiemetic guidelines English 2016 v.1.2.pdf. |
| [6] | NCCN.Clinical Practice Guidelines in Oncology: antiemesis Version 2.2016 [EB/OL].[2016-04-15].https://www.nccn.org/professionals/physician_gls/pdf/antiemesis.pdf. |
| [7] | DeRemer DL, Clemmons AB, Orr J, et al. Emerging role of olanzapine for prevention and treatmentof chemotherapy-induced nauseaand vomiting[J]. Pharmacotherapy, 2016, 36(2): 218–29. DOI:10.1002/phar.2016.36.issue-2 |
| [8] | Navari RM, Nagy CK, Gray SE. The use of olanzapine versus metoclopramide for the treatment of breakthrough chemotherapy-induced nausea and vomiting in patients receiving highly emetogenic chemotherapy[J]. Support Care Cancer, 2013, 21(6): 1655–63. DOI:10.1007/s00520-012-1710-6 |
| [9] | Roscoe JA, Heckler CE, Morrow GR, et al. Prevention of delayed nausea: a University of Rochester Cancer Center Community Clinical Oncology Program study of patients receiving chemotherapy[J]. J Clin Oncol, 2012, 30(27): 3389–95. DOI:10.1200/JCO.2011.39.8123 |
| [10] | Hesketh PJ. Chemotherapy-induced nausea and vomiting[J]. N Engl J Med, 2008, 358(23): 2482–94. DOI:10.1056/NEJMra0706547 |
| [11] | Fernández-Ortega P, Caloto MT, Chirveches E, et al. Chemotherapy-induced nausea and vomiting in clinical practice: impact on patients' quality of life[J]. Support Care Cancer, 2012, 20(12): 3141–8. DOI:10.1007/s00520-012-1448-1 |
| [12] | Gao HF, Liang Y, Zhou NN, et al. Aprepitant plus palonosetron and dexamethasone for prevention of chemotherapy-induced nausea and vomiting in patients receiving multiple-day cisplatin chemotherapy[J]. Intern Med J, 2013, 43(1): 73–6. DOI:10.1111/j.1445-5994.2011.02637.x |
| [13] | Olver IN, Grimison P, Chatfield M, et al. Results of a 7-day aprepitant schedule for the prevention of nausea and vomiting in 5-day cisplatin-based germ cell tumor chemotherapy[J]. Support Care Cancer, 2013, 21(6): 1561–8. DOI:10.1007/s00520-012-1696-0 |
| [14] | Gralla RJ. Palliative care: Aprepitant and control of emesis induced by 5-day chemotherapy[J]. Nat Rev Clin Oncol, 2012, 9(11): 614–6. DOI:10.1038/nrclinonc.2012.183 |
| [15] | Albany C, Brames MJ, Fausel C, et al. Randomized, double-blind, placebo-controlled, phase iii cross-over study evaluating the oral neurokinin-1 antagonist and dexamethasone in patients with germ cell tumors receiving 5-day cisplatin combination chemotherapy regimens: a hoosier oncology group study[J]. J Clin Oncol, 2012, 30(32): 3998–4003. DOI:10.1200/JCO.2011.39.5558 |
| [16] | Navari RM, Gray SE, Kerr AC. Olanzapine versus aprepitant for the prevention of chemotherapy-induced nausea and vomiting: a randomized phase Ⅲ trial[J]. J Support Oncol, 2011, 9(5): 188–95. DOI:10.1016/j.suponc.2011.05.002 |
 2017, Vol. 44
2017, Vol. 44