文章信息
- 口服依托泊苷治疗难治性转移性乳腺癌的疗效及安全性
- Efficacy and Safety of Oral Etoposide on Heavily Pretreated Metastatic Breast Cancer
- 肿瘤防治研究, 2017, 44(5): 347-350
- Cancer Research on Prevention and Treatment, 2017, 44(5): 347-350
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.05.007
- 收稿日期: 2016-11-15
- 修回日期: 2017-02-04
乳腺癌是女性最常见的恶性肿瘤之一,且发病率呈上升趋势。转移性乳腺癌的治疗主要以药物治疗为主,目的是改善生活质量、延长生存期。蒽环和紫杉类药物是乳腺癌常用化疗药物,卡培他滨、长春瑞滨、吉西他滨等主要用于蒽环和紫杉类药物治疗失败的转移性乳腺癌。对于三线以上治疗失败的患者,目前无最佳的化疗方案,乳腺癌诊治指南推荐给予此类患者最佳支持治疗或参与临床试验[1]。
口服依托泊苷(拉司太特胶囊,日本化药株式会社)是从足叶乙甙(鬼臼脂,Podophyllin)中分离出的木脂体类有效成份,为细胞周期特异性抗肿瘤药物,作用于S期或G2期,其作用位点是拓扑异构酶Ⅱ,通过致使受损的DNA不能修复而起到抗肿瘤作用[2]。目前虽然广泛用于小细胞肺癌的治疗,但近期国外几项临床试验报道了口服依托泊苷治疗转移性乳腺癌获得了较好的疗效和安全性[3-6],而国内类似的报道较少,因此我们对此进行了研究。
1 资料与方法 1.1 患者纳入标准(1)经病理组织学证实的术后复发转移或确诊时无法手术的Ⅳ期乳腺癌患者;(2)年龄为18~80岁;(3)按照实体肿瘤的疗效评价标准(response evaluation criteria in solid tumors, RECIST1.1)至少有1个可测量的病灶;(4)美国东部肿瘤协作组(eastern cooperative oncology group, ECOG)体能状态评分≤2;(5)预计生存期≥3月;(6)重要脏器功能基本正常,化疗前血常规以及肝肾功能基本正常,无化疗禁忌证;(7)晚期难治性乳腺癌定义为转移后经二线以上化疗失败者或既往蒽环、紫杉类药物和卡培他滨均治疗失败者。
1.2 临床资料收集2009年2月—2016年6月北京大学肿瘤医院乳腺内科收治的转移性乳腺癌88例,均采用口服依托泊苷单药化疗。中位年龄56.5岁(范围33~78岁)。所有患者经病理学证实为乳腺癌,其中浸润性导管癌80例(91.0%),浸润性小叶癌5例(6.3%),其他类型3例(黏液腺癌、化生性癌、髓样癌各1例)。本组患者中,激素受体阳性且HER2阴性(HR+/HER2-)者45例(51.1%),激素受体阳性且HER2阳性(HR+/HER2+)者8例(9.1%),激素受体阴性且HER2阳性(HR-/HER2+)者9例(10.2%),三阴性(HR-/HER2-)者26例(29.5%)。本研究纳入的17例HER2阳性(HR+/HER2+和HR-/HER2+)患者均因经济原因或既往多线抗HER2治疗联合化疗治疗失败,在本次研究中均未采用抗HER2治疗。
53例激素受体阳性(HR+/HER2-和HR+/HER2+)患者中,46例在复发转移阶段曾接受过内分泌治疗,治疗药物包括:依西美坦(27例)、来曲唑(22例)、阿那曲唑(13例)、他莫昔芬/托瑞米芬(13例)、甲羟孕酮(6例)、氟维司群(5例)和依维莫司联合来曲唑(1例)。其余7例患者因为存在内脏危象或辅助内分泌治疗效果差,在复发转移阶段未进行内分泌治疗。内分泌治疗中位治疗线数为2,(范围1~5线),24例患者曾接受过≥2线内分泌治疗。
本组资料中,最常见的转移部位包括骨45例(51.1%),肝43例(48.9%),肺41例(45.6%),脑6例(6.8%)。大部分患者既往曾行蒽环类、紫杉类药物和卡培他滨治疗,其中78.4%(69/88)患者均用上述三种药物治疗过。26例(29.5%)患者为≥5线治疗。具体临床资料见表 1。
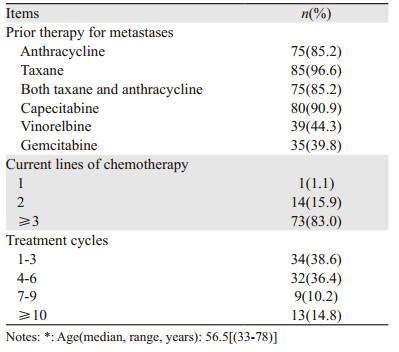 |
口服依托泊苷(拉司太特胶囊,日本化药株式会社)50 mg/d, d1~20,每28天为一周期。每两周期进行疗效评价。使用依托泊苷至肿瘤进展或出现不能耐受的不良反应。
1.4 疗效及不良反应判定所有可测量病灶均有化疗前的基线测量,每两周期进行影像学检查测量。按照RECIST1.1标准分为:完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶长径总和缩小≥30%;疾病进展(PD):基线病灶长径总和增加超过20%,最小绝对值升高5 mm,或出现新病灶;疾病稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。客观缓解率(ORR)=CR+PR,疾病控制率(DCR)=CR+PR+SD;临床获益率(CBR)=CR+PR+SD≥6月;无进展生存(PFS):开始治疗至第一次发生PD或任何原因死亡的时间间隔。总生存(OS)从化疗开始之日起至死亡或末次随访之日止。不良反应按美国国立癌症研究所不良反应事件通用术语标准(national cancer institute-common terminology criteria for adverse events, NCI-CTC4.0)判定分为0~4级。
1.5 随访截至2016年10月,88例患者中,87例已经结束依托泊苷治疗,并观察到无进展生存(PFS),1例患者继续治疗中。88例患者中,60例患者已经死亡,并随访到死亡日期。
1.6 统计学方法所有数据均采用SPSS15.0软件进行统计学分析,患者临床特征采用描述性统计分析进行评价,频数分布资料的比较采用χ2检验。用Kaplan-Meier法绘制生存曲线,运用Log rank检验进行显著性分析。
2 结果 2.1 口服依托泊苷治疗情况患者均行至少2周期的口服依托泊苷治疗,平均为6周期,中位治疗周期数为5。13例(14.8%)患者进行了≥10周期的治疗,其中1例患者进行了37周期的治疗。疾病控制(CR+PR+SD)的患者,中位治疗周期数为6,中位持续治疗时间为7.0月(95%CI: 5.8~8.2月)。
2.2 疗效88例患者均可评价疗效,其中部分缓解(PR)7例(8.0%),疾病稳定(SD)50例(56.8%),疾病进展(PD)31例(35.2%),无完全缓解(CR)患者。客观缓解率(CR+PR)为8.0%,疾病控制率(CR+PR+SD)为64.8%,临床获益率(CR+PR+SD≥6.0月)为44.3%,见表 2。整体的中位无进展生存期(PFS)为5.0月(95%CI: 3.8~6.2月),见图 1,中位生存期(OS)为17.0月(95%CI: 11.3~22.7月),见图 2。
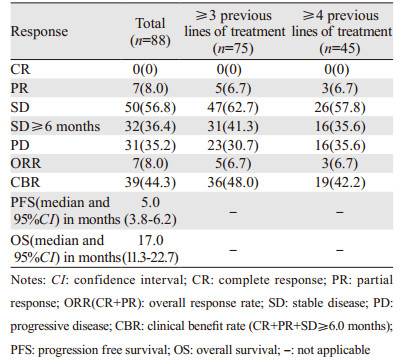 |
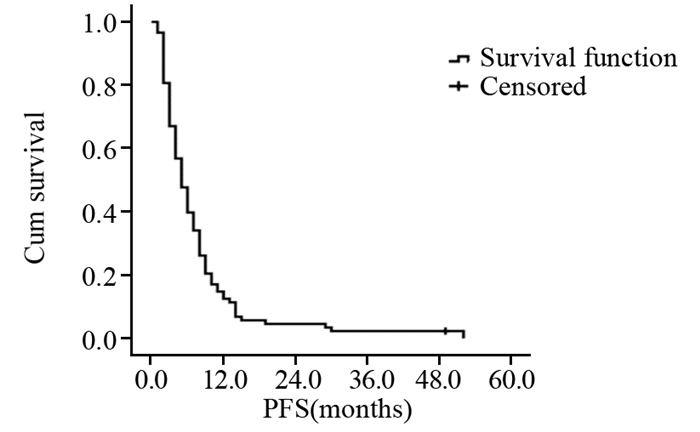
|
| 图 1 88例转移性乳腺癌患者无进展生存期 Figure 1 PFS of 88 patients with metastasis breast cancer |
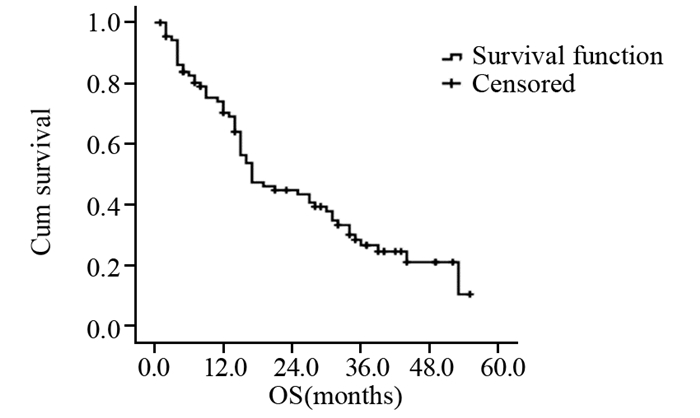
|
| 图 2 88例转移性乳腺癌患者总生存期 Figure 2 OS of 88 patients with metastasis breast cancer |
对不同亚型的乳腺癌患者进行分析,结果显示,HR+/HER2-组,HR+/HER2+组,HR-/HER2+组,三阴性组,这4种分型的患者PFS(P=0.290)和OS(P=0.205)差异均无统计学意义,见图 3。
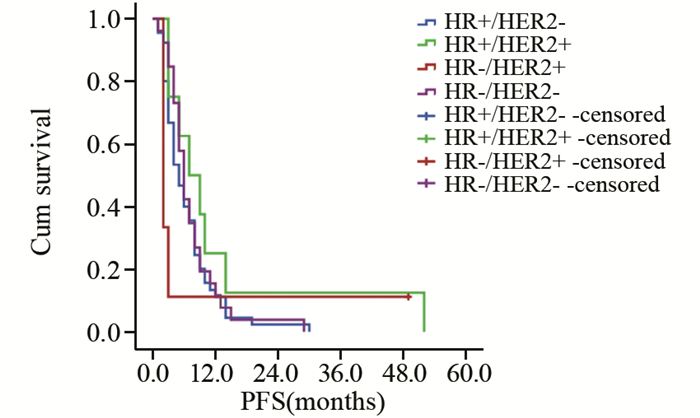
|
| 图 3 不同亚型转移性乳腺癌患者无进展生存期 Figure 3 PFS of patients with different subtype metastasis breast cancer |
主要不良反应为1~2级恶心18例(20.5%)和中性粒细胞减少22例(25.0%),其中发生1~2级中性粒细胞减少者19例(21.6%),3级3例(3.4%);其他不良反应包括乏力11例(12.5%)、肝功能增高15例(17.0%)和贫血7例(8.0%),均为1~2级,见表 3。
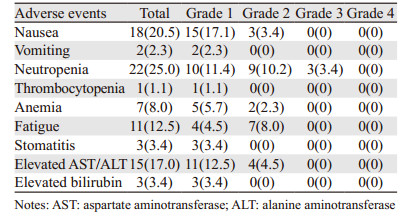 |
依托泊苷为细胞周期特异性抗肿瘤药物,包括静脉剂型和口服剂型,由于疗效相当,且使用方便,口服依托泊苷经常应用在恶性肿瘤治疗中。研究显示作用于S期或G2期,其作用位点是拓扑异构酶Ⅱ,通过致使受损的DNA不能修复而起到抗肿瘤作用[7]。
多项Ⅱ期临床研究均报道口服依托泊苷能够有效治疗转移性乳腺癌。国外研究报道,在一线治疗中,口服依托泊苷的客观有效率(CR+PR)能够达到33.3%(6例/18例)[8]。Bontenbal等[9]报道在二线治疗中,客观有效率为10%(2例/21例)。Martin等[10]报道,在复发转移后曾接受过化疗的患者,口服依托泊苷的客观有效率也能达到35%。但上述几项临床研究均诞生于上世纪九十年代,由于当时化疗药物选择局限,不能反应当下临床治疗的实际情况,并且在这些临床研究中,观察终点仅有效率和安全性的评价,而无疾病进展时间,总生存期等评价指标。另一项回顾性研究显示,口服依托泊苷治疗多线治疗失败的转移性乳腺癌,客观有效率可达25%,中位PFS为5.0月,提示该药可作为难治性乳腺癌的一种治疗选择[11]。近期,我国学者报道了一项口服依托泊苷治疗蒽环、紫杉类药物治疗失败的转移性乳腺癌Ⅱ期临床研究结果,客观有效率为9.3%,中位PFS为4.5月(范围1.3~7.7月)[12]。与该研究结果相似,本研究客观有效率为6.2%,中位PFS为6.0月(95%CI: 4.7~7.3月)。
随着治疗理念和药物的发展,转移性乳腺癌患者治疗药物的选择更加广泛,生存期明显延长。尽管如此,多线治疗失败的转移性乳腺癌目前仍是治疗的难点,这类患者多数曾接受过蒽环类、紫杉类、卡培他滨、长春瑞滨、吉西他滨等化疗药物治疗失败,再选择进一步的化疗通常有效率低,耐受性差,只能选择对症支持治疗。甲磺酸艾日布林是软海绵素经结构优化后的大环酮类似物,通过抑制微管蛋白聚合发挥抗肿瘤作用。该药关键性Ⅲ期临床研究(EMBRACE研究)纳入762例多线治疗失败的转移性乳腺癌(既往经过中位4线治疗,范围2~7线)结果显示,甲磺酸艾日布林治疗组的总生存期为13.1月,显著高于对照组(医生的治疗选择)10.6月(P=0.04)[13]。被美国FDA批准用于临床治疗至少接受过两种化疗方案(含蒽环和紫杉类药物)的转移性乳腺癌,但该药尚未在中国上市。本研究纳入患者中经过3线及3线以上治疗者73例(83.0%),中位生存期为17.0月。因此,口服依托泊苷可以为多线治疗失败的患者,特别是中国患者提供的一种新的治疗选择。但其是否值得在临床中广泛应用,尚待大规模随机、对照临床研究证实。
在Ⅱ期研究中口服依托泊苷的剂量通常为50 mg/m2,每日1次,口服1~21天,28天为1周期。国外学者认为,对于多线治疗失败的转移性乳腺,从安全性和保证生活质量的角度出发,口服依托泊苷可以采用50 mg每天,口服1~20天,28天重复,该剂量不仅疗效好,并且耐受性好[6]。本研究也是采用该治疗剂量,患者耐受性较好,无患者因为不良反应而中断治疗。
对于多线治疗失败的难治性乳腺癌目前缺乏有效的治疗药物和手段,口服依托泊苷治疗此类患者能够取得一定疗效,并且经济、方便、耐受性好。
| [1] | National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: breast cancer (NCCN evidence blocks)., V.1.2016[EB/OL]. [2015-11-18].http://www.nccn.org/professionals/physician_gls/pdf/breast_blocks.pdf. |
| [2] | Clark PI, Slevin ML. The clinical pharmacology of etoposide and teniposide[J]. Clin Pharmacokinet, 1987, 12(4): 223–52. DOI:10.2165/00003088-198712040-00001 |
| [3] | Atienza DM, Vogel CL, Trock B, et al. Phase Ⅱ study of oral etoposide for patients with advanced breast cancer[J]. Cancer, 1995, 76(12): 2485–90. DOI:10.1002/(ISSN)1097-0142 |
| [4] | Jagodic M, Cufer T, Zakotnik B, et al. Selection of candidates for oral etoposide salvage chemotherapy in heavily pretreated breast cancer patients[J]. Anticancer Drugs, 2001, 12(3): 199–204. DOI:10.1097/00001813-200103000-00004 |
| [5] | Saphner T, Weller EA, Tormey DC, et al. 21-day oral etoposide for metastatic breast cancer: a phase Ⅱ study and review of the literature[J]. Am J Clin Oncol, 2000, 23(3): 258–62. DOI:10.1097/00000421-200006000-00010 |
| [6] | Valabrega G, Berrino G, Milani A, et al. A retrospective analysis of the activity and safety of oral Etoposide in heavily pretreated metastatic breast cancer patients[J]. Breast J, 2015, 21(3): 241–5. DOI:10.1111/tbj.2015.21.issue-3 |
| [7] | Hande KR. Etoposide: four decades of development of a topoisomerase Ⅱ inhibitor[J]. Eur J Cancer, 1998, 34(10): 1514–21. DOI:10.1016/S0959-8049(98)00228-7 |
| [8] | Nesković-Konstantinović ZB, Bosnjak SM, Radulović SS, et al. Daily oral etoposide in metastatic breast cancer[J]. Anticancer Drugs, 1996, 7(5): 543–7. DOI:10.1097/00001813-199607000-00009 |
| [9] | Bontenbal M, Planting AS, Verweij J, et al. Second-line chemotherapy with long-term low-dose oral etoposide in patients with advanced breast cancer[J]. Breast Cancer Res Treat, 1995, 34(2): 185–9. DOI:10.1007/BF00665790 |
| [10] | Martin M, Lluch A, Casado A, et al. Clinical activity of chronic oral etoposide in previously treated metastatic breast cancer[J]. J Clin Oncol, 1994, 12(5): 986–91. DOI:10.1200/JCO.1994.12.5.986 |
| [11] | Yuan P, Xu BH, Wang JY, et al. Oral etoposide monotherapy is effective for metastatic breast cancer with heavy prior therapy[J]. Chin Med J (Engl), 2012, 125(5): 775–9. |
| [12] | Yuan P, Di L, Zhang X, et al. Efficacy of oral Etoposide in pretreated metastatic breast cancer: a multicenter phase 2 study[J]. Medicine (Baltimore), 2015, 94(17): e774. DOI:10.1097/MD.0000000000000774 |
| [13] | Cortes J, O'Shaughnessy J, Loesch D, et al. Eribulin monotherapy versus treatment of physician's choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomized study[J]. Lancet, 2011, 377(9769): 914–23. DOI:10.1016/S0140-6736(11)60070-6 |
 2017, Vol. 44
2017, Vol. 44


