文章信息
- Ⅱ和Ⅲ期胸段食管鳞癌术后不同辅助治疗方式治疗后的失败模式分析
- Patterns of Failure After Radical Surgery on Patients with StageⅡ/Ⅲ Thoracic Esophageal Squamous Cell Carcinoma
- 肿瘤防治研究, 2017, 44(5): 340-346
- Cancer Research on Prevention and Treatment, 2017, 44(5): 340-346
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.05.006
- 收稿日期: 2016-11-04
- 修回日期: 2017-02-24
2. 050011 石家庄,石家庄第一医院影像科;
3. 621000 绵阳,绵阳市第三人民医院放疗科
2. Department of Radiation, The First Hospital of Shijiazhuang, Shijiazhuang 050011, China;
3. Department of Radiation Oncology, The Third Hospital of Mianyang, Mianyang 621000, China
食管癌是我国消化道常见恶性肿瘤之一,国内可手术切除的食管癌的主要治疗模式仍以局部手术为主,术后辅助放(化)疗。胸腔内-区域复发和(或)远处转移为食管癌治疗后的主要失败模式。目前,关于食管癌术后和术后辅助放化疗的文章较多见,但有关术后食管癌患者接受辅助性治疗后的失败模式的报道并不多见,而了解此模式对指导患者的后续治疗和预测预后等均有重要的作用,因此,我们就Ⅱ/Ⅲ期胸段食管鳞癌术后不同辅助方式治疗后的失败模式进行了分析。
1 资料与方法 1.1 临床资料2007年1月至2010年12月在河北医科大学第四医院胸外科行根治性手术切除的食管癌患者共2 856例,收集其中Ⅱ/Ⅲ期术后患者216例,其中术后放疗(postoperative radiotherapy, PORT)115例,术后辅助性放化疗(postoperative chemoradiotherapy, POCRT)101例,另从单纯手术组患者中选取252例Ⅱ/Ⅲ期患者进行对比分析,共计468例。其中男342例、女126例;年龄37~75岁,中位年龄59岁;胸上、中、下段食管癌分别为55、328、85例。依据UICC2002年食管癌分期,T1、T2、T3及T4期患者分别为14、78、342和34例,N0和N1期患者分别为185和283例,病理Ⅱa、Ⅱb及Ⅲ期患者分别为157、46和265例。术后残端阳性38例,脉管瘤栓26例。术中记录患者病变长度者463例。216例术后辅助治疗的患者中,171例接受三维适形放疗(3D-CRT),45例接受调强放疗(IMRT)。本组所有患者的临床资料的构成比差异未见统计学意义(P > 0.05),见表 1。
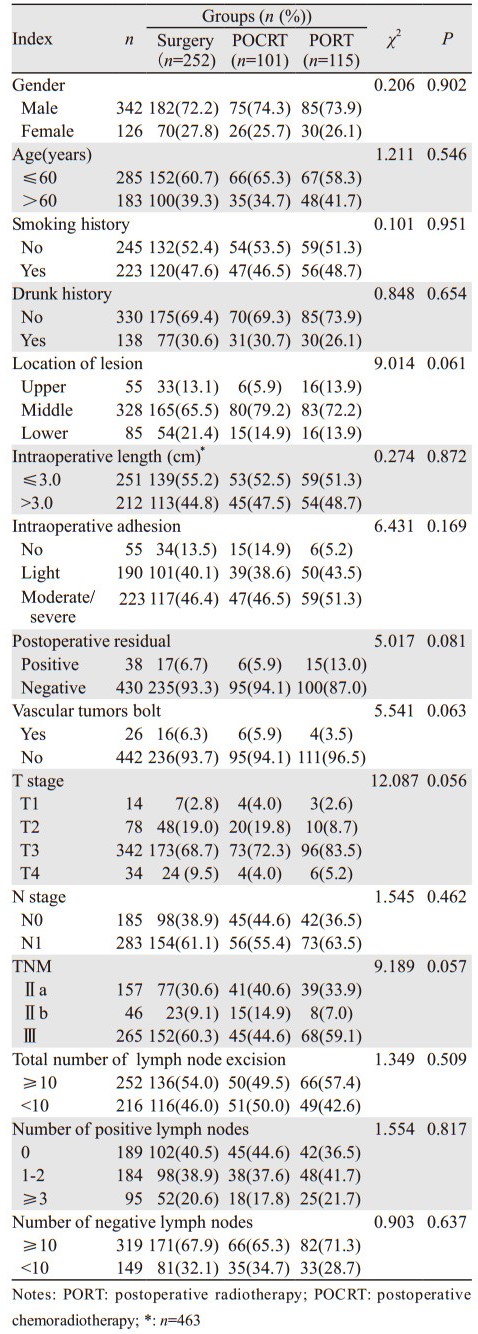 |
术式为左侧开胸426例,右侧开胸13例,颈部+上腹9例,颈部+胸部+上腹20例;术后病理证实淋巴结阳性患者283例(60.5%),手术中共摘除淋巴结4 481枚,其中阳性淋巴结个数为668枚,转移度为14.9%,手术清扫淋巴结个数为0~30枚,中位数10枚。
1.2.2 术后预防性放疗(1)热塑体膜固定体位,CT扫描模拟定位,图像经数字化传输,三维重建进入计划系统;(2)CTV依据肿瘤部位不同范围包括原瘤床+相应淋巴引流区划分,胸上段癌包括双侧锁骨上、食管旁、2区、4区、5区及7区,至隆突下3.0~4.0 cm的范围;胸中段癌包括食管旁、2区、4区、5区、7区、8区、9区及贲门旁;胸下段癌包括食管旁、4区、5区、7区、8区、9区、贲门旁、胃左及腹腔干旁淋巴引流区。在CTV基础上外放0.5~0.8 cm形成PTV;(3)95%PTV接受剂量为50~60 Gy,1.8~2.0 Gy每次,5次/周;(4)脊髓Dmax≤45 Gy,双肺V5≤60%、V20≤28%~30%、V30≤18%~20%,心脏V30≤40%、V40≤30%;(5)手术与术后放疗时间间隔为26~90天,间隔时间中位值为38天。所有患者均按计划完成放疗。
1.2.3 化学治疗全组进行过术后放化疗的216例患者中,术后接受联合化疗101例,化疗疗程为1~6周期,中位3周期;化疗方案以“顺铂”为基础,主要有“LFP(亚叶酸钙200 mg每次,第1~5天,替加氟每次1 g,第1~5天;顺铂20 mg每次,第1~5天)”和“TP(紫杉醇240 mg每次,第1天;顺铂20 mg每次,第1~5天)”;化疗期间辅助止吐、增强免疫力及扶正等支持治疗。101例患者同步放化疗39例,余62例为序贯放化疗。
1.3 术后失败诊断标准失败部位及时间通过我院定期复查病例资料所确定,包括手术记录、影像学报告(CT、MRI及ECT等)、病理和细胞学的报告等。
复发类型:(1)胸腔内-区域失败:胸腔内失败指纵隔淋巴结转移、原食管瘤床复发、吻合口复发;区域失败根据国际抗癌联盟2009年分期标准中区域淋巴结范围制定,包括锁骨上淋巴结转移和腹腔淋巴结转移(如胃左和肝总、脾门及腹腔动脉周围淋巴结);(2)远处转移:肝、肺、骨、皮下转移,胸膜及其他部位淋巴结转移 (如腋下、腹股沟淋巴结转移)。
1.4 淋巴结阳性诊断标准浅表部位肿大淋巴结多数经细胞学或术后病理证实;其余部位淋巴结依据CT诊断,诊断标准:(1)淋巴结轴面短径≥1.0 cm,对照标准轴面短径≥0.8 cm,特殊部位如食管旁、气管食管沟淋巴结短径≥0.5 cm,3个以上的淋巴结聚集“成团”或“成簇”;(2)淋巴结较小但其形态不规整、中央出现低密度坏死灶;(3)淋巴结包膜侵犯与周边脂肪间隙缺乏分界。
1.5 随访全组患者随访截至2015年12月31日。患者第1年每3~6月复查一次,随后每6~12月复查一次,其中有14例患者未能继续规律复查或失访,随访率为97.0%,失访病例以最后实际随访日期作为删失值。随访满1、3、5年者分别为401、227及173例,截至随访日期共死亡323例患者。
1.6 统计学方法统计学分析采用SPSS19.0软件进行,临床资料与失败构成比的比较行卡方检验。P < 0.05为差异有统计学意义。
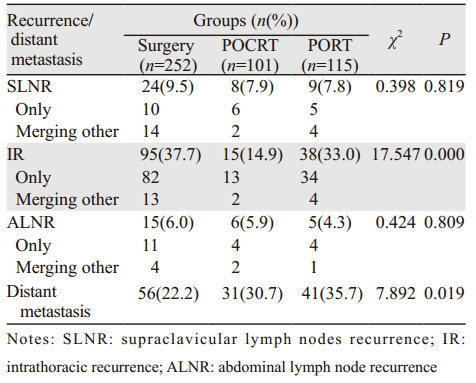
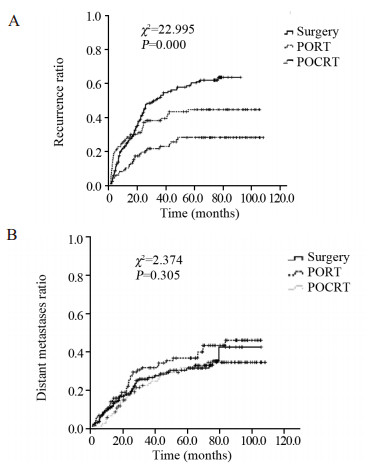
2 结果 2.1 患者失败模式分析结果全组468例患者出现胸腔-区域复发191例(40.8%),出现胸腔-区域复发的时间为1.0~75.3月,中位12.0月;出现远处转移128例(27.4%),出现远处转移的时间为1.1~83.2月,中位18.2月;其中胸腔-区域复发合并远处转移58例。单纯手术组患者1、3、5年复发率及远处转移率分别为24.2%、52.3%、59.9%和10.2%、25.9%、30.8%;POCRT组患者1、3、5年复发率及远处转移率分别为9.9%、22.7%、27.9%和6.0%、22.9%、31.0%;PORT组患者1、3、5年复发率及远处转移率分别为27.1%、37.9%、44.3%和13.2%、31.0%、36.0%,三组患者的复发率比较差异有统计学意义(P=0.000),而远处转移率差异未见统计学意义(P=0.305),见图 1。
|
| 图 1 食管癌术后不同辅助治疗模式治疗后的各组复发率 (A) 及远处转移率 (B) Figure 1 Chest-regional recurrence (A) and distant metastasis (B) curves of different treatment models |
单纯手术组患者出现胸腔-区域复发率为46.8%(118/252),远处转移率为22.2%(56/252);其中复发合并远处转移28例,在远处转移的病例中有14例出现肺转移,占全部远处转移的25.0%(14/56)。POCRT组患者出现胸腔-区域复发率为25.7%(26/101),远处转移率为30.7(31/101);其中复发合并远处转移11例,在远处转移的病例中有17例出现肺转移,占全部远处转移的54.8%(17/31)。PORT组患者出现胸腔-区域复发率为40.9%(47/115),远处转移率为35.7%(41/115),其中复发合并远处转移16例,在远处转移的病例中有20例出现肺转移,占全部远处转移的48.8%(20/41)。三组患者相比,其胸腔内复发率各组间差异有统计学意义(χ2=17.547, P=0.000);与POCRT和PORT相比,单纯手术组患者远处转移率显著较低(χ2=7.892, P=0.019),见表 2。
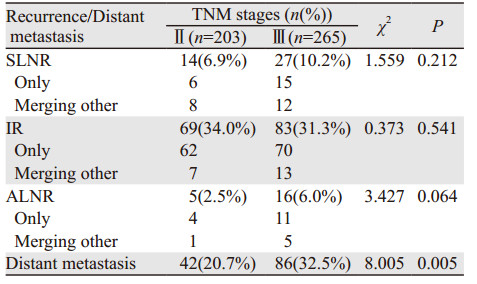
Ⅱ期患者胸腔-区域复发率为39.4%(80/203),远处转移率为20.7%(42/203),其中复发合并远处转移28例,在远处转移的病例中有52.3%(22/42)出现肺转移;Ⅲ期患者胸腔-区域复发率为41.9%(111/265),远处转移率为32.5%(86/265),其中复发合并远处转移36例,在远处转移的病例中有32.6%(28/86)出现肺转移。Ⅱ、Ⅲ期患者间胸腔-区域复发率差异未见统计学意义(P > 0.05),Ⅲ期较Ⅱ期患者有较高的血行转移率(P=0.005),见表 3。
 |
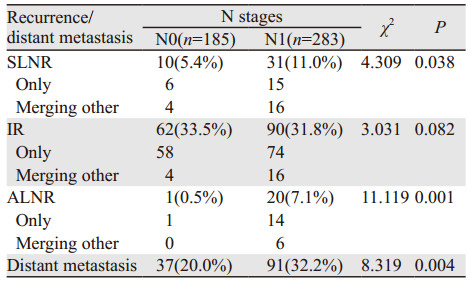
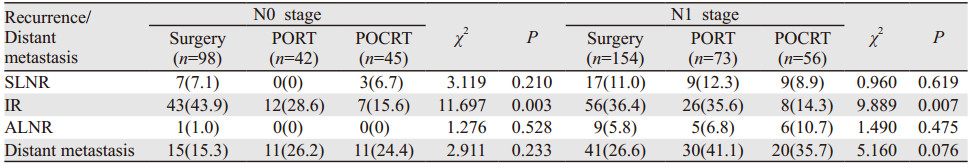
N0期患者的胸腔-区域复发率为37.3%(69/185),远处转移率为20.0%(37/185),其中复发合并远处转移17例;N1期患者的胸腔-区域复发率为43.1%(122/283),远处转移率为32.2%(91/283),其中复发合并远处转移39例。N1期患者的胸腔-区域复发率及远处转移率均显著高于N0期患者(P < 0.05);进一步分析可见两组患者的胸腔内复发率差异并未有统计学意义,主要差异表现在锁上和腹腔淋巴结复发上,见表 4。
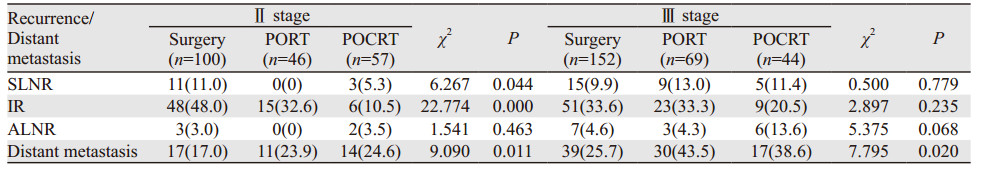
N1期患者无论在胸腔-区域失败率和远处转移率上均要高于N0期患者,N0期患者接受了术后辅助性治疗患者胸腔内复发率显著低于单纯手术患者(P=0.003),而N1期患者似乎更能从术后放化疗中受益(P=0.007)。Ⅱ期患者中接受了术后辅助治疗的其锁骨上淋巴结和胸腔内复发率均显著低于单纯手术患者(P=0.044, P=0.000),但Ⅱ/Ⅲ期接受了术后辅助性治疗的患者远处转移率似乎要高于单纯手术患者(P=0.011, P=0.020),见表 5~6。
 |
 |
术后辅助治疗是我国食管癌主要的综合治疗手段,然而,食管癌术后辅助治疗的有效性到目前为止并未得到临床医师的一致认同,甚至有的学者认为术后辅助性治疗不但未提高患者的疗效,反而增加了患者的不良反应[1]。其中的主要原因可能与目前相关食管癌术后辅助性治疗的前瞻性研究及在循证医学上证据不足有关,而目前临床上的多数回顾性研究中有诸多如入组患者临床病理特征不统一、未行进一步的分层分析、各医疗中心手术习惯和目前食管癌术后放疗并未有统一的靶区勾画标准及放疗剂量等原因均可以导致最终结论的不同。本研究对接受了术后放疗和放化疗的Ⅱ/Ⅲ期食管癌患者的治疗失败情况进行了分析,结果显示患者的总复发率为55.8%,其中胸腔-区域复发率为40.8%,远处转移率为27.4%,这个结果低于临床上多数报道的40%~60%的失败率[2-4],且与有关食管癌术后辅助性治疗报道的结果相似[5-6]。
本研究结果显示Ⅱ期与Ⅲ期食管癌术后行辅助性治疗患者的治疗失败模式仍以区域性复发或和远处转移为主,本组患者治疗后多数患者在1年左右出现区域性复发,2年左右出现血行转移,这与Rice等的相关报道相似[7]。目前临床多数研究均认为胸腔-区域复发为患者的主要失败模式,且其发生率高于远处转移[8-11]。本研究结果显示,术后辅助治疗患者1、3、5年复发率显著低于单纯手术组,而三组1、3、5年远处转移率差异未达到统计学意义。近期一项纳入7项临床研究的Meta分析[12]结果显示,POCRT显著提高生存,PICRT与非术后放化疗组相比,5年OS差异有统计学意义,且术后放化疗组具有更低的局部区域复发,两组远处转移发生率相似。王玉祥等[13]对395例Ⅲ期食管癌术后患者进行了分析,结果显示不同治疗模式为影响患者失败模式的独立性预后影响因素,且PORT和POCRT的失败率显著性低于单纯手术患者。章文成等[5]报道251例Ⅱ/Ⅲ期食管鳞癌患者接受术后放疗的复发率为32.3%,李维贵等[14]研究结果显示食管癌术后放疗患者区域复发率为34.1%。以上研究结果均与本组研究相似。陈俊强等[15]对304例术后接受放化联合治疗和单纯放疗的食管癌患者进行了分析,结果显示两组患者锁骨上区淋巴结转移率、远处转移率、总复发转移率分别为1.8%和7.1%、18.3%和27.9%、27.4%和39.3%,术后放化疗组优于单纯术后放疗组,且组间差异均有统计学意义。Shridhar等[16]的研究同样认为术后辅助治疗可以提高患者的生存率。我们认为术后接受放(化)疗的食管癌患者主要失败模式仍为局部复发和或远处转移,而术后放化疗似乎更能使患者的生存获益,原因可能为食管癌手术后,残留在体内的静止期细胞迅速进入增殖期,肿瘤细胞对化疗及放疗敏感度大大提高,术后采用放疗和化疗进行同步治疗,具有协同作用。
为进一步明确不同亚组患者的失败模式有何不同及不同治疗方式是否对不同亚组人群有影响,我们对本组患者的治疗失败模式进行了分层分析。Ⅲ期与Ⅱ期患者相比,其锁骨上区淋巴结复发率、胸腔内淋巴结复发率及远处转移率均高于后者;N1期患者的锁骨上、腹腔淋巴结复发率及远处转移率均高于N0期患者,且N0期患者锁骨上淋巴结复发率和腹腔淋巴结转移率显著低于N1期患者。因此我们建议对于N1期食管癌术后患者,无论是胸中段还是胸下段食管癌其术后照射范围应包括锁骨上区及腹腔淋巴结区,且应行同步放化疗。本研究结果显示不同治疗方式对于Ⅲ期患者复发率的影响不显著,对于Ⅱ期患者,术后放化疗的应用显著降低了其锁上淋巴复发率和胸腔内区域复发率,我们认为术后放化疗的应用进一步降低了Ⅱ期患者局部复发的可能性,因此该部分患者可从中获益,而Ⅲ期患者较差的预后可能最终抵消了放化疗带来的益处。对于不同淋巴结转移状态的患者,淋巴结阴性患者的总失败率低于阳性患者,与PORT和单纯手术相比,POCRT的应用可以显著降低其胸腔复发率,但其他差异未见统计学意义,而对于N1期患者POCRT的应用与单纯手术和PORT患者相比,前者可以显著降低胸腔内的失败率。我们认为淋巴结转移为患者预后差的重要影响因素,术后有淋巴结转移患者应该接受积极的治疗,这与Bédard等[17]的报道相似,他们认为术后放疗加化疗能提高淋巴结阳性食管癌术后患者的生存率,且不良反应均能耐受。林宇等[18]在对304例食管癌术后淋巴结阳性患者进行了术后放疗和放化疗的研究,他们也认为术后联合放化疗可以提高术后淋巴结阳性患者的生存率。因此对于Ⅱ/Ⅲ期食管癌术后患者,我们建议应进行放化疗治疗。一组来自于我国台湾地区的临床回顾性分析资料结果认为术后辅助放化疗将成为术后病理显示有淋巴结转移的局部晚期食管鳞癌患者的选择[9]。通过分层分析,我们发现接受不同治疗方式患者的主要失败差异在于胸腔内复发的不同上,相关研究同样认为,术后接受了辅助性治疗患者的复发也主要发生在胸腔内,且以野内为主[5],Zieren等[19]同样认为食管癌术后放疗失败主要是局部复发,且主要位于瘤床部位。以上研究结果我们认为对于术后淋巴结转移患者应予以术后放化疗以降低胸腔内复发率;而对于Ⅲ期患者,我们应该积极治疗并寻找新的治疗策略,例如放射性增敏药物、从基因水平上寻找能增加患者放疗疗效的方式以提高患者的疗效,从而提高患者的生存率。
综上所述,依据本研究结果,与既往相关研究比较发现,Ⅱ/Ⅲ期胸段食管鳞癌术后患者接受POCRT及PORT治疗能降低患者的复发率;与单纯手术和PORT相比,POCRT能显著降低患者的胸腔-区域复发率,尤其是胸腔内的复发率;POCRT能显著减低Ⅱ期及N1期患者胸腔内复发率。N1/Ⅲ期患者与N0/Ⅱ期患者相比,锁骨上、腹腔淋巴结复发率和远处转移率高。由于本研究为回顾性分析,最终结论需要前瞻性Ⅲ期随机研究证实。
| [1] | Fok M, Sham Js, Choy D, et al. Postoperative radiotherapy for carcinoma of the esophagus: a prospective, randomized controlled study[J]. Surgery, 1993, 113(2): 138–47. |
| [2] | Barreto JC, Posner MC. Transhiatal versus transthoracic esophagectomy for esophageal cancer[J]. World J Gastroenterol, 2010, 16(30): 3804–10. DOI:10.3748/wjg.v16.i30.3804 |
| [3] | Nakagawa S, Kanda T, Kosugi S, et al. Recurrence pattern of squamous cell carcinoma of the thoracic esophagus after extended radical esophagectomy with three field lymphadenectomy[J]. J Am Coil Surg, 2004, 198(2): 205–11. DOI:10.1016/j.jamcollsurg.2003.10.005 |
| [4] | Baba M, Aikou T, Yoshinaka H, et al. Long-term results of subtotal esophageetomy with three-field lymphadenectomy for carcinoma of the thoracic esophagus[J]. Ann Surg, 1994, 219(3): 310–6. DOI:10.1097/00000658-199403000-00012 |
| [5] | 章文成, 王奇峰, 肖泽芬, 等. Ⅱ和Ⅲ期胸段食管癌术后预防性三维放疗疗效分析[J]. 中华放射肿瘤学杂志, 2012, 21(2): 136–9. [ Zhang WC, Wang QF, Xiao ZF, et al. A efficacy analysis of intensity-modulated radiotherapy or three-dimensional conformal radiotherapy for resected thoracic esophageal squamous cell carcinoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2012, 21(2): 136–9. ] |
| [6] | 肖泽芬, 杨宗贻, 王绿化, 等. 食管癌术后淋巴结转移对生存率的影响和放射治疗的意义[J]. 中华肿瘤杂志, 2004, 26(2): 112–5. [ Xiao ZF, Yang ZY, Wang LH, et al. Influence of the number of lymph node metastasis on survival and significance of postoperative radiotherapy for esophageal carcinoma[J]. Zhonghua Zhong Liu Za Zhi, 2004, 26(2): 112–5. ] |
| [7] | Rice TW, Adelstein DJ, Chidel MA, et al. Benefit of postoperative aajuvant eherroradiotherapy in locoregionally advanced e80phagea carcinoma[J]. J Thorac Cardiovasc Surg, 2003, 126(5): 1590–6. DOI:10.1016/S0022-5223(03)01025-0 |
| [8] | Liu Q, Cai XW, Wu B, et al. Patterns of failure after radical surgery among patients with thoracic esophageal squamouscell postoperative radiotherapy[J]. PLoS One, 2014, 9(5): e97225. DOI:10.1371/journal.pone.0097225 |
| [9] | Hsu PK, Wang BY, Huang CS, et al. Prognostic factors for post-recurrence survival in esophageal squamous cell carcinoma patients with recurrence after resection[J]. J Gastrointest Surg, 2011, 15(4): 558–65. DOI:10.1007/s11605-011-1458-1 |
| [10] | 郭旭峰, 茅腾, 吉春宇, 等. 病理N1期胸段食管癌根治术后复发转移危险因素分析[J]. 中华胃肠外科杂志, 2013, 16(9): 831–4. [ Guo XF, Mao T, Ji CY, et al. Risk factors of recurrence and metastasis in pN1 stage squmous cell carcinoma of the thoracic esophagus after radical esophagectomy with lymphadenectomy[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2013, 16(9): 831–4. ] |
| [11] | 杨琼, 王玉祥, 何明, 等. 影响Ⅲ期食管癌术后患者预后的因素[J]. 中华肿瘤杂志, 2016, 38(7): 530–7. [ Yang Q, Wang YX, He M, et al. Factors affecting on long-time survival in patients with stage Ⅲ thoracic esophageal carcinoma after esophagectomy[J]. Zhonghua Zhong Liu Za Zhi, 2016, 38(7): 530–7. ] |
| [12] | Zheng B, Zheng W, Zhu Y, et al. Role of adjuvant chemora-diotherapy in treatment of resectable esophageal carcinoma: a meta-analysis[J]. Chin Med J, 2013, 126(6): 1178–82. |
| [13] | 王玉祥, 杨琼, 何明, 等. Ⅲ期胸段食管鳞癌根治术后的复发规律[J]. 中华肿瘤杂志, 2017, 39(1): 48–55. [ Wang YX, Yang Q, He M, et al. Patterns of recurrence in patients with stage Ⅲ thoracic esoph ageal squamous cell carcinoma after radical resection[J]. Zhonghua Zhong Liu Za Zhi, 2017, 39(1): 48–55. ] |
| [14] | 李维贵, 张德洲, 马俊杰, 等. 食管癌根治术后放疗临床疗效分析[J]. 中华放射肿瘤学杂志, 2004, 13(3): 342–3. [ Li WG, Zhang DZ, Ma JJ, et al. Clinical analysis of radiotherapy after radical resection of esophageal carcinoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2004, 13(3): 342–3. ] |
| [15] | 陈俊强, 潘建基, 李建成, 等. 淋巴结阳性胸段食管鳞癌术后放化疗的临床研究[J]. 中华放射肿瘤学杂志, 2011, 20(4): 287–90. [ Chen JQ, Pan JJ, Li JC, et al. Clinical study of postoperative chemoradiotherapy of thoracic esophageal squamous cell carcinoma with positive lymph nodes[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2011, 20(4): 287–90. ] |
| [16] | Shridhar R, Weber J, Hoffe SE, et al. Adjuvant radiation therapy and lymphadenectomy in esophageal cancer: a SEER database analysis[J]. J Gastrointest Surg, 2013, 17(8): 1339–45. DOI:10.1007/s11605-013-2192-7 |
| [17] | Bédard EL, Inculet RI, Mahhaner RA, et al. The role of surgery and postoperative chemoradiation therapy in patients with lymph node positive esophageal carcinoma[J]. Cancer, 2001, 91(12): 2423–30. DOI:10.1002/(ISSN)1097-0142 |
| [18] | 林宇, 陈俊强, 李建成, 等. 淋巴结阳性胸段食管鳞癌术后放化疗的价值[J]. 中华肿瘤杂志, 2014, 36(2): 151–4. [ Lin Y, Chen JQ, Li JC, et al. Value of postoperative radiochemotherapy for thoracic esophageal squamous cell carcinoma with lymph node metastasis[J]. Zhonghua Zhong Liu Za Zhi, 2014, 36(2): 151–4. ] |
| [19] | Zieren HU, Müller JM, Jacobi CA, et al. Adjuvant postoperative radiation therapy after curative resection of squamous cell carcinoma of the thoracic esophagus: a prospective randomized study[J]. World J Surg, 1995, 19(3): 444–9. DOI:10.1007/BF00299187 |
 2017, Vol. 44
2017, Vol. 44