文章信息
- miRNA-130b在骨肉瘤组织中的表达及其对骨肉瘤细胞增殖与凋亡的影响
- Expression of miRNA-130b in Osteosarcoma Tissues and Its Impact on Proliferation and Apoptosis of Osteosarcoma Cells
- 肿瘤防治研究, 2017, 44(5): 334-339
- Cancer Research on Prevention and Treatment, 2017, 44(5): 334-339
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.05.005
- 收稿日期: 2016-07-27
- 修回日期: 2016-11-07
2. 30006 南昌,南昌大学第二附属医院骨科
2. Department of Orthopaedics, The Second Affiliated Hospital of Nanchang University, Nanchang 330006, China
骨肉瘤是一种常见的骨原发恶性肿瘤,起源于间叶组织,恶性程度较高[1],好发于青少年,骨肉瘤最主要的治疗方式包括外科切除结合术后放化疗,但骨肉瘤患者预后仍然较差,5年生存率为55%~68%[2],基因水平的治疗是骨肉瘤研究的热点。
miRNA是由20~25个核苷酸组成的非编码小分子RNA,miRNA通过与靶mRNA 3’端完全或不完全的互补结合,导致靶mRNA降解或翻译抑制,在转录后水平对基因表达的负调控[3],从而实现影响细胞增殖、分化和凋亡[4-5]。miRNA-130b是miRNA-130家族中重要的一员,已经被证实在多种肿瘤中异常表达[6-8],但miRNA-130b对骨肉瘤的作用尚不明确。本研究旨在探讨miRNA-130b在骨肉瘤组织中的表达水平及miRNA-130b对骨肉瘤细胞生物学特性的影响及作用机制,以期为骨肉瘤的基因靶向治疗提供新的思路。
1 资料与方法 1.1 临床资料收集新余钢铁集团有限公司中心医院骨科及南昌大学第二附属医院骨科2011年1月至2015年12月手术切除的骨肉瘤标本48例,其中男30例,女18例,年龄12~48岁,平均23.7岁。患者手术前未经放化疗,实验组为骨肉瘤组织,对照组为无癌肿侵犯的癌旁组织,并经术后病理证实。获得患者的知情同意,并经本院医学伦理委员审核通过。
1.2 实验材料及来源骨肉瘤U2细胞购买自中国科学院上海细胞库;胎牛血清和RPMI 1640培养液购自美国Gibco公司;miRNA-130b inhibitor、miR-Negative control(阴性对照)购买自广州锐博生物科技公司,RUNX3 siRNA及其Negative control(NC, 阴性对照),miRNA-130b、RUNX3及内参U6引物由武汉博士德公司合成,TRIzol、总RNA提取试剂盒、Lipofectamine2000购自美国Invitrogen公司,反转录试剂盒、实时荧光定量PCR试剂盒购自日本TaKaRa公司;RUNX3一抗购自美国Abcam公司。
1.3 细胞培养及转染用含10%胎牛血清的RPMI 1640培养液培养U2细胞,在37℃、5%CO2的恒温培养箱中培养。选取对数期生长的细胞接种于6孔板上,待细胞融合度为75%左右时参照说明书用Lipo2000转染。miRNA-130b inhibitor转染实验分3组:空白对照组(Blank)、阴性对照组miR-NC(miR-NC)、转染miRNA-130b inhibitor组;RUNX3 siRNA转染实验分3组:空白对照组(Blank)、阴性对照组(Negative control)、转染RUNX3 siRNA组。转染后24 h后于荧光显微镜下观察细胞荧光,检测转染效率。
1.4 Real-time PCR检测骨肉瘤组织及U2细胞相关基因mRNA表达水TRIzol法提取组织或细胞的总RNA,按反转录试剂盒说明书合成cDNA,反转录条件:37℃ 15 min,85℃ 5 s。扩增体系采用SYBR Premix Ex Taq 10 μl,上、下游引物各0.5 μl,提取的模板DNA 1 μl,加去核酶水至20 μl。扩增的条件:95℃ 30s,95℃ 5 s、65℃ 30 s,40次循环。采用2-ΔΔCt法计算miRNA-130b的相对表达水平。U6的反转录引物:5'-GTCGTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGACAAAATATGGAAC-3',上下游引物分别为:5'-TGCGGGTGCTCGCTTCGGCAGC-3'和5'-CCAGTGCAGGGTCCGAGGT-3';RUNX3基因的上下游引物分别为:5'-AGGCATTGCGCAGCTCAGCGGAGTA-3',下游引物序列: 5'-TCTGCTCCGTGCTGCCCTCGCACTG-3'。
1.5 CCK8法检测转染后U2细胞增殖水平的改变将转染后24 h的细胞,消化后收集细胞,按2×103个每孔接种到96孔板,每孔加入100 μl单细胞悬液,各组设5个复孔。于种板后1~5 d进行检测,待细胞贴壁后,用CCK8分别测定1~5 d时细胞的增殖活性。检测前2 h,加入10 μl/孔CCK8溶液,37℃孵育2 h,利用酶标仪上测定450 nm波长处各孔的吸光度值。
1.6 流式细胞仪检测转染后细胞周期、凋亡情况将转染后各组细胞,制成单细胞悬液并75%乙醇固定,RNase A(1 mg/ml)200 μl,37℃孵育30 min,与800 μl碘化丙啶染色液混匀后,4℃避光染色30 min,使用FACSCalibur流式细胞仪检测细胞周期。收集转染后细胞,用磷酸缓冲盐溶液洗涤细胞沉淀1次,收集细胞沉淀;1 ml染色缓冲液重悬细胞;取100 μl重悬细胞液加入5 μl Annexin V-APC染色,室温避光15 min后上机检测凋亡水平。
1.7 荧光素酶基因报告实验(1)载体构建:RUNX3野生型(RUNX3-wild type, WT)是含有野生型RUNX3的3'UTR序列的pcDNA/EGFP荧光报告载体,RUNX3突变型(RUNX3-mutant, MUT)是经点突变的突变型3'UTR序列的pcDNA/EGFP荧光报告载体。将提取的总RNA反转录后扩增,PCR后双酶切回收产物及载体,连接目的片段与载体、转化、质粒酶切鉴定阳性克隆。(2)miRNA-130b inhibitor与构建的野生型或者突变型RUNX3载体共转染于骨肉瘤U2细胞。(3)双荧光素酶报告基因检测:细胞转染后48 h后,用双荧光素酶报告基因试剂盒进行检测,一起记录荧光强度值。
1.8 Western blot法检测转染后U2细胞中RUNX3蛋白的表达水平收集转染后的骨肉瘤细胞,加入提取缓冲液并收集其裂解液,BCA法测定蛋白浓度,根据蛋白浓度调节上样量,10%浓度的SDS-PAGE胶电泳后进行转膜,按分子量大小剪下相应大小的PVDF膜在5%脱脂奶粉封闭液中行抗原封闭,加入RUNX3一抗孵育,洗膜后孵育二抗,后进行显影、定影。
1.9 统计学方法所有实验数据均经SPSS20.0统计软件分析。实验均重复三次,计量资料以均数±标准差(x± s)表示,组织分析采用两独立样本的t检验,多组数据比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 Real-time PCR法检测骨肉瘤组织中相关基因的表达水平Real time PCR检测骨肉瘤及其癌旁组织中的miRNA-130b及RUNX3 mRNA的表达,结果显示与癌旁组织相比较,骨肉瘤组织中miRNA-130b的表达明显升高(t=15.47, P < 0.0001),见图 1A;而RUNX3 mRNA的表达明显降低(t=7.228, P < 0.0001),见图 1B。
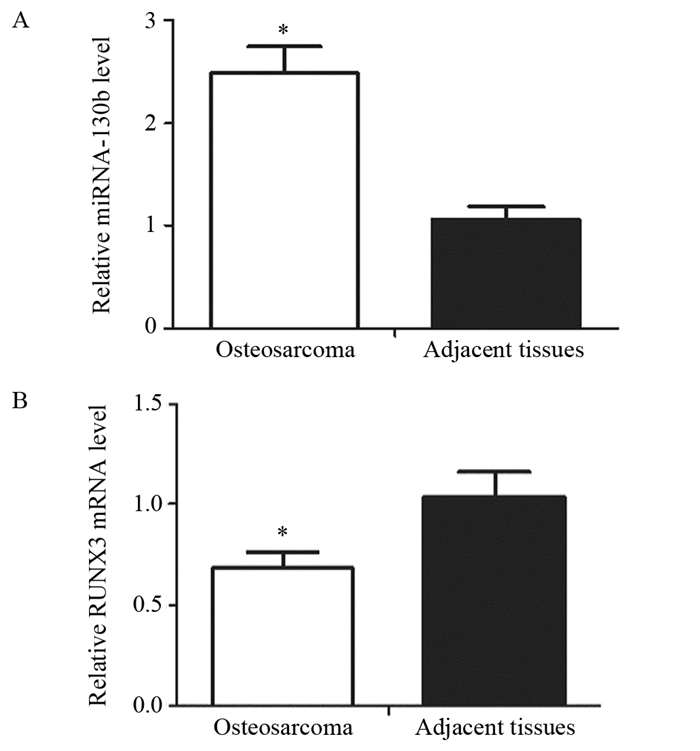
|
| *: P < 0.05, compared with adjacent normal tissues 图 1 Real-time PCR检测骨肉瘤及癌旁组织中miRNA-130b (A) 及RUNX3 mRNA (B) 的表达 Figure 1 The expressions of miRNA-130b (A) and RUNX3 mRNA (B) in osteosarcoma and adjacent normal tissues detected by real-time PCR |
Real time PCR检测结果显示miRNA-130b inhibitor组为(0.4254±0.09)、miR-NC组为(1.00±0.15),Blank组为(1.06±0.12),与Blank和miR-NC组比较,miRNA-130b inhibitor组细胞miRNA-130b的表达水平明显降低,差异有统计学意义(F=81.83, P < 0.0001),表明转染成功,见图 2。
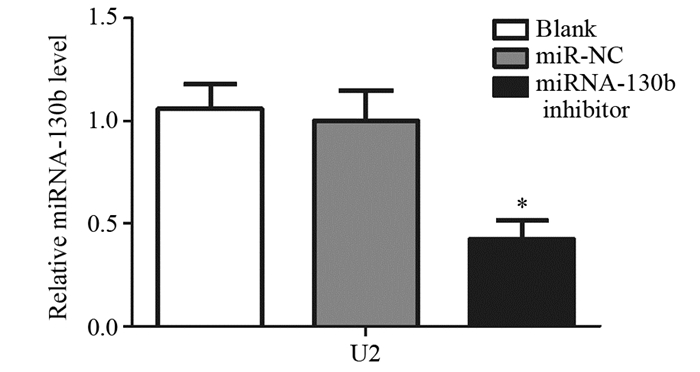
|
| *: P < 0.05, compared with Blank or miR-NC group 图 2 miRNA-130b inhibitor转染U2细胞后miRNA-130b表达水平 Figure 2 The expression level of miRNA-130b in U2 cells after transfected with miRNA-130b inhibitor |
与Blank及miR-NC组比较,从第三天开始miRNA-130b inhibitor组骨肉瘤U2细胞的细胞增殖能力较Blank与miR-NC组明显减弱(P < 0.001),Blank与miR-NC组相比较差异无统计学意义,见图 3。
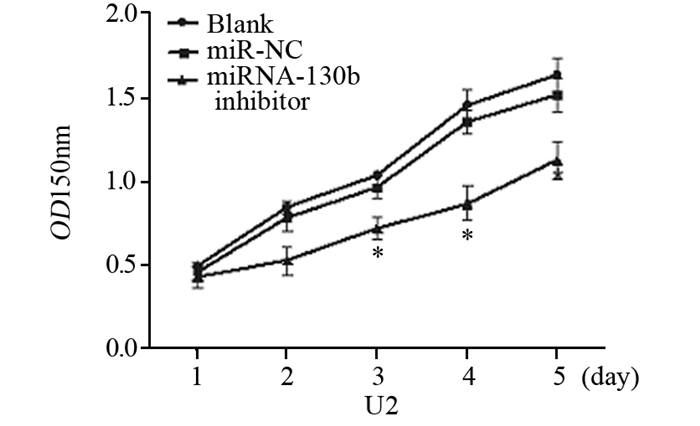
|
| 图 3 CCK8检测转染后不同时间U2细胞的增殖能力 Figure 3 The proliferation of U2 cells after transfected with miRNA-130b inhibitor detected by CCK8 assay |
结果显示:Blank、miR-NC、miRNA-130b inhibitor组分别为(13.21±1.36)%、(16.34±1.68)%、(24.38±2.74)%。miRNA-130b inhibitor组较Blank及miR-NC组细胞凋亡率明显升高,差异有统计学意义(F=81.78, P=0.0007),见图 4。
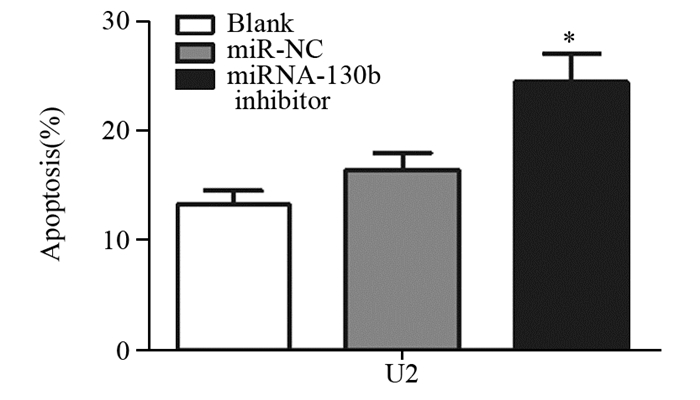
|
| *: P < 0.05, compared with Blank or miR-NC group 图 4 流式细胞术检测转染miRNA-130b inhibitor后各组细胞的凋亡率 Figure 4 The apoptosis rate of U2 cells after transfected with miRNA-130b inhibitor detected by FCM |
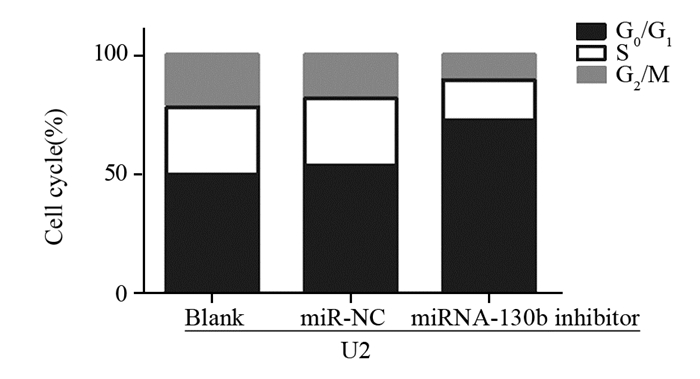
流式细胞仪检测结果显示:S、G2/M、G0/G1期细胞所占比例:Blank组分别为28.63%、21.71%、49.66%,miR-NC组分别为28.72%、17.83%、53.45%,miRNA-130b inhibitor组分别为17.28%、10.54%、72.18%。miRNA-130b inhibitor组较Blank和miR-NC组G0/G1期细胞所占比例明显增高,差异有统计学意义(F=19.93, P=0.002),见图 5。
|
| 图 5 流式细胞术检测转染miRNA-130b inhibitor后各组细胞周期的分布 Figure 5 Cell cycles of U2 cells after transfected with miRNA-130b inhibitor detected by FCM |
经过应用TargetScan、miRanda和miRwalk三种预测miRNA-130b的靶基因,并筛选与骨肉瘤相关的基因,本研究用生物信息学软件进行预测,结果发现RUNX3为miRNA-130b的潜在靶基因之一,为了研究miRNA-130b与骨肉瘤细胞侵袭机制的研究,进一步行荧光素酶实验。
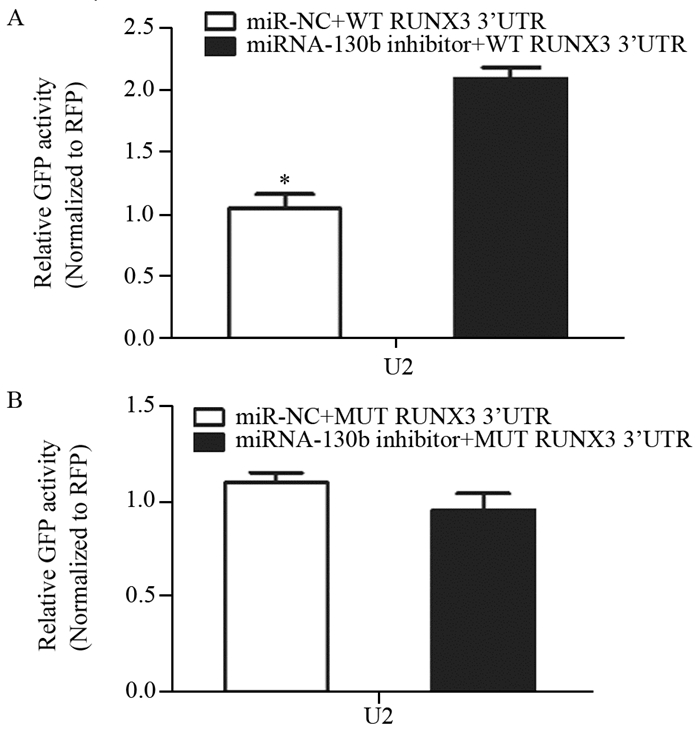
经过点突变,构建SOX4突变型(SOX4-mutant, MUT)的pcDNA/EGFP荧光报告载体,见图 6。在U2细胞中转染miRNA-130b inhibitor+pcDNA/EGFP-WT RUNX3 3′-UTR、miR-NC+pcDNA/EGFP-WT RUNX3 3′-UTR,荧光素酶报告实验结果表明,miRNA-130b inhibitor组与对照组相比,RUNX3 3'UTR的荧光素酶活性较高(P < 0.05),见图 7A。在U2细胞中转染miRNA-130b inhibitor+pcDNA/EGFP-MUT RUNX3 3′-UTR、miR-NC+pcDNA3/EGFP-MUT RUNX3 3′-UTR,荧光素酶报告实验结果表明,当对miRNA-130b与RUNX3 3'UTR的特异性结合位点进行点突变后,miRNA-130b inhibitor和miR-NC对MUT RUNX3 3'UTR的荧光素酶活性影响无差别,见图 7B。综上所述证实RUNX3为miRNA-130b的靶基因。
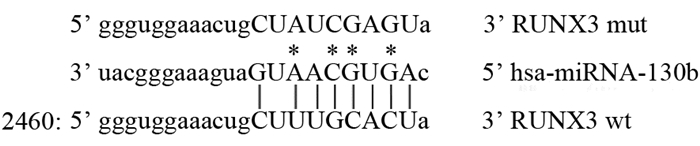
|
| *: mutated nucleotides 图 6 miRNA-130b靶向RUNX3的野生型3′-UTR及突变型RUNX3-3′ UTR示意图 Figure 6 The predicted miRNA-130b binding site with RUNX3 3′-UTR and its mutated version by site mutagenesis |
|
| *: P < 0.05, compared with miRNA-130b inhibitor group 图 7 荧光素酶基因报告实验检测miRNA-130b inhibitor转染U2的相对荧光素酶活性 Figure 7 Relative luciferase activity of U2 cells transfected by miRNA-130b inhibitor detected by luciferase gene reporter assay |
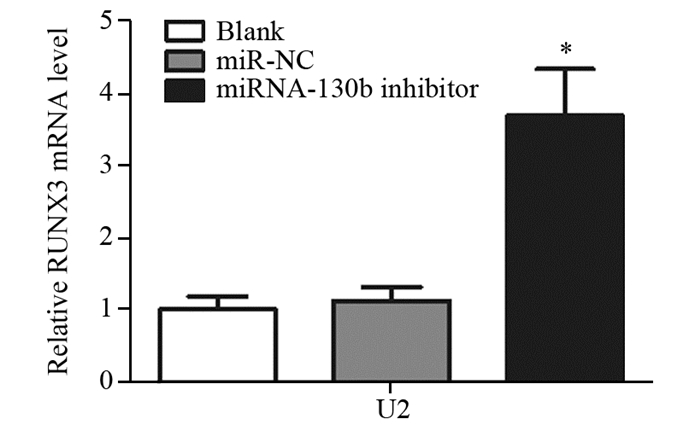
结果显示,转染miRNA-130b inhibitor组RUNX3 mRNA表达水平较miR-NC组和Blank组明显升高(F=140.7, P < 0.001),Blank组与miR-NC组相比差异无统计学显意义(P=0.14),见图 8。
|
| *: P < 0.05, compared with Blank or miR-NC group 图 8 Real-time PCR检测miRNA-130b inhibitor转染后RUNX3 mRNA表达水平 Figure 8 The expressions of RUNX3 mRNA detected by real-time PCR after transfected by miRNA-130b inhibitor |
结果显示,转染miRNA-130b inhibitor组RUNX3蛋白表达水平较miR-NC和Blank组明显升高(F=110.5, P < 0.001),Blank组与miR-NC组相比差异无统计学意义,见图 9。
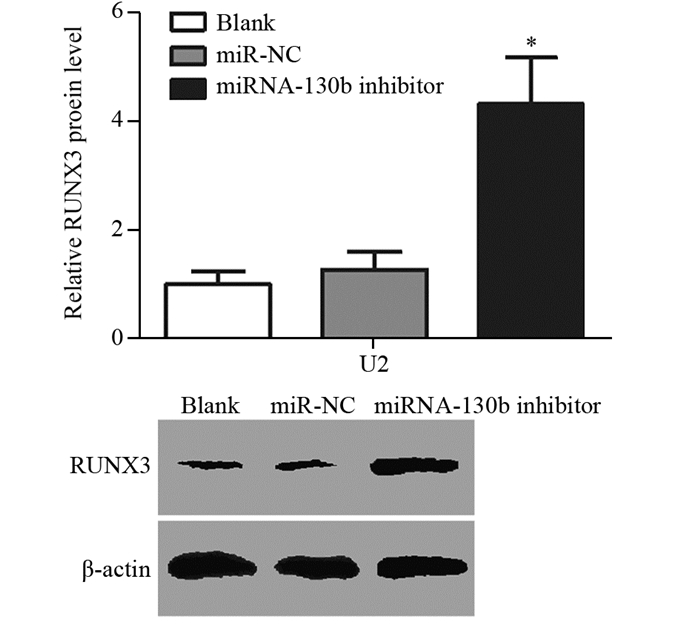
|
| *: P < 0.05, compared with Blank or miR-NC group 图 9 Western blot检测miRNA-130b inhibitor转染后RUNX3蛋白表达水平 Figure 9 The expression of RUNX3 protein detected by Western blot after transfected by miRNA-130b inhibitor |
结果显示,转染RUNX3 siRNA后,RUNX3 mRNA表达明显被抑制(F=76.74, P < 0.001),但miRNA-130b表达水平无明显变化(F=0.03, P > 0.05),见图 10。
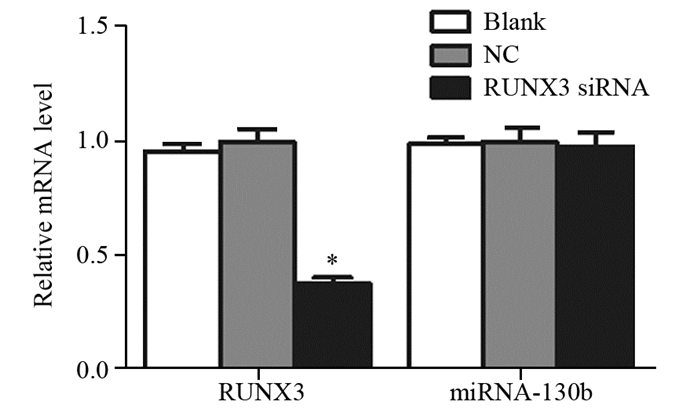
|
| *: P < 0.05, compared with Blank or NC group 图 10 抑制RUNX3表达后对RUNX3及miRNA-130b表达水平的影响 Figure 10 The expression levels of RUNX3 and miRNA-130b evaluated by real-time PCR in U2 cells after transfected with RUNX3 siRNA |
骨肉瘤恶性程度高,目前常规采用手术联合化疗,但其治疗效果仍不佳,预后仍较差,而基因水平的治疗是骨肉瘤研究中的热点,并且急需寻求有效的基因治疗靶点。目前研究表明miRNA具有广泛的基因调节功能,参与一系列的生物学进程如胚胎的发育、细胞增殖与凋亡和造血功能等。目前有学者研究骨肉瘤的发生、发展时发现,miRNA常表达失调,认为骨肉瘤的恶性生物学表型和某些miRNA有着密切的关系[9-10]。
miRNA-130b是miRNA-130家族中重要的一员,miRNA-130b不同于miRNA-130a,位于染色体22。最新发现:Chen等[11]研究在头颈部表皮肿瘤组织中发现miRNA-130b表达上调;张瑞等[12]发现miRNA-130b在胶质瘤组织中高表达,抑制miRNA-130b的表达后脑胶质瘤U87细胞增殖和侵袭能力明显受到抑制;在食管鳞状细胞癌[13]中发现miRNA-130b表达上调并且能够促进Eca109增殖和迁移的作用,且可在转录后水平靶向调控PTEN蛋白的表达并促进AKt磷酸化。但miRNA-130b在骨肉瘤中的表达水平及机制尚不明确。本研究发现骨肉瘤组织中miRNA-130b的表达水平较其癌旁组织明显升高,表明miRNA-130b在骨肉瘤组织中呈高表达,进一步实验将miRNA-130b inhibitor转染入骨肉瘤细胞U2中,使U2细胞的miRNA-130b表达水平受抑制。再行CCK8实验示:下调miRNA-130b的表达能明显抑制U2细胞的增殖能力,通过流式细胞仪对细胞周期和凋亡情况的分析,抑制miRNA-130b的表达水平,G0/G1期的细胞数明显增加,细胞增殖受限,表明miRNA-130b表达下降可以影响骨肉瘤细胞周期,而同时细胞凋亡数目明显增多,凋亡率增高。综上表明,下调miRNA-130b表达水平后U2细胞增殖受抑制并促进其凋亡。
为了探讨miRNA-130b对骨肉瘤细胞的作用机制,首先利用生物信息学预测发现在骨肉瘤中,RUNX3可能作为miRNA-130b的靶基因,而Runt相关转录因子3(runt related transcription factor 3, RUNX3)是Runt结构域转录因子家族成员,RUNX3是1994年首次报道的一种重要抑癌基因,目前已证实在多种肿瘤中其表达下调,与肿瘤的发生、发展以及预后有关[14]。目前RUNX3在骨肉瘤中研究较少,吴同申等[15]发现骨肉瘤组织中RUNX3表达较良性骨肿瘤明显降低。刘融等[16]发现骨肉瘤患者外周血RUNX3基因启动子甲基化率显著高于健康者,进一步研究发现其处于高甲基化沉默状态,基于RUNX3基因与RUNX2基因功能类似,推测RUNX3基因启动子甲基化可能与骨肉瘤的发病机制密切相关,但其具体上游调控机制尚不清楚。
本研究通过荧光素酶实验验证:转染miR-130b inhibitor后,与miR-NC组比较,RUNX3-WT报告载体的荧光强度受到显著影响,而RUNX3-MUT报告载体的荧光强度基本不受影响,表明RUNX3 mRNA的3’UTR上存在miR-130b的结合位点,即miR-130b可与RUNX3 3’UTR结合,从而有效减少脱靶效应的可能性,证实RUNX3是miR-130b的下游靶基因。RUNX3蛋白表达下调的免疫印迹实验结果说明了RUNX3是miR-130b的靶基因,而荧光定量PCR结果表明,miR-130b通过抑制RUNX3的翻译,即转录后调控水平,来参与骨肉瘤发生、发展的调控,而抑制RUNX3的表达后,miRNA-130b的表达水平无明显变化,以上实验基本上表明miR-130b对RUNX3的单项调控作用,从而说明miRNA-130b可能是通过调控RUNX3对骨肉瘤细胞的增殖、凋亡等产生影响。
综上所述,miRNA-130b在骨肉瘤组织中呈高表达,miRNA-130b通过调控RUNX3调控骨肉瘤U2细胞增殖及其凋亡水平。miRNA-130b可能在骨肉瘤中作为一种致癌基因,并可作为骨肉瘤分子治疗的新靶点。
| [1] | Chui MH, Kandel RA, Wong M, et al. Histopathologic Features of Prognostic Significance in High-Grade Osteosarcoma[J]. Arch Pathol Lab Med, 2016. |
| [2] | Ottaviani G, Jaffe N. The epidemiology of osteosarcoma[J]. Cancer Treat Res, 2009, 152: 3–13. DOI:10.1007/978-1-4419-0284-9 |
| [3] | Bueno MJ, Pérez de Castro I, Malumbres M. Control of cell proliferation pathways by microRNAs[J]. Cell Cycle, 2008, 7(20): 3143–8. DOI:10.4161/cc.7.20.6833 |
| [4] | Fan YH, Ye MH, Wu L, et al. Overexpression of miR-98 inhibits cell invasion in glioma cell lines via downregulation of IKKepsilon[J]. Eur Rev Med Pharmacol Sci, 2015, 19(19): 3593–604. |
| [5] | Volk N, Shomron N. Versatility of MicroRNA biogenesis[J]. PLoS One, 2011, 6(5): e19391. DOI:10.1371/journal.pone.0019391 |
| [6] | Gong XC, Xu YQ, Jiang Y, et al. Onco-microRNA miR-130b promoting cell growth in children APL by targeting PTEN[J]. Asian Pac J Trop Med, 2016, 9(3): 265–8. DOI:10.1016/j.apjtm.2016.01.024 |
| [7] | Chen C, Hu Y, Li L. NRP1 is targeted by miR-130a and miR-130b, and is associated with multidrug resistance in epithelial ovarian cancer based on integrated gene network analysis[J]. Mol Med Rep, 2016, 13(1): 188–96. |
| [8] | Siragam V, Rutnam ZJ, Yang W, et al. MicroRNA miR-98 inhibits tumor angiogenesis and invasion by targeting activin receptor-like kinase-4 and matrix metalloproteinase-11[J]. Oncotarget, 2012, 3(11): 1370–85. DOI:10.18632/oncotarget |
| [9] | Dong J, Liu Y, Liao W, et al. miRNA-223 is a potential diagnostic and prognostic marker for osteosarcoma[J]. J Bone Oncol, 2016, 5(2): 74–9. DOI:10.1016/j.jbo.2016.05.001 |
| [10] | Chen J, Zhou J, Chen X, et al. miRNA-449a is downregulated in osteosarcoma and promotes cell apoptosis by targeting BCL2[J]. Tumour Biol, 2015, 36(10): 8221–9. DOI:10.1007/s13277-015-3568-y |
| [11] | Chen D, Cabay RJ, Jin Y, et al. MicroRNA Deregulations in Head and Neck Squamous Cell Carcinomas[J]. J Oral Maxillofac Res, 2013, 4(1): e2. |
| [12] | 张瑞, 徐修鹏, 陈正新, 等. miR-130b在胶质瘤中表达及其对胶质瘤增殖与侵袭的影响[J]. 江苏医药, 2014, 40(16): 1864–7. [ Zhang R, XU XP, Chen ZX, et al. Exepression of miR-130b in glioblastoma and its impact on proliferation and invasion of human glioma cells[J]. Jiangsu Yi Yao, 2014, 40(16): 1864–7. ] |
| [13] | 郁婷婷, 李硕, 傅敏根, 等. miR-130b在食管鳞癌中的表达及对食管鳞癌细胞增殖和迁移的影响[J]. 世界华人消化杂志, 2013, 21(18): 1685–92. [ Yu TT, Li S, Fu MG, et al. Expression of miR-130b in esophageal squamous cell carcinoma and effect of miR-130b transfection on cell proliferation and migration in an esophageal squamous cell carcinoma cell line[J]. Shi Jie Hua Ren Xiao Hua Za Zhi, 2013, 21(18): 1685–92. ] |
| [14] | Feigh M, Hjuler ST, Andreassen KV, et al. Oral salmon calcitonin enhances insulin action and glucose metabolism in diet-induced obese streptozotocin-diabetic rats[J]. Eur J Pharmacol, 2014, 737: 91–6. DOI:10.1016/j.ejphar.2014.05.016 |
| [15] | 吴同申, 彭圣智, 孟彦. 流式细胞术检测骨肉瘤中RUNX3和β-catenin的表达及意义[J]. 中国现代医生, 2012, 50(32): 4–5. [ Wu TS, Peng SZ, Meng Y. Expression and significance of RUNX3 and β-catenin in osteosarcoma by FCM[J]. Zhongguo Xian Dai Yi Sheng, 2012, 50(32): 4–5. ] |
| [16] | 刘融, 陈令斌, 张勇. 骨肉瘤外周血Runx3基因启动子甲基化检测及临床意义[J]. 检验医学与临床, 2015, 7: 978–9. [ Liu R, Chen LB, Zhang Y. Detection of Runx3 gene promoter methylation in peripheral blood of osteosarcoma and its clinical significance[J]. Jian Yan Yi Xue Yu Lin Chuang, 2015, 7: 978–9. DOI:10.3969/j.issn.1672-9455.2015.07.044 ] |
 2017, Vol. 44
2017, Vol. 44
