文章信息
- PTEN和EMMPRIN在肺腺癌组织中的表达及其与EGFR基因突变的关系
- Expression of PTEN and EMMPRIN in Lung Adenocarcinoma Tissues and Their Correlation with EGFR Mutation
- 肿瘤防治研究, 2017, 44(5): 324-328
- Cancer Research on Prevention and Treatment, 2017, 44(5): 324-328
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.05.003
- 收稿日期: 2016-10-17
- 修回日期: 2017-02-06
2. 450000 郑州,郑州人民医院院士工作站
2. Academy of Sciences Expert Workstation, People's Hospital of Zhengzhou, Zhengzhou 450000, China
EMMPRIN/CD147(extracellular matrix metalloproteinase inducer, CD147)属于免疫球蛋白超家族,其在肿瘤中高表达,在正常组织中几乎不表达,是肿瘤发生、发展过程中的一个重要因子。PTEN和CD147在非小细胞肺癌中的研究国内已有少数相关文献报道。肺腺癌是肺癌中最常见的组织学类型,由于其组织学亚型与肺腺癌预后相关,2015年WHO分类也特别强调肺腺癌的组织学亚型。PTEN和CD147与肺腺癌组织亚型有何关系?肺腺癌的治疗与EGFR基因突变密切相关,那么PTEN和CD147蛋白的表达与EGFR基因突变有何关系?本研究用免疫组织化学法和RT-PCR法检测90例肺腺癌组织中PTEN和CD147蛋白的表达和EGFR基因突变情况,分析PTEN和CD147蛋白与肺腺癌临床病例特征以及EGFR基因突变的关系。
1 资料与方法 1.1 病例资料收集郑州人民医院病理科2012年6月—2016年8月期间的病理活检标本。90例肺腺癌原发灶,10例正常健康者肺组织作为对照。按照2015年WHO/国际肺癌研究联合会肺癌组织病理分级分类法,将肺腺癌组织按形态分为附壁为主型、腺泡为主型、乳头为主型、微乳头为主型、实性为主型。患者的其他资料均来自住院病历,术前均未接受化疗或放疗,所有标本经郑州人民医院病理科确诊。
1.2 主要试剂PTEN和CD147一抗兔抗人单克隆抗体(即用型)、二抗及二氨基联苯胺(DAB)均购自福州迈新公司。EGFR基因突变试剂盒来自湖北武汉友芝友医疗科技有限公司。
1.3 免疫组织化学染色主要步骤如下:(1)石蜡组织切片、烤片、脱蜡并水化;(2)抗原修复;(3)一抗37℃孵育2 h;(4)二抗37℃孵育20~30 min;(5)DAB显色5~10 min;(6)脱水、透明和封片。用已知PTEN和CD147阳性的肺腺癌组织和PBS分别代替一抗作为阳性和空白对照。同一批肺腺癌免疫组织化学PTEN和CD147均选用正常健康者作为对照。
1.4 EGFR基因突变检测方法主要步骤如下:(1)石蜡组织DNA提取;(2)EGFR基因产物扩增及纯化;(3)测序反应及纯化、上机测序。实验中设计阳性和阴性对照。
1.5 免疫组织化学结果判断根据染色程度和染色细胞所占百分比进行评分,半定量判定[1]:阴性(无阳性着色)或弱阳性(+或者++,细胞着色范围 < 30%)判断为低表达;中等强度阳性(++,细胞着色范围≥30%或者+++,细胞着色范围 < 50%)或者强阳性(+++,细胞着色范围 > 50%)判断为高表达。
1.6 统计学方法采用SPSS17.0统计软件进行数据处理与统计分析,PTEN和CD147阳性表达率和病理因素的相关性采用χ2检验,相关性采用Spearman相关分析,P < 0.05为差异有统计学意义。
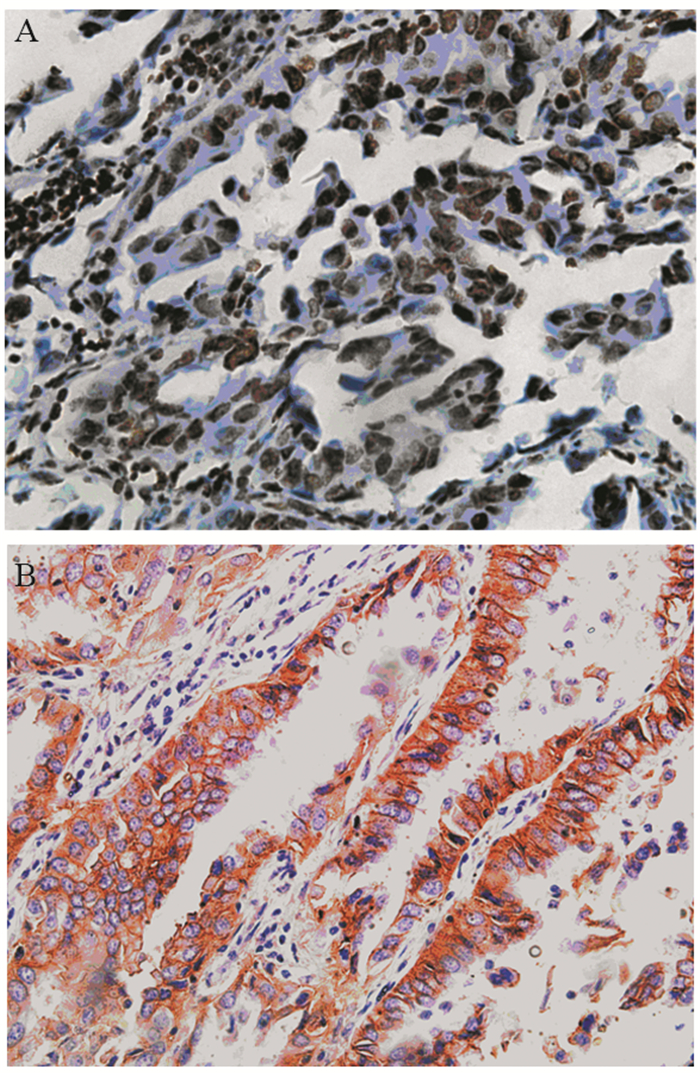
2 结果 2.1 PTEN和CD147在肺腺癌中的表达PTEN阳性表达部位以细胞核为主,在正常肺组织中着色呈棕褐色,见图 1A,在癌组织中有一定程度的表达或不表达。90例肺腺癌组织中PTEN的表达率40%(36/90)明显低于相对正常肺组织100%(10/10)。CD147在肺腺癌组织中的表达主要定位于肺癌细胞膜和(或)质,为粗细不等的棕褐色颗粒见图 1B,其在正常肺组织中几乎不表达。90例肺腺癌中CD147表达率为80%(72/90)明显高于相对正常肺组织0(0/10)。
|
| A: PTEN; B: CD147 图 1 PTEN和CD147在肺腺癌组织中的表达(IHC×200) Figure 1 Expression of PTEN and CD147 in lung adenocarcinoma tissues (IHC×200) |
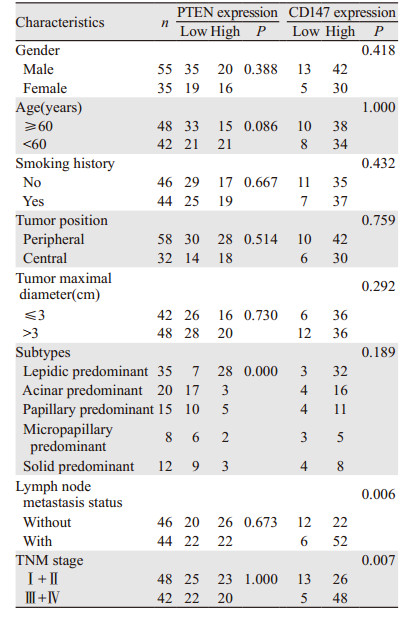
90例肺腺癌中,PTEN与肺腺癌组织学类型有关,即PTEN在贴壁为主表达率(80%)最高,均高于腺泡为主型(15%)、乳头为主型(33.33%)、微乳头为主(25%)和实性为主型(25%),差异有统计学意义(χ2=28.581, P=0.000)。PTEN与肺腺癌患者年龄、吸烟史、大体类型、肿瘤直径、淋巴结有无转移及TNM分期均无关(均P > 0.05)。90例肺腺癌中,CD147在有淋巴结转移的原发灶中高于无淋巴结转移的原发灶,差异有统计学意义(χ2=8.478, P=0.006);其在TNM Ⅲ期+Ⅳ期组高于Ⅰ期+Ⅱ期组,差异有统计学意义(χ2=8.154, P=0.007)。CD147与肺腺癌患者年龄、吸烟史、大体类型、肿瘤直径及肺腺癌组织学类型均无关(均P > 0.05),见表 1。
 |
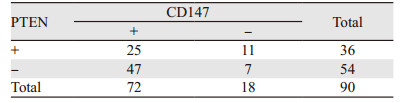
90例患者肺腺癌组织中,PTEN和CD147同时表达阳性者25例(27.78%),同时表达阴性者7例(7.78%),仅CD147表达阳性者47例(52.22%),仅PTEN表达阳性者11例(12.22%)。采用Spearman相关分析,结果显示PTEN与CD147表达呈负相关,差异有统计学意义(r=-0.215, P=0.041),见表 2。
 |
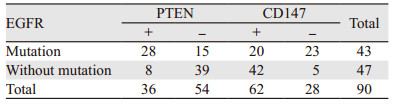
90例肺腺癌中,EGFR基因突变率为47.78%(43/90)。采用Spearman相关分析,结果显示PTEN与EGFR基因突变呈正相关,差异有统计学意义(r=0.490, P=0.000),CD147与EGFR基因突变无明显正相关性(r=0.170, P=0.110),见表 3。
 |
PTEN基因是一种抑癌基因,它能够负性调节细胞生长,诱导凋亡并抑制细胞浸润、转移[2]。目前已在多种肿瘤中发现存在PTEN基因的突变,如乳腺癌、非小细胞肺癌、前列腺癌、恶性间皮瘤[3-6]等。CDl47是一种广泛分布于人体多种组织细胞表面的跨膜糖蛋白,属于免疫球蛋白家族成员。文献研究表明CD147在肝癌、前列腺癌、非小细胞肺癌等来源于上皮性的恶性肿瘤组织中高表达,在正常组织或胚胎性组织中几乎不表达,其高表达与肿瘤的预后不良有关[7-9]。
关于PTEN和CD147两者关系的研究国外尚未见文献报道,国内在胃癌和食管癌中的相关性已有文献报道[10-11],本课题组以往报道了非小细胞肺癌HAb18G(肝细胞膜表面相关蛋白,CD147家族成员之一)和PTEN的表达,并注意到了两者呈负相关[12],最近刘曙光等[13]也注意到PTEN和CD147在非小细胞肺癌的相关性。但由于肺癌组织学亚型种类多样性,且不同组织学亚型的肺癌发病机制不一,临床治疗也存在较大的差异,以往的研究样本量都是笼统的非小细胞癌,并不能准确反映PTEN和CD147在具体亚型肺癌中表达的规律和差异性。由于肺腺癌是肺癌中最常见的组织学类型,本研究中选取90例肺腺癌,观察PTEN和CD147在不同组织学形态亚型的表达规律,同时还观察了PTEN和CD147与肺腺癌EGFR基因突变的关系,以期为肺腺癌的靶向治疗提供一定的依据。
本研究中PTEN蛋白检测结果显示与肺腺癌的组织学类型有关,即PTEN在贴壁为主型肺腺癌和腺泡为主型表达较高,在微乳头和实体为主型表达较低。2015年WHO分类中,贴壁为主型肺腺预后较好,其次是腺泡为主型,微乳头和实体为主型预后最差。PTEN与其他临床病理参数如年龄、性别、吸烟史、肿瘤直径、分期及淋巴结转移无关。而以往研究结果显示PTEN与分化、分期和淋巴结均有关[14-15]。这可能与以下原因有关:(1)样本含量的不同;(2)研究中免疫组织化学结果判读标准的差异;(3)本研究中选取的是肺腺癌标本。
本研究结果表明CD147蛋白与肺腺癌分期及淋巴结有无转移有关,提示该蛋白在肺腺癌的发生发展的过程中可能发挥了重要的作用。CD147蛋白研究结果与以往文献基本相似[1, 8-9]。相关分析结果显示,90例肺腺癌中PTEN和CD147存在负相关,这与以往其在非小细胞肺癌研究结果基本相似[12-13]。
PTEN基因突变或蛋白表达降低可使细胞间的黏附力下降,并能上调基质金属蛋白酶MMPs和血管内皮生长因子VEGF的表达,进而促进肿瘤细胞向间质浸润以及肿瘤血管形成[16-17]。CD147能够刺激基质金属蛋白酶MMPs和血管内皮生长因子VEGF的表达,促进肿瘤细胞的浸润、转移和肿瘤血管的形成[18-19]。根据本研究结果,推测两者可能涉及共同的信号通路,共同促进MMPs和VEGF的产生,两者产生的协同作用促进了肺腺癌的发生、发展。
EGFR基因突变多发于贴壁、微乳头为主的肺腺癌或者含贴壁结构、乳头结构和微乳头结构亚型的肺腺癌,少见于其他亚型[20-21]。本研究中PTEN与肺腺癌组织学亚型有关,其在贴壁为主型的肺腺癌中表达率最高,而在其他亚型中表达率较低,这可能是PTEN蛋白表达与EGFR基因突变呈正相关原因所在。
综上所述,PTEN蛋白在正常肺组织中高表达,肺腺癌中低表达,在贴壁为主肺腺癌有较高的表达率,其蛋白水平的表达与EGFR基因突变呈正相关。CD147蛋白在正常肺组织中几乎不表达,肺腺癌中高表达,蛋白水平表达越高,肿瘤分期越高,淋巴结容易转移,该蛋白的表达与EGFR基因突变无明显相关性。肺腺癌中PTEN蛋白和CD147蛋白呈负相关,两者可能存在某些机制共同作用促进了肺腺癌的发生发展,其分子机制有待进一步研究。
| [1] | Xu XY, Lin N, Li YM, et al. Expression of HAb18G/CD147 and its localization correlate with the progression and poor prognosis of non-small cell lung cancer[J]. Pathol Res Pract, 2013, 209(6): 345–52. DOI:10.1016/j.prp.2013.02.015 |
| [2] | Tay Y, Kats L, Salmena L, et al. Coding-independent regulation of the tumor suppressor PTEN by competing endogenous mRNAs[J]. Cell, 2011, 147(2): 344–57. DOI:10.1016/j.cell.2011.09.029 |
| [3] | Chen Y, van de Vijver MJ, Hibshoosh H, et al. PTEN and NEDD4 in Human Breast Carcinoma[J]. Pathol Oncol Res, 2016, 22(1): 41–7. DOI:10.1007/s12253-015-9971-2 |
| [4] | Shen H, Guan D, Shen J, et al. TGF-β1 induces erlotinib resistance in non-small cell lung cancer by down-regulating PTEN[J]. Biomed Pharmacother, 2016, 77: 1–6. DOI:10.1016/j.biopha.2015.10.018 |
| [5] | Lotan TL, Wei W, Morais CL, et al. PTEN Loss as Determined by Clinical-grade Immunohistochemistry Assay Is Associated with Worse Recurrence-free Survival in Prostate Cancer[J]. Eur Urol Focus, 2016, 2(2): 180–8. DOI:10.1016/j.euf.2015.07.005 |
| [6] | 梁育飞, 郑国启, 李春英, 等. COX-2、NF-κB、WT-1、PTEN在恶性腹膜间皮瘤中的表达及与预后的关系[J]. 肿瘤防治研究, 2016, 43(8): 704–8. [ Liang YF, Zheng GQ, Li CY, et al. Prognostic Significance of COX-2, NF-κB, WT-1 and PTEN Expression in Malignant Peritoneal Mesothelioma[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(8): 704–8. ] |
| [7] | Lee A, Rode A, Nicoll A, et al. Circulating CD147 predicts mortality in advanced hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2016, 31(2): 459–66. DOI:10.1111/jgh.2016.31.issue-2 |
| [8] | Kaira K, Arakawa K, Shimizu K, et al. Relationship between CD147 and expression of amino acid transporters (LAT1 and ASCT2) in patients with pancreatic cancer[J]. Am J Transl Res, 2015, 7(2): 356–63. |
| [9] | Xu X, Liu S, Lei B, et al. Expression of HAb18G in non-small lung cancer and characterization of activation, migration, proliferation, and apoptosis in A549 cells following siRNA-induced downregulation of HAb18G[J]. Mol Cell Biochem, 2013, 383(1-2): 1–11. DOI:10.1007/s11010-013-1722-7 |
| [10] | 许建民, 董涛, 田湘萍, 等. PTEN和AKT2及CD147在胃癌组织中的表达及意义[J]. 中国现代普通外科进展, 2010, 13(9): 681–4. [ Xu JM, Dong T, Tian XP, et al. Expression of PTEN and CD147 and AKT2 in gastric carcinoma tissues and the clinical significance[J]. Zhongguo Xian Dai Pu Tong Wai Ke Jin Zhan, 2010, 13(9): 681–4. ] |
| [11] | 李昌秀, 徐红梅, 杨达荣, 等. CD147PTEN E-钙黏蛋白在食管癌组织中表达与临床病理的关系[J]. 检验医学与临床, 2013, 10(2): 129–31. [ Li CX, Xu HM, Yang DR, et al. The expression of CDl47, PTEN and E-cadherin in esophagcal carcinoma and their correlation with clinical-pathological characteristics[J]. Jian Yan Yi Xue Yu Lin Chuang, 2013, 10(2): 129–31. ] |
| [12] | 徐小艳, 郅程, 陈清, 等. 非小细胞肺癌组织中PTEN和HAb18G的表达及相关关系研究[J]. 实用医学杂志, 2012, 28(5): 701–4. [ Xu XY, Zhi C, Chen Q, et al. Study on the correlation of PTEN and HAb18G expression in non small lung carcinoma tissues[J]. Shi Yong Yi Xue Za Zhi, 2012, 28(5): 701–4. ] |
| [13] | 刘曙光, 邹振宁, 马红梅, 等. CD147和PTEN在非小细胞肺癌中的表达及与临床病理因素的相关性分析[J]. 重庆医学, 2016, 45(19): 2638–40, 2644. [ Liu SG, Zou ZN, Ma HM, et al. The expression of CD147 and PTEN in non small cell lung cancer and their correlation with clinical pathological factors[J]. Chongqing Yi Xue, 2016, 45(19): 2638–40, 2644. DOI:10.3969/j.issn.1671-8348.2016.19.015 ] |
| [14] | 顾学文, 陈月香, 田秀春, 等. PTEN抑癌基因在人胃癌组织中的表达及意义[J]. 肿瘤研究与临床, 2005, 17(1): 18–20. [ Gu XW, Chen YX, Tian XC, et al. Expression and significance of suppressor gene PTEN in human gastric cancer tissues[J]. Zhong Liu Yan Jiu Yu Lin Chuang, 2005, 17(1): 18–20. ] |
| [15] | 米登海, 易继林, 刘恩宇, 等. 血管内皮生长因子与抑癌基因PTEN在肝细胞癌组织中表达及临床意义[J]. 中华肿瘤防治杂志, 2006, 13(15): 1158–62. [ Mi DH, Yi JL, Liu EY, et al. Expressions of VEGF and PTEN in liver cancer and their clinical significance[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2006, 13(15): 1158–62. DOI:10.3969/j.issn.1673-5269.2006.15.010 ] |
| [16] | Moon SK, Kim HM, Kim CH. PTEN induces G1, cell cycle arrest and inhibits MMP-9 expression via the regulation of NF-κB and AP-1 in vascular smooth muscle cells[J]. Arch Biochem Biophys, 2004, 421(2): 267–76. DOI:10.1016/j.abb.2003.11.007 |
| [17] | Tian T, Nan KJ, Wang SH, et al. PTEN regulates angiogenesis and VEGF expression through phosphatase-dependent and-independent mechanisms in HepG2 cells[J]. Carcinogenesis, 2010, 31(7): 1211–9. DOI:10.1093/carcin/bgq085 |
| [18] | Marchiq I, Albrengues J, Granja S, et al. Knock out of the BASIGIN/CD147 chaperone of lactate/H+symporters disproves its pro-tumour actionviaextracellular matrix metalloproteases (MMPs) induction[J]. Oncotarget, 2015, 6(28): 24636–48. DOI:10.18632/oncotarget |
| [19] | Su J, Chen X, Kanekura T. A CD147-targeting siRNA inhibits the proliferation, invasiveness, and VEGF production of human malignant melanoma cells by down-regulating glycolysis[J]. Cancer Lett, 2009, 273(1): 140–7. DOI:10.1016/j.canlet.2008.07.034 |
| [20] | 贺锐, 李建民, 王跃华, 等. EGFR基因突变与肺腺癌新分类及临床病理特征的关系[J]. 临床与实验病理学杂志, 2013, 29(12): 1323–8. [ He R, Li JM, Wang YH, et al. Correlation of epidermal growth factor receptor mutations with the new lung adenocarcinoma classification and their clinicopathological features[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2013, 29(12): 1323–8. ] |
| [21] | Hong SJ, Kim TJ, Choi YW, et al. Radiogenomic correlation in lung adenocarcinoma with epidermal growth factor receptor mutations: Imaging features and histological subtypes[J]. Eur Radiol, 2016, 26(10): 3660–8. DOI:10.1007/s00330-015-4196-z |
 2017, Vol. 44
2017, Vol. 44


