文章信息
- KRT81 rs3660变异对肺癌发病风险的影响
- Effect of KRT81 rs3660 Polymorphism on Risk of Lung Cancer
- 肿瘤防治研究, 2017, 44(4): 295-297
- Cancer Research on Prevention and Treatment, 2017, 44(4): 295-297
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.04.012
- 收稿日期: 2016-06-29
- 修回日期: 2016-12-20
2. 063000 唐山,华北理工大学公共卫生学院
2. College of Public Health, North China University of Science and Technology, Tangshan 063000, China
肺癌是目前严重威胁人类健康的恶性肿瘤之一,其发病率和死亡率均居我国及全球癌症之首[1-2]。肺癌分非小细胞肺癌(non-small cell lung carcinoma, NSCLC)和小细胞肺癌(small cell lung carcinoma, SCLC)两大类,前者约占肺癌总数的85%,而后者约占15%[3]。KRT81(keratin 81)蛋白由KRT81基因编码,是发角蛋白的一种,研究表明角蛋白参与细胞恶性转化和侵袭转移等进程[4-5]。KRT81在肺癌组织中呈显著性高表达[6],而位于KRT81基因3' UTR的rs3660G>C变异影响NSCLC患者的预后[6-9]。rs3660在肺癌细胞中已被证明是一个miR-SNP[6],预示rs3660变异可能会影响NSCLC和SCLC发病风险。本研究采用病例-对照研究方法,探讨KRT81基因rs3660G>C变异对NSCLC和SCLC发病风险的影响。
1 资料与方法 1.1 研究对象收集2008年3月—2012年12月在河北省唐山市工人医院经病理确诊的原发NSCLC患者526例,原发SCLC患者203例。健康对照来自同一时期该院的健康体检者,既往无肿瘤史或体征。NSCLC对照组按性别和年龄(±5)与病例组1:1频数匹配,SCLC对照组按性别和年龄(±5)与病例组2:1频数匹配。用查阅病历资料结合问卷调查的方式收集研究对象一般人口学资料及临床病理资料,并获得知情同意。本研究获得华北理工大学伦理委员会批准。收集每位研究对象的外周静脉血2 ml,用于基因组DNA提取,DNA提取采用北京天根生化科技有限公司提供的DNA提取试剂盒。
1.2 KRT81 rs3660变异基因分型利用TaqMan-MGB探针法进行基因分型,PCR引物(正义引物:5′-TCTTTCTAGGGTGGCCTTTCC-3′,反义引物:5′-AGGCGCCTGGAGCAAGT-3′)及TaqMan-MGB探针(rs3660-G Probe:FAM-CTTTCAAAGTGcAGGAGA-MGB,rs3660-C Probe:TET-TCTTTCAAAGTGgAGGAGA-MGB)。PCR反应在ABI 7900HT Fast Real-Time PCR仪中进行。反应体系为5 µl,含探针各0.2 µl(2 µmol/L),上下游引物各0.15 µl(10 µmol/L),基因组DNA 1 µl(0.1~20 ng),2×PCR mix(TaqMan Universal Master Mix Ⅱ,美国ABI公司)2.5 µl,加水补足。反应条件为:50℃ 2 min,95℃ 10 min,95℃ 15 s,60℃ 1 min,50个循环。使用ABI SDS 2.4软件进行结果判断和分析。每个检测单元均设立阴性对照及两个以上随机重复样本进行质量控制。
1.3 统计学方法采用SPSS16.0对数据进行分析,用χ2检验比较分类变量(性别、年龄和吸烟状况)在病例组和对照组中的分布差异,用Logistic回归计算比值比(odds ratios, OR)及其95%可信区间(confidence intervals, CI),评价KRT81基因rs3660遗传变异与NSCLC和SCLC遗传易感性之间的关系,检验水准为α=0.05。
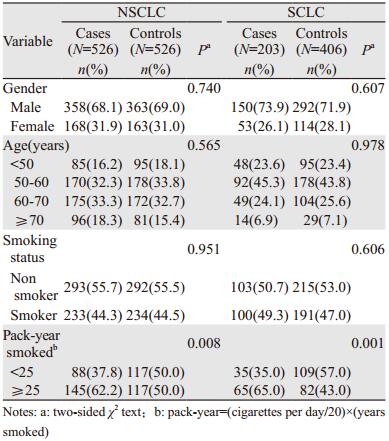
2 结果 2.1 研究对象基本特征研究对象基本资料如表 1所示,NSCLC和SCLC病例组与各自对照组相比,性别、年龄和吸烟状况差异均无统计学意义(P > 0.05)。进一步以累计吸烟量分析,重度吸烟者(≥25包/年)在NSCLC组中占62.2%,显著高于其对照组为50%(P=0.008);在SCLC组中占65%,显著高于其对照组为43%(P=0.001)。
|
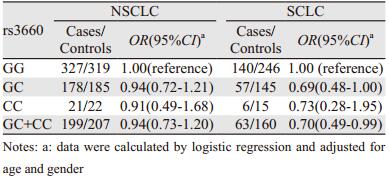
KRT81 rs3660各基因型在NSCLC病例组及其对照组中的分布见表 2。在对照组中,rs3660各基因型分布均符合Hardy-Weinberg遗传平衡(χ2=0.56, P=0.454)。χ2检验未发现rs3660G > C变异影响NSCLC发病风险(P=0.614)。多变量Logistic回归分析显示,与rs3660GG基因型携带者相比,至少携带一个C等位基因者发生NSCLC风险的OR为0.94(95%CI: 0.73~1.20)。KRT81 rs3660各基因型在SCLC病例组及其对照组中的分布同见表 2。在对照组中,rs3660各基因型分布均符合Hardy-Weinberg遗传平衡(χ2=1.28, P=0.257)。χ2检验表明,rs3660G > C变异影响SCLC发病风险(P=0.048)。多变量Logistic回归分析显示,至少携带一个rs3660C等位基因者比GG基因型携带者罹患SCLC风险显著降低(OR=0.70, 95%CI: 0.49~0.99)。
|
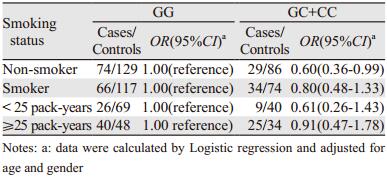
吸烟是肺癌发病的确认风险因素,因而我们进行了吸烟分层分析。如表 3所示,在不吸烟组中,至少携带一个C等位基因的非吸烟者具有较低的SCLC发病风险(OR=0.60, 95%CI: 0.36~0.99,P=0.049)。进一步以累计吸烟量来分析,我们未发现至少携带一个C等位基因的轻度吸烟者(或重度吸烟者)具有较低的SCLC发病风险(OR=0.61, 95%CI: 0.26~1.43, P=0.254)。
|
角蛋白是上皮细胞中间丝的主要成分,维持上皮细胞机械稳定和完整[10],参与细胞极性、压力应答、细胞周期和凋亡等多个生物进程[4]。由于角蛋白在人类肿瘤中呈特征性表达,已广泛作为癌的免疫组学诊断标志物[5, 10]。
KRT81 rs3660遗传变异位于KRT81基因3' UTR,且正处于miR-17、miR-20a/b、miR-93、miR-106a/b和miR-519d的种子序列中,这说明rs3660G/C很可能影响KRT81的表达。Lee等[6]在293T和H1299细胞中进行的双荧光素酶实验证明rs3660是一个功能性miR-SNP、rs3660G等位基因的种子序列可与miRNAs完美结合,抑制荧光素酶活性,且在NSCLC组织中证实了rs3660GG基因型下的KRT81表达水平较低。
本研究显示KRT81 rs3660G等位基因在中国北方健康对照人群中的频率为78%,与Xie等[11]在中国人群中的研究结果一致,高于Campayo等[7]和Robles等[8]在高加索人群中的频率。Robles等[8]研究表明,rs3660GG基因型可降低高加索人NSCLC发病风险,但仅限于男性(ORGG/CC=0.43, 95%CI: 0.21~0.87, P=0.020)。本研究发现KRT81 rs3660G > C变异可影响中国人群SCLC发病风险,但是不影响NSCLC发病风险。Xie等[11]对210例非霍奇金淋巴瘤患者和233例健康者进行了研究,未发现rs3660G > C变异与非霍奇金淋巴瘤发生风险的关系,这可能和不同组织中miRNAs的表达差异有关,如在肺癌组织中miR-17、miR-20a/b和miR-93就呈现出显著性的高表达[12]。在rs3660遗传变异与NSCLC患者的预后分析中,Lee等[6]在韩国人中的研究显示,rs3660C等位基因携带者总生存时间长于GG基因型携带者;Campayo等[7]在欧洲人中的研究发现,CC基因型携带者中位复发时间(20.3月)短于rs3660G等位基因携带者(86.8月)。这些研究表明KRT81 rs3660遗传变异在不同人群、不同组织中具有不同的作用机制。此外,本研究同Lin等[13]的研究(MYCL1 3' UTR rs3134615变异与SCLC发生风险相关)类似,均表明3' UTR遗传变异可影响SCLC发病风险,且都可能采用miR-SNP的作用方式。
综上所述,KRT81 rs3660遗传变异可能通过miR-SNP的方式影响KRT81的表达,进而影响肿瘤的发生发展,而且这种影响可能存在组织性差异。然而,本研究及对rs636832[14-15]等的相关研究结果存在一些矛盾,这可能归于miR-SNP/SNP在不同组织中有差异的作用方式,提示此类研究的结果需结合最新的理论成果及肺癌其他危险因素并在更大样本量的人群中进一步研究证实。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [2] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1): 10–29. DOI:10.3322/caac.20138 |
| [3] | Van Meerbeeck JP, Fennell DA, De Ruysscher DKM. Small-cell lung cancer[J]. The Lancet, 2011, 378(9804): 1741–55. DOI:10.1016/S0140-6736(11)60165-7 |
| [4] | Magin TM, Vijayaraj P, Leube RE. Structural and regulatory functions of keratins[J]. Exp Cell Res, 2007, 313(10): 2021–32. DOI:10.1016/j.yexcr.2007.03.005 |
| [5] | Karantza V. Keratins in health and cancer: more than mere epithelial cell markers[J]. Oncogene, 2011, 30(2): 127–38. DOI:10.1038/onc.2010.456 |
| [6] | Lee SY, Choi JE, Jeon HS, et al. A genetic variation in microRNA target site of KRT81 gene is associated with survival in early-stage non-small-cell lung cancer[J]. Ann Oncol, 2015, 26(6): 1142–8. DOI:10.1093/annonc/mdv100 |
| [7] | Campayo M, Navarro A, Vinolas N, et al. A dual role for KRT81: a miR-SNP associated with recurrence in non-small-cell lung cancer and a novel marker of squamous cell lung carcinoma[J]. PLoS One, 2011, 6(7): e22509. DOI:10.1371/journal.pone.0022509 |
| [8] | Robles A I, Ryan BM. KRT81 miR-SNP rs3660 is associated with risk and survival of NSCLC[J]. Ann Oncol, 2016, 27(2): 360–1. DOI:10.1093/annonc/mdv552 |
| [9] | Lee SY, Choi JE, Park JY. Reply to the letter to the editor ' KRT81 miR-SNP rs3660 is associated with risk and survival of NSCLC' by Robles et al[J]. Ann Oncol, 2016, 27(2): 361–3. DOI:10.1093/annonc/mdv556 |
| [10] | Moll R, Divo M, Langbein L. The human keratins: biology and pathology[J]. Histochem Cell Biol, 2008, 129(6): 705–33. DOI:10.1007/s00418-008-0435-6 |
| [11] | Xie Y, Diao L, Zhang L, et al. A miR-SNP of the KRT81 gene is associated with the prognosis of non-Hodgkin' s lymphoma[J]. Gene, 2014, 539(2): 198–202. DOI:10.1016/j.gene.2014.02.010 |
| [12] | Guan P, Yin Z, Li X, et al. Meta-analysis of human lung cancer microRNA expression profiling studies comparing cancer tissues with normal tissues[J]. J Exp Clin Cancer Res, 2012, 31: 54. DOI:10.1186/1756-9966-31-54 |
| [13] | Xiong F, Wu C, Chang J, et al. Genetic variation in an miRNA-1827 binding site in MYCL1 alters susceptibility to small-cell lung cancer[J]. Cancer Res, 2011, 71(15): 5175–81. DOI:10.1158/0008-5472.CAN-10-4407 |
| [14] | Kim J S, Choi YY, Jin G, et al. Association of a common AGO1 variant with lung cancer risk: a two-stage case-control study[J]. Mol Carcinog, 2010, 49(10): 913–21. DOI:10.1002/mc.20672 |
| [15] | Shang M, Huang Y, Hu X, et al. Association between SNPs in miRNA-machinery genes and chronic hepatitis B in the Chinese Han population[J]. Infect Genet Evol, 2014, 28: 113–7. DOI:10.1016/j.meegid.2014.09.015 |
 2017, Vol. 44
2017, Vol. 44


