文章信息
- 雷替曲塞为基础化疗方案治疗晚期原发性肝癌的临床观察
- Clinical Observation of Raltitrexed-based Regimen for Advanced Primary Liver Carcinoma
- 肿瘤防治研究, 2017, 44(4): 281-285
- Cancer Research on Prevention and Treatment, 2017, 44(4): 281-285
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.04.009
- 收稿日期: 2017-01-17
- 修回日期: 2017-02-14
原发性肝癌是我国常见的恶性肿瘤之一,绝大多数患者就诊时已为局部晚期或有远处转移,失去手术及局部治疗时机。奥沙利铂是被我国SFDA批准的全球首个治疗肝癌的化疗药物,以奥沙利铂为主的FOLFOX4方案在晚期肝癌系统性化疗研究中取得了突破性进展[1],成为公认的治疗晚期肝癌的标准方案之一,但至今尚缺乏标准的二线化疗方案。雷替曲塞是一种特异性胸腺苷酸合成酶(TS)抑制剂,能够选择性抑制TS,从而产生抗癌作用[2],目前已应用于多种实体瘤并取得了较好疗效。南京中医药大学附属八一医院全军肿瘤中心肿瘤内科应用以雷替曲塞为基础化疗方案治疗索拉非尼或奥沙利铂等治疗失败的晚期肝癌患者,取到一定效果,现报告如下。
1 资料与方法 1.1 一般材料收集2013年4月—2016年12月在南京中医药大学附属八一医院全军肿瘤中心肿瘤内科治疗的31例晚期原发性肝癌患者的临床资料,均为住院患者,资料完整。其中男22例,女9例,年龄38~75岁,中位年龄57岁。经病理学诊断为肝细胞癌20例,临床诊断肝细胞癌6例,胆管细胞癌5例。局部晚期4例,肝外转移27例。既往行姑息术13例,根治术2例,肝移植1例,未手术者15例。24例接受过局部治疗(包括介入治疗、射频消融、无水酒精、局部放疗)。31例患者中接受过一线治疗14例,二线治疗10例,三线治疗7例。9例接受过索拉非尼治疗,27例接受过含奥沙利铂的方案化疗。所有病例影像学检查(CT/MR)均有可测量病灶(病灶直径 > 1 cm)。治疗前患者情况均符合化疗要求,均签署知情同意书。
1.2 治疗方法31例患者中雷替曲塞联合伊立替康方案(TOMIRI)20例(伊立替康180 mg/m2静脉滴注d1,雷替曲塞3 mg/m2静脉滴注d2,2周为1周期)、雷替曲塞联合奥沙利铂方案(TOMOX)5例(奥沙利铂85 mg/m2静脉滴注d1,雷替曲塞3 mg/m2静脉滴注d2,2周为1周期)、雷替曲塞联合吉西他滨方案(TOMGEM)4例(吉西他滨1000 mg/m2静脉滴注d1、8,雷替曲塞3 mg/m2静脉滴注d2,3周为1周期)、雷替曲塞单药方案(RTX)2例(雷替曲塞3 mg/m2静脉滴注d1,3周为1周期),2周方案最多用12周期,3周方案最多用6周期。2周方案每3周期评价一次疗效,3周方案每2周期评价一次疗效,如患者出现特殊情况可提前复查评估。化疗时根据联合用药的不同特点,配合止吐、保肝等治疗。
1.3 疗效及不良反应评价疗效评定按照实体瘤疗效评定标准(RECIST1.1标准),分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD);以CR+PR计算有效率(RR),CR+PR+SD计算疾病控制率(DCR);疾病进展时间(TTP)定义为从化疗开始至影像学检查(CT或MR)发现肿瘤进展的时间。总生存期(OS)定义为化疗开始至死亡或者末次随访时间。不良反应评价依据美国国立癌症研究所常见不良反应4.0版标准评价(NCI-CTC 4.0)。所有患者均采用门诊或电话随访,随访截至2016年12月26日,无失访病例。
1.4 统计学方法运用SPASS20.0版统计软件对数据进行处理。生存分析用Kaplan-Meier法计算TTP和OS并绘制生存曲线。P < 0.05为差异有统计学意义。
2 结果 2.1 疗效情况截至2016年12月26日,31例患者均完成了1周期以上的系统化疗。中位化疗周期数为3周期(1~12周期)。31例均可评价疗效:无CR和PR病例,SD 13例(41.9%),PD 18例(58.1%);DCR为41.9%(13/31),RR为0%(0/31)。mTTP为63天(95% CI: 35.719~90.281),TTP最短者15天,最长者238天;mOS为189天(95% CI: 135.100~242.900),最短者43天,最长达1048天,见图 1。31例患者中死亡24例,7例存活仍在继续治疗。
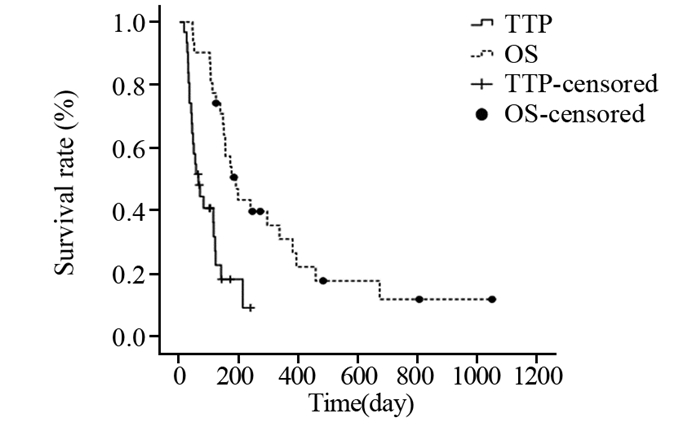
|
| 图 1 接受雷替曲塞为基础化疗方案治疗的31例晚期肝癌患者的疾病进展时间和生存期曲线 Figure 1 Time to progression (TTP) and overall survival (OS) curves of 31 advanced primary liver carcinoma patients treated with raltitrexed-based regimen |
31例患者中,13例SD患者的mTTP为139天(95% CI: 102.266~175.734),mOS为456天(95% CI: 277.690~634.310);18例PD患者mTTP为41天(95% CI: 34.763~47.237),mOS为148天(95% CI: 133.448~162.552)。SD患者的TTP和OS明显优于PD患者(P=0.000018; P=0.001),见图 2。
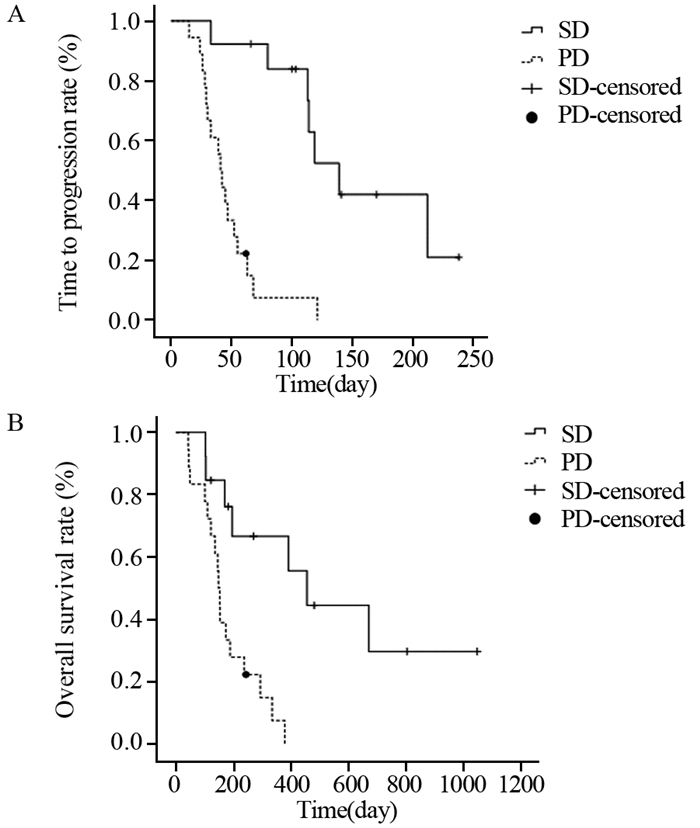
|
| 图 2 接受雷替曲塞为基础化疗方案治疗的31例晚期肝癌SD和PD患者的TTP (A) 和OS (B) 曲线 Figure 2 TTP (A) and OS (B) curves of 31 advanced primary liver carcinoma patients treated with raltitrexed-based regimen who were evaluated with SD or PD |
本组26例肝细胞癌中,11例SD(42.3%),15例PD(57.7%),mTTP为63天(95% CI: 31.207~94.793),mOS为189天(95% CI: 148.931~229.069);5例胆管细胞癌中,2例SD(40.0%),3例PD(60.0%),mTTP为29天(95% CI: 22.853~31.147),mOS为101天(95% CI: 0.000~221.236)。肝细胞癌患者与胆管细胞癌患者的TTP(P=0.445)与OS(P=0.915)比较差异均无统计学意义,见图 3。
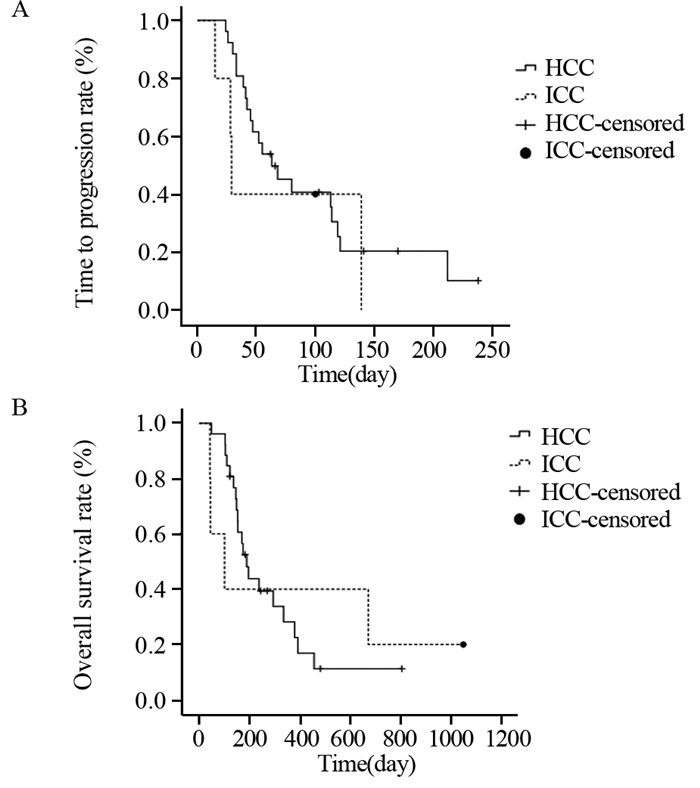
|
| HCC: hepatocellular carcinoma; ICC: intrahepatic cholangiocarcinoma 图 3 接受雷替曲塞为基础化疗方案治疗的31例晚期HCC和ICC患者的TTP (A) 和OS (B) 曲线 Figure 3 TTP (A) and OS (B) curves of 31 advanced HCC and ICC patients treated with raltitrexed-based regimen |
本研究共纳入4种含雷替曲塞化疗方案。TOMIRI方案20例,8例SD(40.0%),12例PD(60.0%),mTTP为55天(95% CI: 14.095~95.905),mOS为153天(95% CI: 83.028~222.972);TOMOX方案5例,3例SD(60.0%),2例PD(40.0%),mTTP为113天(95% CI: 35.009~190.991),mOS为174天(95% CI: 165.412~182.588);TOMGEM方案4例,1例SD(25.0%),3例PD(75.0%),mTTP为26天(95% CI: 0.000~53.440),mOS为335天(95% CI: 106.660~563.340);RTX方案2例,1例SD(50.0%),1例PD(50.0%)。各方案间TTP(P=0.513)和OS(P=0.609)比较差异均无统计学意义,见图 4。
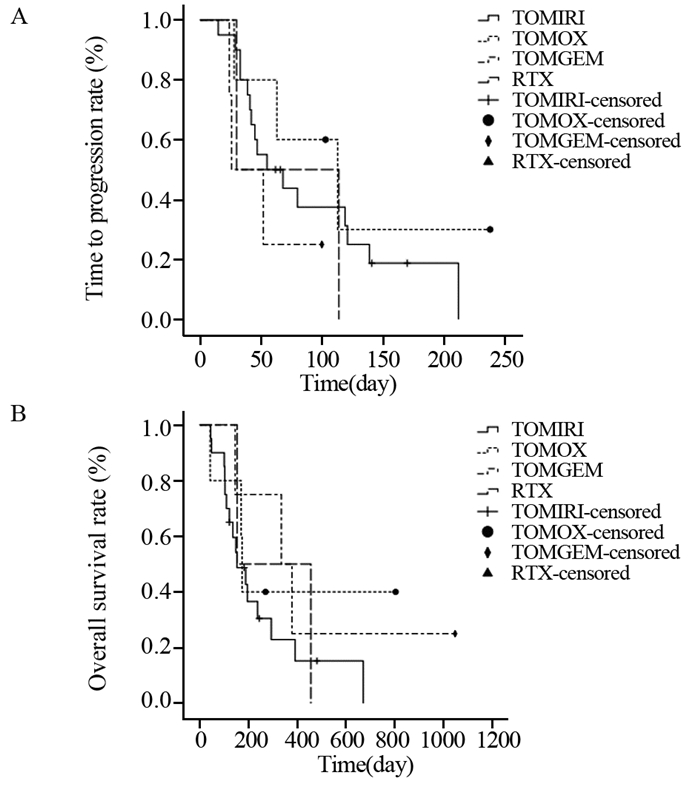
|
| 图 4 接受不同雷替曲塞为基础化疗方案的31例晚期原发性肝癌患者的TTP (A) 和OS (B) 曲线 Figure 4 TTP (A) and OS (B) curves of 31 advanced primary liver carcinoma patients treated with different raltitrexed-based regimens |
14例二线治疗患者中,5例SD(35.7%),9例PD(64.3%),mTTP为45天(95% CI: 30.333~59.667),mOS为170天(95% CI: 105.831~234.169);10例三线治疗患者中,5例SD(50.0%),5例PD(50.0%),mTTP为45天(95% CI: 28.308~199.692),mOS为196天(95% CI: 0.000~613.336);7例四线治疗患者中,3例SD(42.9%),4例PD(57.1%),mTTP为80天(95% CI: 45.129~114.871),mOS为174天(95% CI: 97.963~250.037)。各线治疗间TTP(P=0.252)和OS(P=0.36)比较差异均无统计学意义,见图 5。
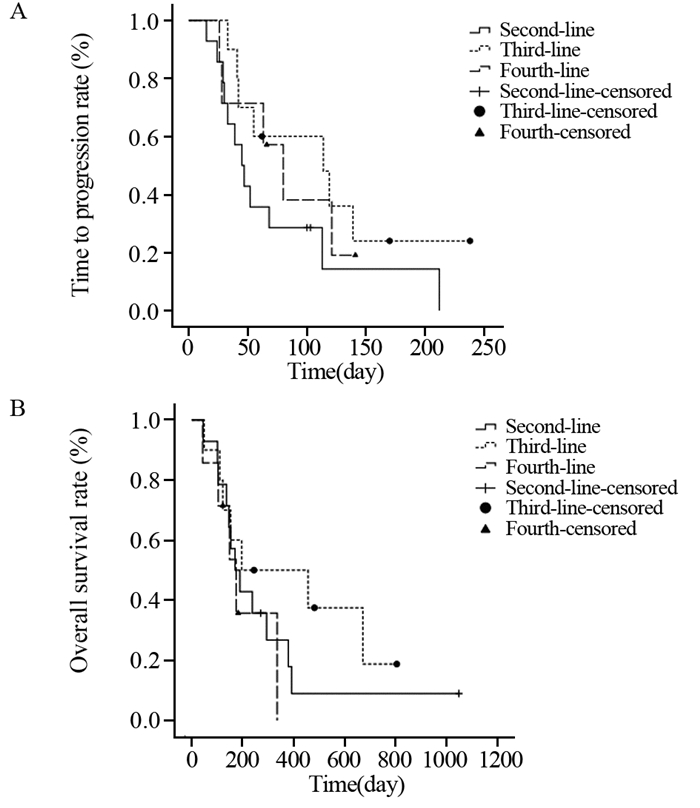
|
| 图 5 接受雷替曲塞为基础化疗方案不同线数治疗的31例晚期肝癌患者的TTP (A) 和OS (B) 曲线 Figure 5 TTP (A) and OS (B) curves of 31 advanced primary liver carcinoma patients treated with different raltitrexed-based regimens in different lines |
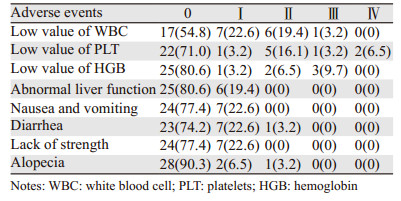
31例患者中有23例出现不同程度的不良反应,见表 1。有1例患者因反复Ⅲ级血红蛋白下降终止化疗。白细胞和中性粒细胞降低的患者,在经皮下注射粒细胞集落刺激因子后均可恢复正常,血小板降低患者接受白介素-11、血小板生成素治疗后均恢复正常。本组未发生化疗相关性死亡。
|
我国是原发性肝癌高发国家,新发和死亡患者各占全球总数的54.3%和51.3%[3]。然而仅有15%~20%的患者有机会施行手术治疗,肝动脉栓塞化疗、射频消融和放疗等局部治疗手段也因其各自的局限性,最终仍无法避免复发或转移。目前靶向治疗药物索拉非尼是唯一一个被多个国家批准用于不可手术切除晚期肝细胞癌患者的药物,其作用一方面能够抑制Raf/MEK/ERK信号通路中激酶的活性,另一方面能够抑制血管内皮生长因子受体和血小板衍生生长因子受体的络氨酸激酶的活性,通过这两方面作用同时发挥抑制细胞增殖和抗肿瘤血管生成的作用[4-6]。一项Ⅲ期临床试验证实索拉非尼能够延长晚期肝细胞癌患者的中位生存期2.3~2.8月,延长中位TTP 1.4~2.7月[7-8],但是索拉非尼的有效率和疾病控制率均差强人意,另外患者产生索拉非尼耐药也是疾病进展的重要因素。我国学者开展的一项亚太地区的国际临床试验证实以奥沙利铂为主的FOLFOX4化疗方案使晚期肝癌患者的复发转移风险降低了38%,死亡风险降低了20%[1],可以延长中国患者的中位生存期。据此,我国SFDA批准奥沙利铂可以用于治疗肝癌,并将奥沙利铂为基础的FOLFOX方案列入了我国《原发性肝癌的诊疗规范》中。近年来以奥沙利铂为主的方案广泛用于晚期原发性肝癌的治疗中,并取得了良好的疗效[9-10]。然而对于索拉非尼或奥沙利铂治疗失败的患者目前仍然缺乏有效的手段,成为临床治疗的难题。
雷替曲塞和氟尿嘧啶均为TS抑制剂,雷替曲塞的半衰期较长(120天)[11],并且在细胞内形成的化合物能够长时间潴留在肿瘤细胞内发挥持久抗肿瘤作用[12],与氟尿嘧啶(5-Fu)无交叉耐药性。目前雷替曲塞已应用于结直肠癌、胃癌等多种实体瘤的治疗中,尤其在结直肠癌中应用广泛[13-16],但在原发性肝癌的系统治疗方面研究少见报道,多见用于肝癌的介入治疗。CPT-11、OXA、GEM是临床常用的化疗药物,尽管CPT-11、GEM目前尚未批准治疗肝癌,但已有体内外研究证实两者对肝癌细胞具有杀伤作用及对晚期原发性肝癌患者有一定疗效[17-20],与雷替曲塞联合有可能起到增效作用。Zhao等在体外研究中发现雷替曲塞对HepG2细胞的抑制作用是通过下调细胞周期调节蛋白A和CDK2的表达将HepG2细胞阻滞在G0/G1达到的;同时还发现雷替曲塞能够上调肿瘤抑制基因p16和p53的表达,这可能与周期调节蛋白A/CDK2的表达减少相关[21]。有研究报道,对病理学诊断为肝细胞癌的患者,给予雷替曲塞单药化疗(3.0 g/m2静脉滴注),3周为1周期,结果显示:12例SD(46%),14例PD(56%),肿瘤可得到有效控制[22]。亦有将雷替曲塞用于肝动脉介入治疗的研究,患者接受雷替曲塞联合奥沙利铂介入治疗后疾病控制率达96.1%,中位OS为13.4月,中位PFS为6.7月,且不良反应发生率也较低[23]。
本研究显示,治疗后虽然未有缓解患者,但DCR为41.9%,mTTP为63天,mOS达189天,与Oriental[24]和EACH[1]等的研究结果基本一致。从SD和PD患者与疗效关系来看,获得SD的患者的mTTP达139天,mOS达456天,明显长于PD患者(mTTP为41天,mOS为148天),说明长期SD能转化为生存获益。不同的病理类获益可能亦有不同,26例肝细胞癌患者的mOS为189天,5例胆管细胞癌患者mOS为101天,肝细胞癌的治疗效果优于胆管细胞癌,说明胆管细胞癌的治疗难度更大。与不同的化疗药物联合,各方案之间疗效虽无明显差异,提示对于标准治疗失败的患者后续治疗有了更多选择。不同的治疗线数也对疗效有影响,但本研究显示各线治疗后均能获益,说明线数并不是唯一的决定因素,还可能与体能状态、骨髓及肝肾功能等有关。本研究有17例患者进入三线以上治疗,但患者的体力状况均较好,可以继续耐受化疗,且不良反应能耐受,所以取得了与二线治疗相似的疗效,提示对临床标准治疗失败的患者如果体力状况及其他状态符合化疗要求,可以不受线数的限制。
综上所述,雷替曲塞作为一种TS酶的抑制剂,具有在细胞内半衰期长,特异性强,不易产生交叉耐药,用药简便,耐受性好等特点。对于接受过多种治疗手段包括索拉非尼和奥沙利铂为基础化疗方案治疗失败的晚期原发性肝癌患者不失为一种可供选择的药物。由于本研究病例数较少,且为回顾性总结,其确切疗效还有待于今后扩大样本量做进一步研究。
| [1] | Qin S, Bai Y, Lim HY, et al. Randomized, multicenter, open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia[J]. J Clin Oncol, 2013, 31(28): 3501–8. DOI:10.1200/JCO.2012.44.5643 |
| [2] | Waldman BC, Wang Y, Kilaru K, et al. Induction of intrachromosomal homologous recombination in human cells byraltitrexed, an inhibitor of thymidylatesynthase[J]. DNA Repair (Amst), 2008, 7(10): 1624–35. DOI:10.1016/j.dnarep.2008.06.006 |
| [3] | Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide:IARC Cancer Base No.11[DB/OL]. Lyon: International Agency for Research on Cancer. http://globocan.iarc.fr, 2017-01-15. |
| [4] | Sideras K, Bots SJ, Biermann K, et al. Tumour antigen expression in hepatocellular carcinoma in a low endemic western area[J]. Br J Cancer, 2015, 112(12): 1911–20. DOI:10.1038/bjc.2015.92 |
| [5] | Carey RA, Nathaniel SD, Das S, et al. Cavernous sinus syndrome due to skull base metastasis:A rare presentation of hepatocellular carcinoma[J]. Neurol India, 2015, 63(3): 437–9. DOI:10.4103/0028-3886.158247 |
| [6] | Chen JH, Wei CK, Lee CH, et al. The safety and adequacy of resection on hepatocellular carcinoma larger than 10cm:A retrospective study over 10 years[J]. Ann Med Surg (Lond), 2015, 4(2): 193–9. DOI:10.1016/j.amsu.2015.05.003 |
| [7] | Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359(4): 378–90. DOI:10.1056/NEJMoa0708857 |
| [8] | Cheng AL, Kang YK, Chen Z, et al. Efficancy and safety of sorafenib in patients in the Asia Pacific region with advanced hepatocellular carcinoma:a phaseⅢrandomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1): 25–34. DOI:10.1016/S1470-2045(08)70285-7 |
| [9] | 杨柳青, 秦叔逵, 华海清, 等. XELOX方案治疗中晚期原发性肝癌的临床观察[J]. 临床肿瘤学杂志, 2013, 18(8): 704–8. [ Yang LQ, Qing SK, Hua HQ, et al. Clinical observation on XELOX regimen as systemic chemotherapy for advanced primary liver carcinoma[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2013, 18(8): 704–8. ] |
| [10] | 王锋, 秦叔逵, 华海清, 等. 含奥沙利铂化疗方案治疗对索拉非尼耐药的晚期原发性肝癌的临床观察[J]. 临床肿瘤学杂志, 2014, 19(3): 226–30. [ Wang F, Qing SK, Hua HQ, et al. Clinical observation of oxaliplatin-based regimen for sorafenib-resistant advanced primary liver carcinoma[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2014, 19(3): 226–30. ] |
| [11] | Leonardi MC, Zampino MG, Luca F, et al. Pre-operative radiochemotherapy with raltitrexed for resectable localy advanced rectal cancer: aphaseⅡstudy[J]. Anticancer Res, 2006, 26(3B): 2419–23. |
| [12] | Wilson KS, Malfair Taylor SC. Raltitrexed:optimism and reality[J]. Expert Opin Drug Metab Toxic, 2009, 5(11): 1447–54. DOI:10.1517/17425250903307455 |
| [13] | Deboever G, Hiltrop N, Cool M, et al. Alternative treatment options in colorectalcancer patients with 5-fluorouracil or capecitabine induced cardiotoxicity[J]. Clin Colorectal Cancer, 2013, 12(1): 8–14. DOI:10.1016/j.clcc.2012.09.003 |
| [14] | 岳顺, 张大红, 周磊磊. 雷替曲塞联合多西他赛治疗晚期胃癌的临床疗效[J]. 肿瘤防治研究, 2014, 41(2): 160–2. [ Yue S, Zhang DH, Zhou LL. Clinical Efficacy of Raltitrexed Combined with Docetaxel for Advanced Gastric Cacinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(2): 160–2. ] |
| [15] | 王俊斌, 吴穷, 邹维燕, 等. 雷替曲塞或氟尿嘧啶联合伊立替康二线治疗晚期结直肠癌疗效分析[J]. 肿瘤防治研究, 2014, 41(12): 1335–8. [ Wang JB, Wu Q, Zou WY, et al. Therapeutic Effect of Raltitrexed or Fluorouracil plus Irinotecan as Second-line Treatment for Advanced Colorectal Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(12): 1335–8. DOI:10.3971/j.issn.1000-8578.2014.12.018 ] |
| [16] | Barni S, Ghidini A, Coinu A, et al. A systematic review of raltitrexed-based first-line chemotherapy in advanced colorectal cancer[J]. Anticancer Drugs, 2014, 25(10): 1122–8. DOI:10.1097/CAD.0000000000000133 |
| [17] | Ang C, O'Reilly EM, Carvajal RD, et al. A Nonrandomized, Phase Ⅱ Study of Sequential Irinotecan and Flavopiridol in Patients With Advanced Hepatocellular Carcinoma[J]. Gastrointest Cancer Res, 2012, 5(6): 185–9. |
| [18] | Shao J, Xu Z, Peng X, et al. Gefitinib Synergizes with Irinotecan to Suppress Hepatocellular Carcinoma via Antagonizing Rad51-Mediated DNA-Repair[J]. PLoS One, 2016, 11(1): e0146968. DOI:10.1371/journal.pone.0146968 |
| [19] | Wang Z, Zhao Z, Wu T, et al. Sorafenib-irinotecan sequential therapy augmented the anti-tumor efficacy of monotherapy in hepatocellular carcinoma cells HepG2[J]. Neoplasma, 2015, 62(2): 172–9. DOI:10.4149/neo_2015_022 |
| [20] | Devulapally R, Foygel K, Sekar TV, et al. Gemcitabine and Antisense-microRNA Co-encapsulated PLGAPEG Polymer Nanoparticles for Hepatocellular Carcinoma Therapy[J]. ACS Appl Mater Interfaces, 2016, 8(49): 33412–22. DOI:10.1021/acsami.6b08153 |
| [21] | Zhao H, Zhang Y, Sun J, et al. Raltitrexed Inhibits HepG2 Cell Proliferation via G0/G1 Cell Cycle Arrest[J]. Oncol Res, 2016, 23(5): 237–48. DOI:10.3727/096504016X14562725373671 |
| [22] | Rougier P, Ducreux M, Kerr D, et al. A phase Ⅱ study of raltitrexed ('Tomudex') in patients with hepatoceluar carcinoma[J]. Ann Oncol, 1997, 8(5): 500–2. DOI:10.1023/A:1008249328792 |
| [23] | Zhao C, Fan L, Qi F, et al. Raltitrexed plus oxaliplatin-based transarterial chemoembolization in patients with unresectable hepatocelluar carcinoma[J]. Anticancer Drugs, 2016, 27(7): 689–94. DOI:10.1097/CAD.0000000000000371 |
| [24] | Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase Ⅲ randomized, double-blind, piacebo-controlled trial[J]. Lancet Oncol, 2009, 10(1): 25–34. DOI:10.1016/S1470-2045(08)70285-7 |
 2017, Vol. 44
2017, Vol. 44


