文章信息
- 胰岛素受体酪氨酸激酶底物p53蛋白在上皮性卵巢癌中的表达及其对患者预后的影响
- Expression of IRSp53 in Epithelial Ovarian Carcinoma and Its Prognostic Significance
- 肿瘤防治研究, 2017, 44(4): 272-275
- Cancer Research on Prevention and Treatment, 2017, 44(4): 272-275
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.04.007
- 收稿日期: 2016-10-27
- 修回日期: 2016-12-22
上皮性卵巢癌(epithelial ovarian cancer, EOC)的死亡率位居妇科恶性肿瘤中病死率的首位,由于其发病隐匿,大部分患者就诊时已处于中晚期,并且已向盆腹腔扩散和远处转移等,所以如何做到早期诊断是一大难题[1-2]。EOC的病因尚不清楚,大量研究证实其发生发展可能是多基因、多步骤、多阶段改变的过程[3-4]。近年来,有学者研究发现细胞内一些结构如细胞骨架的改变可能与细胞癌变密切相关[5-6]。胰岛素受体酪氨酸激酶底物p53蛋白(insulin receptor tyrosine kinase substrate p53, IRSp53)目前已被证实是一个控制细胞迁移能力的关键蛋白,可以启动恶性肿瘤侵袭过程中丝状伪足的形成,并对癌细胞的运动能力产生相应的影响[7-8]。基于此,本研究初步探讨IRSp53蛋白表达在EOC发生发展中的作用,旨在了解IRSp53蛋白表达的变化在EOC早期诊断和预后中的作用,为临床治疗EOC提供新的思路。
1 资料与方法 1.1 标本收集选择西宁市第一人民医院2008年1月至2010年12月76例经病理学专家进行组织学认定的手术存档ECO组织蜡块,均取自女性患者。标本制片后,分别进行免疫组织化学检测。EOC患者中位年龄为52(30~76)岁,组织病理分级参照国际妇产科协会(FIGO)联合国际妇科肿瘤协会(IGCS)共同制定的妇科恶性肿瘤分期标准(2000年):Ⅰ期13例,Ⅱ期18例,Ⅲ期39例,Ⅳ期6例;组织病理分级参照WHO肿瘤组织学分类标准(1999年):G1级20例,G2级25例,G3级31例;病理学类型:浆液型47例,黏液型20例,透明细胞型9例;淋巴结转移25例,无淋巴结转移51例。所有病例均有完整的病理资料,并且EOC患者均为初发,术前均未接受过放化疗治疗。本研究征得所有研究对象的知情同意和本院伦理委员会批准,实验过程严格按照国家伦理学审查机构和协议进行。
1.2 主要试剂鼠抗人IRSp53单克隆抗体(ab106775)购自英国Abcam公司,抗体稀释液、免疫组织化学二抗试剂盒和浓缩型DAB试剂盒均购自美国Santa Cruz公司。
1.3 免疫组织化学方法存档蜡块制成厚4 μm的连续病理切片,以PBS代替一抗作阴性对照,用已知阳性切片作阳性对照,抗原修复采用EDTA(pH9.0)抗原修复液高压锅热修复。鼠抗人IRSp53单克隆抗体的工作浓度为1:200,置于4℃冰箱孵育过夜。PBS冲洗2次,滴加二抗后室温孵育30 min,DAB显色,苏木精对比染色,脱水、透明、封固。
1.4 阳性结果判断IRSp53阳性表达判定:以细胞质呈现棕黄色及棕褐色颗粒者为阳性细胞,测定时采用双盲法,由两名经验丰富的病理科医生在200倍光学显微镜下随机选择5个视野进行半定量计数[6]。根据染色强度,无色积分为0分,浅黄色积分为1分,棕黄色积分为2分,棕褐色积分为3分;阳性细胞数比例 < 25%为0分,25%~50%为1分,50%~75%为2分,> 75%为3分。将每张切片的染色强度评分和阳性细胞比例评分相乘,乘积0~1为(-),2~3分为(+),4~6分为(++),7~9分(+++),最后将(++)和(+++)为高表达组,(-)和(+)为低表达组。
1.5 统计学方法采用SPSS13.0软件,计量资料以(x±s)表示,进行t检验和Mann-Whitney U非参数检验;计数资料采用χ2检验,生存曲线采用Kaplan-Meier法进行评估,IRSp53不同程度表达与病理分级之间关系采用Wilcoxon秩和检验,线性相关性研究采用Spearman相关分析法,P < 0.05为差异有统计学意义。
2 结果 2.1 IRSp53在EOC中的表达免疫组织化学法检测结果显示,IRSp53蛋白主要表达于胞膜和胞质中,在细胞核中基本无表达,呈棕黄色颗粒,见图 1。
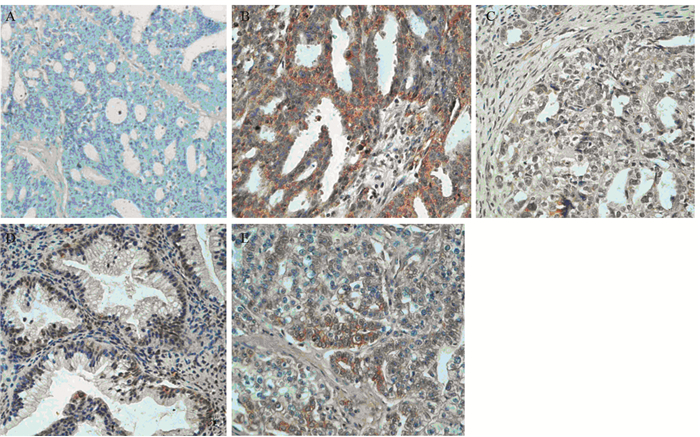
|
| A: negative expression of IRSp53 in EOC tissues; B: high expression of IRSp53 in serous EOC tissues; C: low expression of IRSp53 in serous EOC tissues; D: positive expression of IRSp53 in mucinous EOC tissues; E: positive expression of IRSp53 in transparent cells EOC; EOC: epithelial ovarian cancer 图 1 IRSp53在EOC组织中的表达 (×200) Figure 1 The expression of IRSp53 in EOC tissues (×200) |
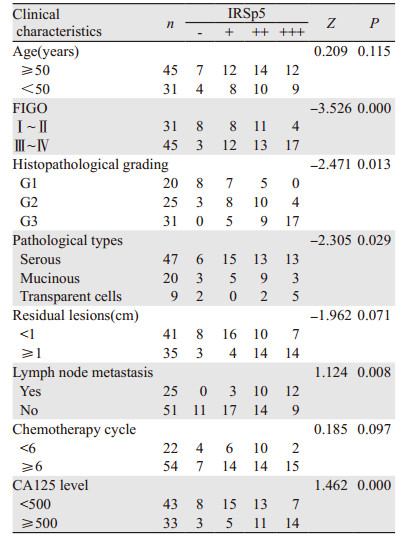
76例EOC组织中,IRSp53蛋白的表达与FIGO分期(Z=-3.526, P=0.000)、组织病理分级(Z=-2.471, P=0.013)、病理学类型(Z=-2.305, P=0.029)、淋巴结转移(Z=1.124, P=0.008)和CA125水平(Z=1.462, P=0.000)显著相关,见表 1。
|
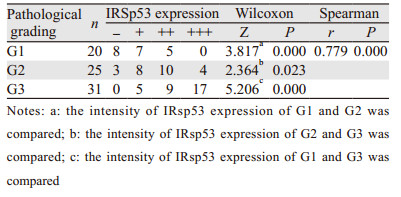
Wilcoxon秩和检验结果显示,与G1级相比,G2、G3级EOC组织中IRSp53蛋白表达强度显著升高(P < 0.05);与G2级相比,G3级EOC组织中IRSp53蛋白表达强度显著升高(P < 0.05)。Spearman相关分析结果显示,IRSp53的表达强度与组织病理分级之间呈显著正相关性(r=0.779, P < 0.05),见表 2。
|
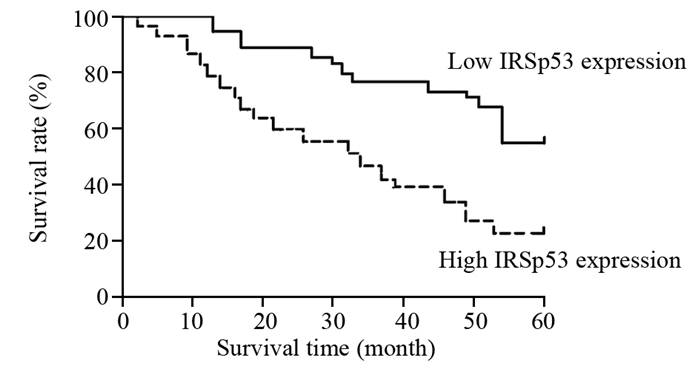
45例IRSp53蛋白高水平表达患者的术后5年累积生存率为23.8%,31例IRSp53蛋白低水平表达患者的术后5年累积生存率为57.5%。经Log rank检验,IRSp53蛋白低水平表达患者的5年累积生存率显著高于IRSp53蛋白高水平表达者(χ2=5.018, P=0.016),见图 2。
|
| 图 2 IRSp53蛋白表达水平与EOC患者预后关系 Figure 2 Relationship between IRSp53 expression and prognosis of EOC patients |
EOC是卵巢癌最常见的类型,晚期患者5年生存率仅为20%~25%[9-10]。目前,肿瘤细胞减灭术、联合药物化疗及靶向治疗是临床治疗EOC的主要方案,但仍有75%的患者经治疗后复发[11]。因此,寻找能够早期诊断并有效预测患者预后的、特异性强、灵敏度高的分子标志物,对改善EOC患者的预后及提高生存率具有重要的临床意义。近年来研究发现,恶性肿瘤的侵袭转移与伪足的形成和细胞骨架重排密切相关,预防这些触须状结构的伪足形成,能阻止癌症扩散[12]。通过探寻调控EOC伪足形成的关键蛋白,能够为早期有效诊断EOC并改善患者的预后提供潜在的可能。
IRSp53属于I-BAR结构域蛋白家族,是一个控制细胞迁移能力的关键蛋白,介导伪足的形成并参与细胞骨架重排,在肿瘤的发生发展中发挥重要的作用[13]。IRSp53主要含有I-BAR、CRIB、SH3及WH2四个结构域,其中I-BAR能够与细胞膜结合产生负向的向外的膜突起,促进伪足的形成。最新研究发现CRIB、SH3及WH2共同参与调节肌动蛋白,并与小GTP酶发生相互作用,参与丝状伪足和板状伪足的形成。Chen等[14]发现SOS1/Rac1-IRSp53-ABI1信号通路存在于卵巢癌患者的腹水中并有效地促进细胞迁移;Kast等[15]研究发现正常人类IRSp53处于封闭的非活动构象,肿瘤促进因子Eps8绑定到SH3域能协同IRSp53开放;Oikawa等[16]研究发现IRSp53蛋白含有I-BAR结构域,其将膜变形成突起并结合到Rac,CRIB基序与Cdc42相互作用,能促进卵巢癌细胞伪足的形成且支持细胞的迁移。因此,IRSp53可能作为早期诊断卵巢癌和评估卵巢癌预后的分子标志。
本研究检测IRSp53在EOC中的表达并分析其与EOC患者临床病理特征及预后的关系,结果显示IRSp53蛋白的表达与EOC的FIGO分期、组织病理分级、病理学类型、淋巴结转移和CA125水平关系密切,其中IRSp53在FIGO分期Ⅳ期高分化癌、浆液性、淋巴结转移和CA125水平大于500的EOC组织中呈现高表达。同时相关性分析显示IRSp53的表达强度与病理分级之间呈显著正相关性,生存曲线分析发现IRSp53高水平表达患者的5年累积生存率显著低于低水平表达患者,提示IRSp53高表达患者的预后更差。据此,我们认为IRSp53可能是EOC发生发展过程中的关键调控因子,其表达异常是导致EOC患者病情恶化的一个早期事件,同时也是部分EOC患者的组织病理分级由低分数向高分数发展的一个分子转变过程。
综上所述,IRSp53可能是EOC发生发展过程中的关键调控因子,其过度表达导致患者的预后更差。因此,IRSp53在EOC中可能发挥重要作用,可能成为未来治疗EOC的新靶点。
| [1] | Chambers SK. Role of CSF-1 in progression of epithelial ovarian cancer[J]. Future Oncol, 2016, 5(9): 1429–40. |
| [2] | Nassir M, Guan J, Luketina H, et al. The role of HE4 for prediction of recurrence in epithelial ovarian cancer patients-results from the OVCAD study[J]. Tumour Biol, 2016, 37(3): 3009–16. DOI:10.1007/s13277-015-4031-9 |
| [3] | Zhang Z, Zhou B, Gao Q, et al. A polymorphism at miRNA-122-binding site in the IL-1α 3'UTR is associated with risk of epithelial ovarian cancer[J]. Fam Cancer, 2014, 13(4): 595–601. DOI:10.1007/s10689-014-9739-y |
| [4] | Colombo PE, Fabbro M, Theillet C, et al. Sensitivity and resistance to treatment in the primary management of epithelial ovarian cancer[J]. Crit Rev Oncol Hematol, 2014, 89(2): 207–16. DOI:10.1016/j.critrevonc.2013.08.017 |
| [5] | Chieng CK, Say YH. Cellular prion protein contributes to LS 174T colon cancer cell carcinogenesis by increasing invasiveness and resistance against doxorubicin-induced apoptosis[J]. Tumour Biol, 2015, 36(10): 8107–20. DOI:10.1007/s13277-015-3530-z |
| [6] | Girault A, Privé A, Trinh NT, et al. Identification of KvLQT1 K+ channels as new regulators of non-small cell lung cancer cell proliferation and migration[J]. Int J Oncol, 2014, 44(3): 838–48. |
| [7] | Chung W, Choi SY, Lee E, et al. Social deficits in IRSp53 mutant mice improved by NMDAR and mGluR5 suppression[J]. Nat Neurosci, 2015, 18(3): 435–43. DOI:10.1038/nn.3927 |
| [8] | Thomas A, Mariani-Floderer C, López-Huertas MR, et al. Involvement of the Rac1-IRSp53-Wave2-Arp2/3 Signaling Pathway in HIV-1 Gag Particle Release in CD4 T Cells[J]. J Virol, 2015, 89(16): 8162–81. DOI:10.1128/JVI.00469-15 |
| [9] | Karimi-Zarchi M, Mortazavizadeh SM, Bashardust N, et al. The Clinicopathologic Characteristics and 5-year Survival Rate of Epithelial Ovarian Cancer in Yazd, Iran[J]. Electron Physician, 2016, 8(1): 1399–406. |
| [10] | Koh SC, Razvi K, Chan YH, et al. The association with age, human tissue kallikreins 6 and 10 and hemostatic markers for survival outcome from epithelial ovarian cancer[J]. Arch Gynecol Obstet, 2011, 284(1): 183–90. DOI:10.1007/s00404-010-1605-z |
| [11] | Lu Y, Huang S, Li P, et al. Prognostic evaluation of preoperative serum C-reactive protein concentration in patients with epithelial ovarian cancer[J]. Exp Ther Med, 2015, 9(5): 2003–7. |
| [12] | López-Contreras L, Hernández-Ramírez VI, Flores-García Y. Src and PI3 K inhibitors affect the virulence factors of Entamoeba histolytica[J]. Parasitology, 2013, 140(2): 202–9. DOI:10.1017/S0031182012001540 |
| [13] | Chen CJ, Shih CH, Chang YJ, et al. SH2B1 and IRSp53 proteins promote the formation of dendrites and dendritic branches[J]. J Biol Chem, 2015, 290(10): 6010–21. DOI:10.1074/jbc.M114.603795 |
| [14] | Chen H, Wu X, Pan ZK, et al. Integrity of SOS1/EPS8/ABI1 tri-complex determines ovarian cancer metastasis[J]. Cancer Res, 2010, 70(23): 9979–90. DOI:10.1158/0008-5472.CAN-10-2394 |
| [15] | Kast DJ, Yang C, DisanzaA, et al. Mechanism of IRSp53 inhibition and combinatorial activation by Cdc42 and downstream effectors[J]. Nat Struct Mol Biol, 2014, 21(4): 413–22. DOI:10.1038/nsmb.2781 |
| [16] | Oikawa T, Okamura H, Dietrich F, et al. IRSp53 mediates podosome formation via VASP in NIH-Src cells[J]. PLoS One, 2013, 8(3): e60528. DOI:10.1371/journal.pone.0060528 |
 2017, Vol. 44
2017, Vol. 44
