文章信息
- 卵巢癌化疗患者紫杉醇血药浓度监测的临床价值
- Clinical Value of Pharmacokinetic Monitoring of Serum Paclitaxel Concentration in Paclitaxel-based Chemotherapy on Patients with Ovarian Cancer
- 肿瘤防治研究, 2017, 44(4): 268-271
- Cancer Research on Prevention and Treatment, 2017, 44(4): 268-271
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.04.006
- 收稿日期: 2016-07-13
- 修回日期: 2016-11-04
2. 430079 武汉,湖北省肿瘤医院妇瘤科
2. Depatment of Gynecologic Oncology, Hubei Cancer Hospital, Wuhan 430079, China
卵巢癌是一种严重危害妇女健康的疾病,是我国常见的恶性肿瘤之一。紫杉醇作为卵巢癌最有效的化疗药物之一,已经被广泛应用于一线化疗方案中[1]。与大部分化疗药物相似,紫杉醇的使用剂量是依据患者体表面积(body surface area, BSA)计算的,个体间的差异很大,患者往往疗效不是很明显,但不良反应却很大[2-4]。因此,如果能监测紫杉醇的血药浓度,实现“剂量个体化”,能否控制化疗药物的毒性,改善化疗效果?本试验采用一种新的胶乳免疫比浊法,利用全自动生化分析仪检测患者血浆中紫杉醇的浓度,并观察其疗效和不良反应与血药浓度的关系,并希望能提供一个合理的针对紫杉醇治疗卵巢癌的血药浓度范围。
1 资料与方法 1.1 资料选取2015年4—9月湖北省肿瘤医院妇瘤科卵巢癌患者75例,女性,年龄范围45~68岁,平均年龄58.4岁。均经病理确诊为上皮性卵巢癌。所有患者采用铂类/紫杉醇的化疗方案,其中紫杉醇在根据体表面积数值后计算所得出的治疗剂量均为175 mg/m2,连续3 h静脉输注给药。用药后观察白细胞(中性粒细胞为主)减少、末梢神经炎、脱发等指标,根据WHO化疗药物不良反应分级标准,将毒性分1~4度[5-6]。所有待检测患者均签署了知情同意书。
1.2 试剂与仪器采用上海复兴长征生物制品公司的美可安-紫杉醇(MyCare-PTX)测定试剂盒,贝克曼公司奥林巴斯全自动生化分析仪AU5400及贝克曼原装谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、总胆红素(TBIL)、直接胆红素(DBIL)生化试剂,SYSMEX五分类血细胞分析仪及原装试剂。
1.3 治疗方法75例患者中,40例接受紫杉醇/卡铂方案,35例接受紫杉醇/顺铂方案一线化疗。卡铂(齐鲁制药公司)按AUC=5 mg/ml.min的浓度输注,每个周期使用。
1.4 样本采集经前期选择其中10例患者,分别在输注紫杉醇后0.5、1.5、3、3.5、4、5、7、11、15、19、24、30 h外周静脉采血于K2EDTA抗凝管中,通过测得的血药浓度-时间数据获得药物浓度的动态曲线,确定紫杉醇的血药浓度检测时间为滴注后(24±6)h。其余65例患者于紫杉醇滴注开始后(24±6)h之间采集二次血样,通过外周静脉穿刺采集2~3 ml血液于K2EDTA抗凝采血管中。待血液自然凝固后,2300 g离心10 min,小心从上层移出血浆至样品管中,一定要避免转移任何细胞层到样品管中。
1.5 样本检测分离血浆在抽血1 h内完成,记录分离时间,立即送至实验室在贝克曼奥林巴斯全自动生化分析仪AU5400上使用MyCare-PTX试剂盒检测血浆药物浓度,取两次采血浓度的平均值作为最终血药浓度。采用原装美可安校准品及质控品,其余肝功能检测及血常规检测采用伯乐BIORAD质控品,所有检测项目的室内质控、室间质评均合格。
1.6 疗效评价标准按WHO标准:完全缓解(CR):病灶完全消失,持续4周以上无新病灶出现;部分缓解(PR):病灶缩小到治疗前的50%,多灶性病变时无一病灶增大;稳定(SD):病灶无变化;进展(PD):病灶扩大25%或出现新病灶,CR+PR为有效[5-6]。不良反应按WHO标准分为0~Ⅳ级。
1.7 随访患者每周查血常规1~2次,每周期治疗前查肝、肾功能,CA125,盆腔B型超声,疗程结束后作全面检查。
1.8 统计学方法应用SPSS17.0软件进行统计分析。计数资料采用χ2检验。计量资料采用(x±s)表示,不良反应程度、血药浓度和缓解率等的组间比较采用方差分析,检验水准α=0.05。
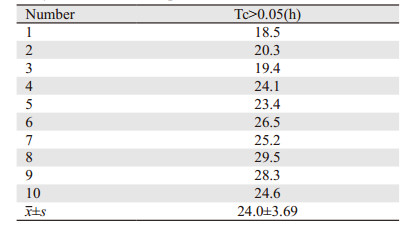
2 结果 2.1 预实验结果经前期选择其中10例患者,分别在输注紫杉醇后0.5、1.5、3、3.5、4、5、7、11、15、19、24、30 h外周静脉采血于K2EDTA抗凝管中,检测其不同时间点紫杉醇的血药浓度,见表 1。计算临界血药浓度(0.05 μmol/L)以上暴露时间(time point of blood concentration above 0.05 μmol/L, Tc > 0.05),结果如下表 2所示。根据预实验结果,确定紫杉醇的血药浓度检测时间为滴注后(18~30)h,即最短血药浓度(0.05 μmol/L)以上暴露时间[The minimum duration of blood concentration above 0.05 μmol/L, Tc > 0.05(min)]至最长血药浓度(0.05 μmol/L)以上暴露时间[The maximum duration of blood concentration above 0.05μmol/L, Tc > 0.05(max)][Tc > 0.05(min)~Tc > 0.05 (max)]。PTX血药浓度-时间曲线,见图 1。
|

|
| 图 1 PTX血药浓度-时间曲线 Figure 1 The plasma concentrations-time curve of PTX |
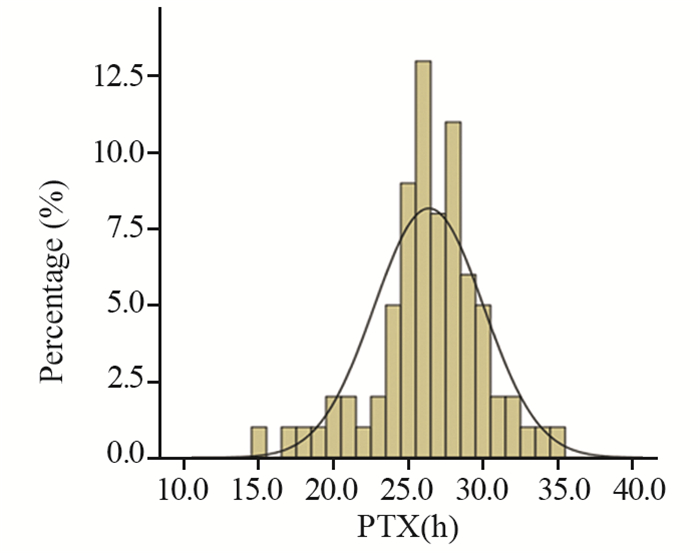
使用175 mg/m2紫杉醇剂量化疗的不同卵巢癌患者个体差异性,见图 2。不同的患者依据体表面积计算出用药剂量,但基于BSA给药的PTX血药浓度Tc > 0.05差异超过1倍 > 10.3%。
|
| 图 2 基于BSA给药的不同患者PTX血药浓度(Tc > 0.05)的分布 Figure 2 The distribution of PTX blood concentration (Tc > 0.05) in different patients based on BSA administration |
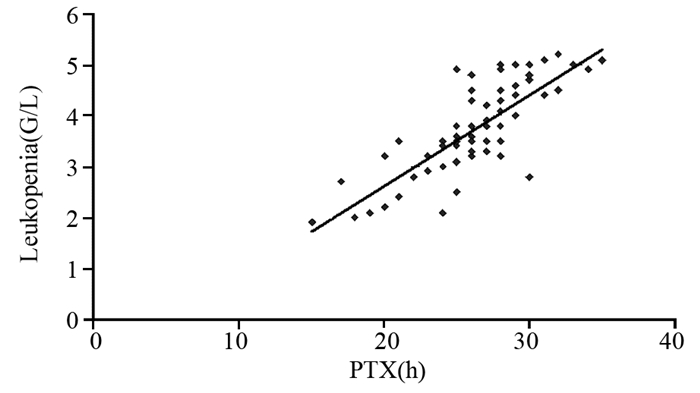
75例卵巢癌患者使用紫杉醇化疗后,PTX血药浓度Tc > 0.05与白细胞减少的相关性,见图 3,相关系数为0.828,方程y=0.1785x-0.9544,R2=0.765。
|
| 图 3 基于BSA给药的卵巢癌患者PTX浓度与白细胞减少的相关性 Figure 3 The correlation between PTX concentration and leukopenia in ovarian cancer patients based on BSA administration |
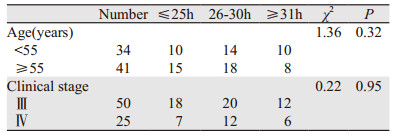
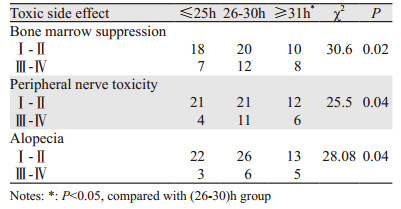
根据PTX血药浓度的分布图,按照三个周期血药浓度的平均值将75例卵巢癌患者分为3组:(1)≤25 h组:25例,年龄45~68岁,中位年龄58.6岁。(2)26~30 h组:32例,年龄48~65岁,中位年龄55.8岁。(3)≥31 h组:18例,年龄47~60岁,中位年龄52.3岁。三组患者的临床特征差异无统计学意义,见表 3。紫杉醇化疗的其他不良反应如脱发、某稍神经炎与血药浓度Tc > 0.05的相关性,见表 4。
|
|
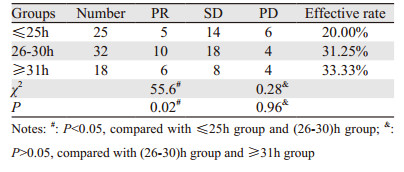
使用紫杉醇化疗后,PTX血药浓度≤25 h组、26~30 h组、≥31 h组与患者疗效的比较分析,见表 5。
|
紫杉醇被广泛应用于卵巢癌、乳腺癌、非小细胞肺癌、消化系统癌症等的治疗中[6-7]。在临床治疗中,紫杉醇的使用剂量是依据患者体表面积而计算的[6]。然而,基于体表面积的给药方式患者个体间的药理差异可高达10倍,现有很多临床结果表明患者药理学上个体间的巨大差异是引起PTX毒性过高和治疗失败的主要原因[6]。因此,有必要监测紫杉醇的血药浓度,并根据每个患者的药理表现进行剂量调节,实现“剂量个体化”,从而控制化疗药物毒性,改善化疗效果。
很多研究显示临界血药浓度(0.05 μmol/L)以上暴露时间(Tc > 0.05)可以用来最有效地预测药物相关的嗜中性白细胞减少症程度[2-4]。有多个针对西方患者进行的关于PTX药代动力学和药代-药效学的研究证明药代学参数中,PTX血药浓度在0.05 μmol/L以上的时间(Tc > 0.05)和血液毒性、神经毒性以及临床疗效差异具有统计学意义。然而对于亚洲,尤其是中国人群,相关的数据还比较缺乏。
本研究通过观察PTX药理参数与毒性以及疗效相关性,证实了PTX的血药浓度与白细胞减少的程度呈正相关,血药浓度越高,骨髓抑制越严重,其他的不良反应越明显,但疗效评估是在一定浓度范围内,疗效呈现出较稳定的趋势。证实紫杉醇在治疗中国卵巢癌患者人群中也存在理想治疗窗,根据PTX血药浓度来调整PTX用药剂量,有可能达到进一步提高疗效并减少不良反应的目的。本研究提示PTX血药浓度 > 25 h即能取得较好的疗效,而血药浓度≥31 h组的患者骨髓抑制、胃肠道反应和脱发的发生率均会增高,认定26~30 h组可作为紫杉醇卵巢癌化疗患者治疗窗的浓度范围。
CYP3A4同工酶的活性与PTX的血浆清除率及不良反应发生率相关[8-10]。因此,建议在进行PTX药代动力学分析时,应预测CYP3A4同工酶活性,主要是相关基因CYP1B1和MDR1两项基因表型[8-10]。结合PTX血药浓度监测能更好的评估疗效和预测不良反应。
综上,化疗后紫杉醇PTX血药浓度在26~30 h时,可能获得较好的疗效并控制相应的不良反应。若能筛选CYP3A4同工酶的活性,若活性不佳或无者,应检测CYP1B1和MDR1两项基因表型,实现更好的PTX个体化治疗。本研究因数据有限且病患较集中,不能以偏概全,提出适合中国人群卵巢癌化疗的治疗窗,但仍能起一定的指导价值,希望进一步扩大样本量和覆盖地区,以获得合理的中国人群的紫杉醇对卵巢癌的治疗窗。
| [1] | 刘晋雯. 紫杉醇联合顺铂、卡铂周疗治疗卵巢癌疗效及安全评价[J]. 中国保健营养 (中旬刊), 2012, 6(6): 326. [ Liu JW. The curative effect and safety evaluation of Paclitaxel combined Cisplatin or Carboplatin in weekly chemotherapy on ovarian cancer[J]. Zhongguo Bao Jian Yin Yang (Zhong Xun Kan), 2012, 6(6): 326. ] |
| [2] | Hendrikx JJ, Hillebrand MJ, Thijssen B, et al. A sensitive combined assay for the quantification of paclitaxel, docetaxel and ritonavir in human plasma using liquid chromatography coupled with tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879(28): 2984–90. DOI:10.1016/j.jchromb.2011.08.034 |
| [3] | 董滨华, 孙蓬明, 宋一一, 等.高效液相色谱法测定卵巢癌患者血浆中紫杉醇浓度的研究[J].国际妇产科学杂志, 2013, 40(4): 372-4, 385. [ Dong BH, Sun PM, Song YY, et al. Determination of Paclitaxel in Ovarian Neoplasm Patients' Plasma by HPLC[J]. Guo Ji Fu Chan Ke Xue Za Zhi, 2013, 40(4): 372-4, 385. ] |
| [4] | 叶怀庄, 方维佳, 徐农. 高效液相色谱法在肿瘤化疗患者紫杉醇血药浓度检测中的应用[J]. 中华检验医学杂志, 2009, 32(2): 198–200. [ Ye HZ, Fang WJ, Xu N. Determination of chemotherapy drug in cancer patients' plasma by High performance liquid chromatography (HPLC)[J]. Zhonghua Jian Yan Yi Xue Za Zhi, 2009, 32(2): 198–200. ] |
| [5] | 蔡讯, 薛鹏, 宋卫峰, 等. 氟尿嘧啶血药浓度监测在进一步提高晚期结直肠癌以氟尿嘧啶为基础的化疗疗效中的作用[J]. 中华肿瘤杂志, 2012, 34(1): 39–43. [ Cai X, Xue P, Song WF, et al. Role of pharmacokinetic monitoring of serum fluorouracil concentration in patients with local advanced and metastatic colorectal cancer and further improving efficacy of fluorouracil-based chemotherapy[J]. Zhonghua Zhong Liu Za Zhi, 2012, 34(1): 39–43. ] |
| [6] | Wang N, He T, Shen Y, et al. Paclitaxel and Tacrolimus Coencapsulated Polymeric Micelles That Enhance the Therapeutic Effect of Drug-Resistant Ovarian Cancer[J]. ACS Appl Mater Interfaces, 2016, 8(7): 4368–77. DOI:10.1021/acsami.5b09340 |
| [7] | 邹厚文, 罗会俊, 余瑛, 等. 紫杉醇联合顺铂的两种给药方法治疗晚期卵巢癌疗效的比较[J]. 江西医药, 2014, 49(3): 232–4. [ Zou HW, Luo HJ, Yu Y, et al. The curative effect comparison of Paclitaxel combined Cisplatin in two administration modes on advanced ovarian cancer[J]. Jiangxi Yi Yao, 2014, 49(3): 232–4. ] |
| [8] | Wang B, Li S, Meng X, et al. Inhibition of mdr1 by G-quadruplex oligonucleotides and reversal of paclitaxel resistance in human ovarian cancer cells[J]. Tumor Biol, 2015, 36(8): 6433–43. DOI:10.1007/s13277-015-3333-2 |
| [9] | 杨建伟, 苏颖, 陈增, 等. CYP3A4基因多态性与晚期胃癌患者接受紫杉醇/奥沙利铂多线化疗、化疗周期数及不良反应的相关性[J]. 国际病理科学与临床杂志, 2014, 34(1): 22–8. [ Yang JW, Su Y, Chen Z, et al. Correlation between gene polymorphisms of CYP3A4 and multi-line chemotherapy, cycles of chemotherapy or adverse reactions in gastric cancer patients received therapy of paclitaxel and/or oxaliplatin combination regimens[J]. Guo Ji Bing Li Ke Xue Yu Lin Chuang Za Zhi, 2014, 34(1): 22–8. ] |
| [10] | 杨建伟, 陈增, 苏颖, 等. 胃癌细胞色素氧化酶CYP3A4基因多态性与含紫杉醇方案化疗敏感性的研究[J]. 临床肿瘤学杂志, 2014, 19(1): 23–8. [ Yang JW, Chen Z, Su Y, et al. Trial of the correlation between cytochrome oxidase CYP3A4 with the susceptibility of paclitaxel-based regimen for advanced gastric cancer[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2014, 19(1): 23–8. ] |
 2017, Vol. 44
2017, Vol. 44



