文章信息
- 足细胞标记蛋白在乳腺癌组织中的表达
- Expression of Podocalyxin in Breast Cancer Tissues
- 肿瘤防治研究, 2017, 44(4): 248-252
- Cancer Research on Prevention and Treatment, 2017, 44(4): 248-252
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.04.002
- 收稿日期: 2016-07-21
- 修回日期: 2016-11-17
2. 300140 天津,天津医科大学第四中心临床学院病理科
2. Department of Pathology, The 4th Center Clinical College of Tianjin Medical University, Tianjin 300140, China
足细胞标记蛋白(Podocalyxin)最初发现是肾脏足细胞表达的一种带有大量负电荷的CD34相关性唾液酸黏蛋白,是足细胞顶端表面的主要组成成分,正常表达于肾脏足细胞、造血干细胞、血管内皮细胞、间皮细胞、神经元、骨髓间充质干细胞和血小板[1]。近年来学者们发现Podocalyxin的表达与肿瘤的发生发展密切相关[1]。乳腺癌是一组异质性很强的疾病,日益成为严重危害女性健康的疾病之一,并且乳腺浸润性导管癌(invasive ductal carcinoma, IDC)与导管内癌(ductal carcinoma in situ, DCIS)分级对临床预后的指导意义十分重要[2]。本研究采用免疫组织化学方法检测Podocalyxin在IDC及DCIS中的表达情况,并分析Podocalyxin在IDC中的表达与临床病理特征和预后的关系,以期为乳腺癌的诊断、预后及靶向治疗提供依据。
1 资料与方法 1.1 一般资料随机抽取天津医科大学肿瘤医院2004年1月至2006年12月经病理诊断为IDC的病例129例及同时期收治的诊断为DCIS的病例62例,由两位副高级以上病理医师参照2012年乳腺肿瘤WHO分类[3]证实病理诊断。所有病例均为女性,年龄26~83岁(中位年龄57岁),其余资料见表 1。所有患者术前均未接受放化疗。62例DCIS中,低/中级别有33例,高级别有29例。收集上述病例的石蜡包埋组织作为实验研究样本。所有的病例均有随访资料。
鼠抗人Podocalyxin单克隆抗体购自美国Santa Cruz Biotechnology公司。实验步骤:按照免疫组织化学SP法进行,石蜡切片常规脱蜡、水化,用3%H2O2室温孵育10 min,高温高压抗原热修复,封闭后滴加稀释度为1:50的一抗,4℃冰箱过夜。滴加二抗,37℃保温箱孵育1 h。DAB显色,苏木精对比染色、脱水、封片,光学显微镜下观察,用预实验时显示阳性的样本切片作阳性对照,用PBS替代一抗作阴性对照。
1.3 免疫组织化学结果判定Podocalyxin的阳性着色部位为肿瘤细胞的细胞质,呈棕黄色,可以有轻微胞膜着色。染色结果评分标准参照文献[4]:0分:无阳性细胞着色;1分:阳性细胞数≤10%;2分:弥漫着色的阳性细胞数 < 50%或强着色的阳性细胞数 > 10%;3分:强着色的阳性细胞数≥50%。如有间质组织和正常组织着色区域不计入阳性细胞百分数。评分2分和3分的病例被认为是Podocalyxin表达阳性的病例。
ER和PR以癌细胞核阳性细胞 > 1%为阳性;人表皮生长因子2(human epidermal growth factor receptor 2, HER2)以浸润性癌细胞膜强阳性细胞 > 30%为标准,Ki67以癌细胞核着色阳性细胞≥20%为阳性。
1.4 随访随访时间自手术日起,截至2012年12月,中位随访时间为87.2月。129例IDC患者均从手术当日开始计算生存时间,无瘤生存期限定为从手术日到第一次发生局部复发或远处转移的时间。
1.5 统计学方法应用SPSS19.0统计软件进行数据分析,定性资料间的比较采用χ2检验,单因素生存分析采用Kaplan-Meier生存曲线,多因素分析采用Cox多因素分析模型。以P < 0.05为差异有统计学意义。
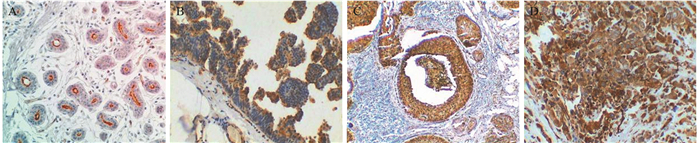
2 结果 2.1 Podocalyxin在IDC与DCIS中的表达Podocalyxin仅在正常乳腺组织导管上皮细胞腔面顶部出现阳性表达[4],见图 1A,在DCIS和IDC中细胞质着色,见图 1B~1D。DCIS中Podocalyxin的阳性率为35.48%(22/62),IDC中阳性率为51.94%(67/129),两者差异有统计学意义(χ2=4.556, P=0.032)。
|
| 图 1 Podocalyxin在正常乳腺组织、DCIS和IDC中的表达 (IHC) Figure 1 Podocalyxin expression in normal breast tissues, DCIS and IDC tissues (IHC) |
62例DCIS样本中,22例(35.48%)Podocalyxin阳性表达,其中低/中级别者8例(24.24%, 8/33),高级别者14例(48.28%, 14/29),两者比较差异有统计学意义(χ2=3.895, P=0.048)。
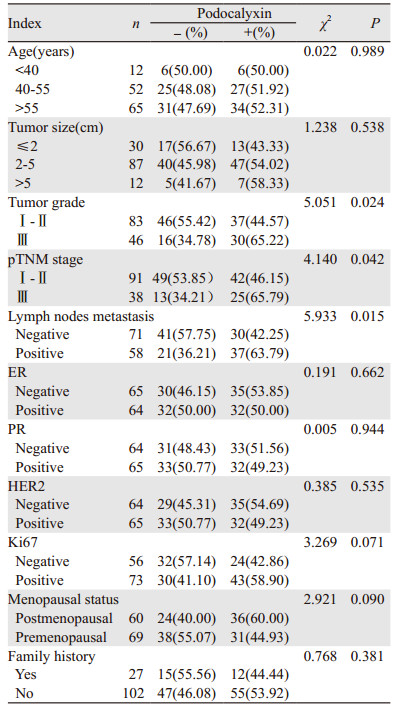
2.3 Podocalyxin在乳腺IDC中的表达及与临床病理参数间的关系Podocalyxin阳性率表达在高级别IDC中比例明显高于低级别IDC(65.22% vs. 44.57%, P=0.024);pTNM分期,91例Ⅰ~Ⅱ期样本中,46.15%(42/91)表达Podocalyxin,38例Ⅲ期样本中65.79%(25/38)高表达Podocalyxin,两者比较差异有统计学意义(χ2=4.140, P=0.042);出现淋巴结转移患者中Podocalyxin阳性率和未出现淋巴结转移患者阳性率比较差异有统计学意义(63.79% vs. 42.25%, P=0.015)。在肿瘤大小、ER、PR、HER2、Ki67表达、年龄、绝经状态、家族史等分组间比较,差异无统计学意义,见表 2。
|
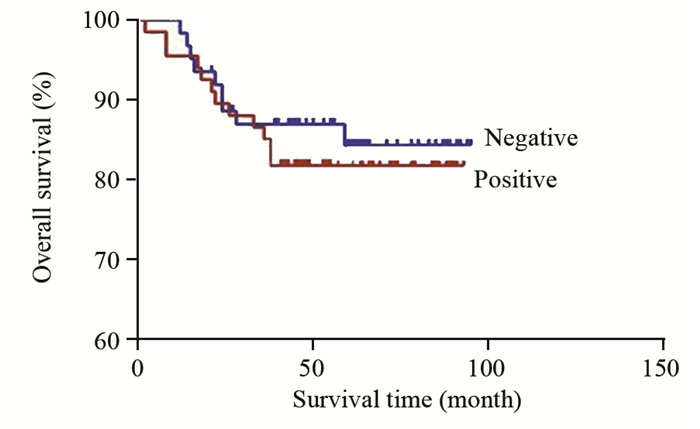
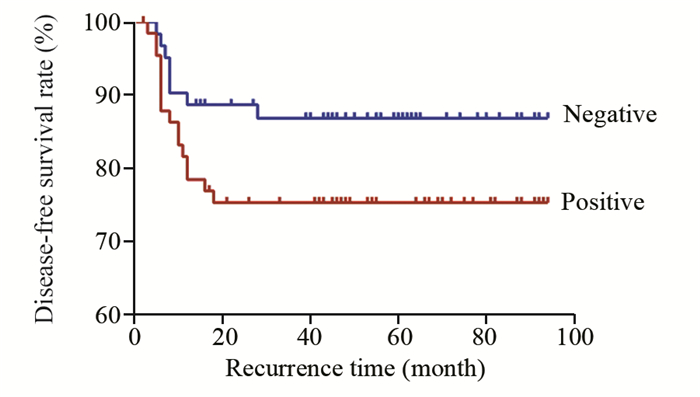
129例IDC病例总生存率为84.50%(109/129);IDC中Podocalyxin阳性患者在随访期内生存率明显低于阴性患者(77.61% vs. 91.93%, P=0.025),见图 2。Podocalyxin阳性表达患者在随访期内无瘤生存率为71.64%(55/67),明显低于阴性表达组患者的90.32%(54/62),差异有统计学意义(P=0.029),见图 3。随访结果显示,IDC中Podocalyxin阳性表达病例复发率为28.36%(19/67),Podocalyxin阴性病例的复发率为9.68%(6/62)(P=0.032)。
|
| 图 2 129例IDC中Podocalyxin表达的总生存曲线 Figure 2 Overall survival curves of podocalyxin expression in 129 IDC patients |
|
| 图 3 129例IDC中podocalyxin阳性与阴性表达的无瘤生存曲线 Figure 3 Disease-free survival curves of 129 IDC patients with positive and negative podocalyxin expression |
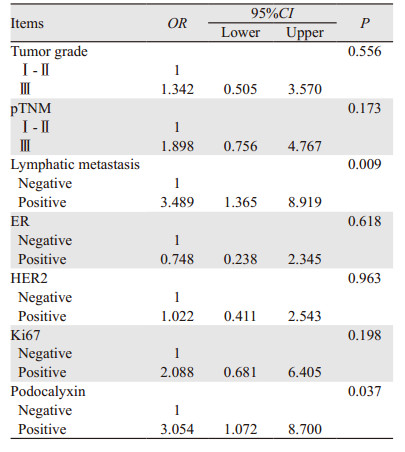
Kaplan-Meier分析中,pTNM分期、淋巴结转移、ER和Podocalyxin的表达等因素对IDC患者无瘤生存期有影响,单变量分析有意义的预后因子纳入多变量回归模型分析结果,仅显示Podocalyxin表达状态和淋巴结转移是乳腺IDC无瘤生存期的独立影响因素(P < 0.05),见表 3。
|
乳腺癌是最常见的侵袭性恶性肿瘤之一,占女性所有癌症的22.8%,每年确诊的新发病例约有138万[5]。目前,乳腺癌的发病率逐年增加,并且在所有恶性肿瘤中跃居第二位[6]。因此对乳腺癌浸润机制的研究十分必要。
Podocalyxin是足细胞顶端表面的主要组成成分[1],通过抗黏附作用产生的高净负电荷维持肾小球足突间裂孔滤过膜的完整性,防止带负电荷的蛋白分子漏入原尿中;维持相邻足细胞的分离;防止壁层上皮细胞与毛细血管袢的黏附作用;减少细胞外基质的聚集。通过podocalyxin/Na/K交换调控因子(NHERF2)/ezrin复合体对足细胞骨架形成和维持起重要作用[7-8]。
Podocalyxin正常表达于包括乳腺导管和小叶的管腔细胞在内的各种上皮顶端表面[4]。同时,Podocalyxin在管腔形成过程中,通过促进形成抗黏附顶膜结构域的功能,直接在管腔和腺上皮生发过程中起到广泛的作用[9]。
在乳腺、泌尿生殖系统、消化系统及呼吸系统等多种上皮来源的肿瘤中,Podocalyxin出现高表达并且与不同的预后指标密切相关[4, 10-15]。一些研究初步探讨了Podocalyxin与乳腺癌侵袭与转移的关系。Somasiri等[4]对272例浸润性乳腺癌的组织芯片进行免疫组织化学检测发现Podocalyxin高表达与预后不良的关系密切。另有基础实验研究发现[11],Podocalyxin与ezrin构成复合物。增强MAPK及PI3K通路的活性,诱导基质金属蛋白酶MMP,最终导致更具有侵袭性的表型。并且乳腺癌细胞中Podocalyxin通过激活Rac1/Cdc42/cortactin信号通路促进侵入性伪足(invadopodia)的形成和癌细胞的转移[16]。Snyder等[10]对乳腺肿瘤生长和转移的体外模型(MDA-MB-231细胞株)的研究表明,Podocalyxin的过表达具有促进肿瘤增长和播散的作用。由此看来,在体内和人类乳腺肿瘤细胞中,Podocalyxin在肿瘤的进展中发挥重要的作用。此外,Podocalyxin在人转化生长因子-β(TGF-β)诱导的上皮间质转化(epithelial mesenchymal transition, EMT)过程中表达上调。同时,在EMT过程中Podocalyxin与胶原蛋白相互作用,与上皮细胞间黏附和与细胞骨架结构的改变密切相关,从而使肿瘤细胞具有更强侵袭性的表型[17]。在细胞水平的研究中发现,Podocalyxin过表达从乳腺癌上皮细胞游离面顶膜结构域出现了扩展,它改变了NHERF-1和ezrin这两个相关的肌动蛋白结合支架蛋白的亚细胞定位[18],这两种蛋白的错误定位与乳腺癌肿瘤细胞的发展密切相关。随后,Graves等[19]对乳腺癌细胞株MCF-7的研究表明,Podocalyxin是乳腺癌“瘤芽”的生发过程中的内在调节基因,其高表达促进了乳腺肿瘤细胞株MCF-7形成结合集团(cohesive clusters),从原发肿瘤出芽并侵入小鼠体内的乳腺基质。
研究结果显示:高级别DCIS阳性率明显高于低/中级别DCIS。提示分化差的肿瘤细胞Podocalyxin的表达增强。由于高核分级DCIS细胞异型明显且多伴有粉刺型亚型,侵袭能力强,容易发生间质浸润,在相对较短的时间内即可出现局部复发,进展为浸润性癌的风险明显提高[20-21]。
Podocalyxin在DCIS中的阳性率明显低于IDC的阳性率,提示Podocalyxin在乳腺癌进展中可能具有重要意义。在IDC中Podocalyxin表达与肿瘤大小与肿瘤分级呈正相关。本研究中,Podocalyxin的表达与淋巴结转移关系密切。Podocalyxin阴性患者的无病生存率明显高于阳性患者,Podocalyxin阳性患者的复发率高于阴性表达患者。因此,在乳腺IDC患者中出现Podocalyxin阳性表达提示预后不良。Cox多因素分析表明,Podocalyxin的表达与淋巴结转移是影响术后无瘤生存期的危险因素。在IDC中,Podocalyxin的表达是增加死亡风险的因素,提示Podocalyxin是估测IDC预后的有效指标。
综上所述,检测Podocalyxin的表达,可助于判断乳腺癌的恶性程度、估测乳腺癌预后,也可能解释DCIS发生浸润的机制。此外,已有针对乳腺肿瘤细胞的临床前研究,评估抗Podocalyxin治疗性抗体(PODOC1)的功效,开发以Podocalyxin为靶标的单克隆抗体,用以抑制肿瘤细胞生长和转移。深入了解Podocalyxin在肿瘤细胞发生、发展中的作用,有助于进一步了解乳腺癌的侵袭机制,为临床治疗及预测预后提供新的思路。
| [1] | Nielsen JS, McNagny KM. The role of podocalyxin in health and disease[J]. J AM Soc Nephrol, 2009, 20(8): 1669–76. DOI:10.1681/ASN.2008070782 |
| [2] | 唐平, 魏兵, 杨雯娟, 等. 乳腺癌预后/预测因子[J]. 中华病理学杂志, 2011, 40(2): 73–6. [ Tang P, Wei B, Yang WJ, et al. Prognostic factors of breast cancer[J]. Zhonghua Bing Li Xue Za Zhi, 2011, 40(2): 73–6. ] |
| [3] | Ellis IO, Collins L, Ichihara S, et al. Invasive carcinoma of no special type[M]//Lakhani SR, Ellis IO, Schnitt SJ, et al. WHO classification of tumours of the breast. Lyon: IARC Press, 2012: 33-8. |
| [4] | Somasiri A, Nielsen JS, Makretsov N, et al. Overexpression of the anti-adhesin podocalyxin is an independent predictor of breast cancer progression[J]. Cancer Res, 2004, 64(15): 5068–73. DOI:10.1158/0008-5472.CAN-04-0240 |
| [5] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893–917. DOI:10.1002/ijc.v127:12 |
| [6] | 张敏璐, 黄哲宙, 郑莹. 中国2008年女性乳腺癌发病、死亡和患病情况的估计及预测[J]. 中华流行病学杂志, 2012, 33(10): 1049–51. [ Zhang ML, Huang ZZ, Zheng Y. Estimates and prediction on incidence, mortality and prevalence of breast cancer in China, 2008[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2012, 33(10): 1049–51. DOI:10.3760/cma.j.issn.0254-6450.2012.10.012 ] |
| [7] | Orlando RA, Takeda T, Zak B, et al. The glomerular epithelial cell anti-adhesin podocalyxin associates with the actin cytoskeleton through interactions with ezrin[J]. Am J Soc Nephrol, 2001, 12(8): 1589–98. |
| [8] | Li Y, Li J, Straight SW, et al. PDZ domain-mediated interaction of rabbit podocalyxin and Na (+)/H (+) exchange regulatory factor-2[J]. Am J Physiol Renal Physiol, 2002, 282(6): 1129–39. DOI:10.1152/ajprenal.00131.2001 |
| [9] | Strilić B, Kucera T, Eglinger J, et al. The molecular basis of vascular lumen formation in the developing mouse aorta[J]. Dev Cell, 2009, 17(4): 505–15. DOI:10.1016/j.devcel.2009.08.011 |
| [10] | Snyder KA, Hughes MR, Hedberg B, et al. Podocalyxin enhance breast tumor growth and metastasis and is a target for monoclonal antibody therapy[J]. Breast Cancer Res, 2015, 17: 46. DOI:10.1186/s13058-015-0562-7 |
| [11] | Sizemore S, Cicek M, Sizemore N, et al. Podocalyxin increases the aggressive phenotype of breast and prostate cancer cells in vitro through its interaction with ezrin[J]. Cancer Res, 2007, 67(13): 6183–91. DOI:10.1158/0008-5472.CAN-06-3575 |
| [12] | Boman K, Larsson AH, Segersten U, et al. Membranous expression of podocalyxin-like protein is an independent factor of poor prognosis in urothelial bladder cancer[J]. Br J Cancer, 2013, 108(11): 2321–8. DOI:10.1038/bjc.2013.215 |
| [13] | Laitinen A, Böckelman C, Hagström J, et al. Podocalyxin as a prognostic marker in gastric cancer[J]. PloS One, 2015, 10(12): e0145079. DOI:10.1371/journal.pone.0145079 |
| [14] | Larsson A, Johansson ME, Wangefjord S, et al. Overexpression of podocalyxin-like protein is an independent factor of poor prognosis in colorectal cancer[J]. Br J Cancer, 2011, 105(5): 666–72. DOI:10.1038/bjc.2011.295 |
| [15] | Koch LK, Zhou H, Ellinger J, et al. Stem cell marker expression in small cell lung carcinoma and developing lung tissue[J]. Hum Pathol, 2008, 39(11): 1597–605. DOI:10.1016/j.humpath.2008.03.008 |
| [16] | Lin CW, Sun MS, Liao MY, et al. Podocalyxin-like 1 promotes invadopodia formation and metastasis through activation of Rac1/Cdc42/cortactin signaling in breast cancer cells[J]. Carcinoqenesis, 2014, 35(11): 2425–35. DOI:10.1093/carcin/bgu139 |
| [17] | Meng X, Ezzati P, Wilkins JA. Requirement of podocalyxin in TGF-Beta induced epithelial mesenchymal transition[J]. PLoS One, 2011, 6(4): e18715. DOI:10.1371/journal.pone.0018715 |
| [18] | Nielsen JS, Graves ML, Chelliah S, et al. The CD34-related molecule podocalyxin is a potent inducer of microvillus formation[J]. PLoS One, 2007, 2(2): e237. DOI:10.1371/journal.pone.0000237 |
| [19] | Graves ML, Cipollone JA, Austin P, et al. The cell surface mucin podocalyxin regulates collective breast tumor budding[J]. Breast Cancer Res, 2016, 18(1): 11. DOI:10.1186/s13058-015-0670-4 |
| [20] | 张荣菊, 牛昀, 高玉霞. 乳腺导管原位癌浸润机制的研究进展[J]. 中华病理学杂志, 2009, 38(1): 63–5. [ Zhang RJ, Niu Y, Gao YX. Recent advances in studies on in-situ and invasive ductal carcinoma[J]. Zhonghua Bing Li Xue Za Zhi, 2009, 38(1): 63–5. ] |
| [21] | 王舒, 倪青. 钼靶、彩超及磁共振在乳腺导管原位癌中的诊断价值[J]. 肿瘤防治研究, 2015, 42(6): 597–600. [ Wang S, Ni Q. Accuracy of mammography, color doppler ultrasonography and magnetic resonance imaging in predicting puctal carcinoma in situ[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(6): 597–600. ] |
 2017, Vol. 44
2017, Vol. 44