文章信息
- 二甲双胍对胰腺癌和胰腺癌干细胞中ALDH1表达的作用
- Effects of Metformin on ALDH1 Expression in Pancreatic Cancer and Pancreatic Cancer Stem Cells
- 肿瘤防治研究, 2017, 44(3): 177-183
- Cancer Research on Prevention and Treatment, 2017, 44(3): 177-183
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.03.005
- 收稿日期: 2016-07-11
- 修回日期: 2016-09-30
据统计,全世界每年胰腺癌的新发病例约277 000人[1],胰腺癌死亡率在美国肿瘤死亡率中位居第四位(每年约4万人死亡),在未来的十年里可能成为第二大肿瘤相关的死亡原因[2]。研究发现肿瘤干细胞(cancer stem cells, CSCs)在胰腺癌的转移,化疗抵抗和疾病复发中具有重要的作用[3-4]。ALDHs(aldehyde dehydrogenase)作为干细胞标志物被用来鉴定和分离正常干细胞和CSCs[5],并参与胰腺癌的多个信号通路,与胰腺癌的治疗耐药、复发、预后等方面相关。2005年Evans等[6]首次发现二甲双胍能够降低2型糖尿病患者的肿瘤发病率,如结肠癌、肺癌、胰腺癌、乳腺癌、肝癌、子宫内膜癌等[7]。另外,有研究报道二甲双胍不仅可以通过mTOR通路抑制胰腺癌细胞的增殖[8],还能够抑制胰腺癌动物模型中ALDH1的表达[9],但其作用机制尚不清楚。在本实验中,通过mTOR的抑制剂雷帕霉素阻断mTOR信号的激活进行体外实验,观察二甲双胍以及雷帕霉素对胰腺癌PANC-1细胞株和胰腺癌干细胞中ALDH1表达水平的影响,并初步探究胰腺癌细胞中ALDH1的表达与mTOR的关系。
1 材料与方法 1.1 材料胰腺癌PANC-1细胞购自上海细胞库。盐酸二甲双胍为上海Aladdin公司产品,雷帕霉素购自美国Selleck Chemicals公司;DMEM培养液购自美国Gibco公司,胎牛血清购自美国GEMINI公司;CCK-8试剂盒购自日本同仁公司;蛋白裂解液购自中国碧云天有限公司,一抗有ALDH1和4EBP1购于英国Abcam公司,p-mTOR购自美国CST公司,ECL发光液购自美国Santa Cruz公司;TRIzol试剂购自美国Invitrogen公司,RT-PCR试剂盒购自日本TAKARA公司;DMEM/F12购于美国HyClone公司;EGF、bFGF、B27生长因子均购自美国Gibco公司。
1.2 方法 1.2.1 细胞培养人胰腺癌PANC-1细胞培养于含有10%胎牛血清、青霉素100 u/ml和链霉素100 μg/ml的DMEM培养液中,置于37℃、5%CO2饱和湿度培养箱培养。3~5天传代1次,消化,收集对数生长期细胞备用。
1.2.2 CCK-8法检测细胞增殖抑制率取对数生长期的PANC-1细胞,0.25%胰酶消化制成单细胞悬液,按(2~5)×103个/孔接种于96孔板中,加入培养液100 μl。随机分为7组并加入二甲双胍,使其终质量浓度为0、1、2、5、10、15、20 mmol/L,对照组加入等体积的培养液,每组4个复孔,同时设调零孔,置于37℃、5%CO2饱和湿度培养箱中培养。待药物分别作用24、48、72 h后加入CCK-8试剂(每100 μl培养液中含有10 μl CCK-8试剂),于培养箱中孵育2 h,在450 nm波长下检测OD值。细胞增殖抑制率(%)=[(实验孔OD450-空白孔OD450)/(对照孔OD450-空白孔OD450)]×100%(实验孔:含有细胞的培养液、CCK-8、二甲双胍,对照孔:含有细胞的培养液、CCK-8、不含二甲双胍,空白孔:不含有细胞和二甲双胍的培养液、CCK-8)。
1.2.3 Western blot检测ALDH1,p-mTOR蛋白的表达取对数生长期PANC-1细胞,0.25%胰酶消化制成单细胞悬液,按(3~5)×105个/孔接种于6孔板中,加入培养液2 ml。分组同1.2.2随机分为6组并加入二甲双胍,使其终质量浓度为0、2、5、10、15、20 mmol/L。待药物干预48 h后,弃去培养液,冷PBS洗细胞3次,加蛋白裂解液(含有蛋白酶抑制剂和磷酸酶抑制剂)制备总蛋白,4℃,12 000 r/min离心15 min,取上清液,采用BCA法检测蛋白浓度。取30~50 μg的蛋白样品,经SDS-PAGE电泳分离后,电转移到PVDF膜上,用含有5%脱脂奶粉的TBST溶液室温摇床上封闭1 h;加入一抗anti-ALDH1A1(1:1 000),anti-p-mTOR(1:1 000), anti-GADPH(1:1 000),4℃过夜;TBST洗涤3次,每次10min,加入HRP标记的山羊抗兔IgG(1:10000),室温孵育1~2 h,TBST洗涤3次,每次10 min。ECL底物化学发光显色后曝光显影,通过Bio-rad化学发光成像系统进行曝光分析,目的蛋白相对表达量=目的条带灰度值/GAPDH条带灰度值。实验均重复3次。
1.2.4 Western blot和qRT-PCR检测p-mTOR、4EBP1、ALDH1蛋白以及mRNA的表达取对数生长期PANC-1细胞,0.25%胰酶消化制成单细胞悬液,按(3~5)×105个/孔接种于6孔板中,加入培养液2 ml。随机分为四组:对照组,二甲双胍组(20 mmol/L),雷帕霉素组(100 nmol/L)以及联合用药组二甲双胍(20 mmol/L)+雷帕霉素组(100 nmol/L)进行干预。置于37℃、5%CO2饱和湿度培养箱中培养48 h。按照方法1.2.3检测不同干预组中p-mTOR、4EBP1、ALDH1蛋白的表达。
qRT-PCR检测p-mTOR,4EBP1,ALDH1中mRNA的表达。(1)引物合成:mTOR上游引物序列5'-AGAGAGGACACAAGCAC-3',下游引物序列5'-CACAGATAATGGCAATG-3',扩增产物大小为155 bp;4EBP1上游引物序列5'-AAGCACCAGCCATCGTGT-3',下游引物序列5'-CTTTCCCAAGCACATCAACC-3',扩增产物大小为371 bp;GAPDH上游引物序列5'-TGATTCCACCCATGGCAAATTCC-3',下游引物序列5'-ACAGCCTTGGCAGCGCCAGTAGA-3',扩增产物大小为504 bp。上述引物均由生工生物(上海)工程有限公司合成。(2)总RNA的制备和cDNA合成:取对照、二甲双胍、雷帕霉素以及联合用药组干预后的细胞,Trizol法提取每组细胞的总RNA,紫外分光光度法检测纯度和浓度;取1 μg的总RNA按试剂说明书配制20 μl RT反应液,反应条件:37℃ 15 min;85℃ 5 s。(3)实时荧光定量聚合酶链反应(qRT-PCR):配制20 μl反应体系(SYBR Premix Ex TaqTMⅡ 10 μl、上游引物0.8 μl、下游引物0.8 μl、模板DNA 2.0 μl、dH2O 6.4 μl)。反应条件:95℃预变性10 min;95℃变性10 s,60℃退火10 s,72℃延伸10 s,共40个循环。以GAPDH为内参,具体计算方法如下:设阴性对照为1,分别将经不同药物处理的PANC-1细胞与对照组作比较,得倍数为N(N=2-ΔΔCt),其中ΔΔCt=(Ct目的基因-Ct内参基因)药物处理组-(Ct目的基因-Ct内参基因)对照组。实验均重复3次。
1.2.5 免疫荧光法检测ALDH1的表达取对数生长期PANC-1细胞,0.25%胰酶消化制成单细胞悬液,按照(3~5)×104个/孔接种到含有细胞爬片的24孔板中,加入完全培养液800 μl;待细胞过夜完全贴壁后,弃去原培养液后随机分为4组(分组同1.2.4)进行干预,置于37℃、5%CO2饱和湿度培养箱中培养48 h。取出24孔板弃去培养液,加入4%多聚甲醛冰上固定15 min,PBS洗3次,随后用0.5%Triton X-100室温通透20 min;用10%BSA室温封闭1h。加入30 μl一抗(ALDH1A1:1:(10~50))于24孔板中4℃孵育过夜。次日加入荧光二抗,湿盒中37℃避光孵育1 h。滴加DAPI,湿盒中避光室温孵育5 min,最后用含抗荧光淬灭剂的封片液封片。在莱卡TCS SP5共聚焦荧光显微镜下观察采集图像。使用ImageJ分析免疫荧光图片,获得的平均光密度值(average density)。实验均重复3次。
1.2.6 胰腺癌细胞悬浮成球培养取对数生长期PANC-1细胞,0.25%胰酶消化制成单细胞悬液,重悬于干细胞无血清培养液[10]中(无血清的DMEM/F12中含有20 ng/ml bFGF,20 ng/ml EGF,2% B27,4 μg/ml肝素钠,100 u /ml青霉素和100 μg/ml链霉素),按(1~3)×104个/孔的浓度接种到超低黏附6孔板中,加入干细胞培养液4 ml;将胰腺癌成球细胞随机分为四组(分组方法同1.2.4)并加入相应的干预,置于37℃、5%CO2饱和湿度培养箱中培养,每组设3个复孔。观察细胞形态并计数,并使用Leica DMI4000B倒置显微镜拍照记录。取上述培养的不同组成球细胞,采用Western blot法检测ALDH1蛋白的表达(方法同1.2.3)。实验均重复3次。
1.2.7 裸鼠胰腺癌移植瘤模型的构建购买Balb/c nu/nu裸小鼠(3~5周龄,体重18~20 g)10只,寄养于河南省实验动物中心。在恒温25℃~27℃、恒湿(45%~50%)、新鲜空气、除尘除菌的无特殊病原菌 (SPF级) 饲养室条件下饲养。每个饲养盒内饲养5~6只动物, 经无菌处理的水和饲料供动物自由摄入,严格遵循无菌原则操作。小鼠需饲养一周时间适应新环境,一周后可用于实验建模。取胰腺癌成球细胞(详见1.2.6中对照组胰腺癌细胞球),离心,0.25%胰酶消化并制成单细胞悬液,注射于裸鼠右侧皮下;同时,收集的对数生长期胰腺癌细胞作为对照组注射于裸鼠左侧皮下进行成瘤实验。在SPF环境下培养裸鼠,接种细胞后每3天观察记录一次小鼠体重,并观察肿瘤生长情况,观察至少两周时间,若有瘤体长出,使用数显游标卡尺测量肿瘤长径(a)及短径(b)按公式计算肿瘤体积。(注:肿瘤体积计算公式V=πab2/6,a和b分别为瘤体最长径和最短径)
1.3 统计学方法使用SPSS17.0软件进行统计分析,实验结果以均数±标准差表示,使用单因素ANOVA分析比较不同浓度二甲双胍对PANC-1细胞的增殖以及ALDH1和p-mTOR蛋白表达的影响,不同药物对PANC-1细胞和成球细胞中ALDH1,p-mTOR蛋白以及mRNA表达的影响,两两比较用LSD-t检验;应用独立样本t检验比较胰腺癌成球细胞与胰腺癌细胞中ALDH1蛋白表达的不同;应用非参数秩和检验比较胰腺癌成球细胞与胰腺癌细胞的成瘤体积大小。P < 0.05为差异有统计学意义。
2 结果 2.1 二甲双胍对PANC-1细胞增殖的抑制作用0、1、2、5、10、15和20 mmol/L的二甲双胍作用于胰腺癌PANC-1细胞后发现,相比于对照组,二甲双胍能够明显抑制PANC-1的增殖,呈时间和剂量依赖性,最佳作用时间为48 h,IC50约为20 mmol/L,见表 1。
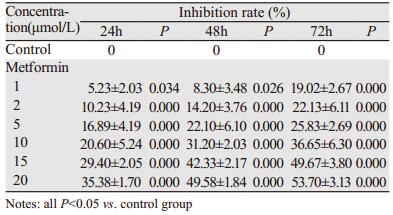
|
Western blot结果显示不同浓度的二甲双胍(0、2、5、10、15、20 mmol/L)均能抑制PANC-1细胞中ALDH1及p-mTOR蛋白的表达,并且随着二甲双胍浓度的增加,ALDH1以及p-mTOR的表达逐渐降低,并呈浓度依赖性(FALDH1A1=67.558, 均P=0.000; Fp-mTOR=115.882, P=0.024, 0.004, 0.000, 0.002, 0.000),见图 1。

|
| 图 1 Western blot检测不同浓度的二甲双胍对胰腺癌PANC-1细胞中ALDH与p-mTOR蛋白表达的影响 Figure 1 Effect of different concentrations of metformin on protein expression levels of ALDH1A1 and p-mTOR in PANC-1 cells evaluated by Western blot |
Western blot检测结果显示,二甲双胍、雷帕霉素以及联合用药组中ALDH1,4EBP1以及p-mTOR的蛋白水平均显著下降,与对照组比较,差异均有统计学意义(F=210.193, 96.959, 128.417;均P=0.000)。与雷帕霉素组相比,二甲双胍组中ALDH1的蛋白水平也显著降低,差异具有统计学意义(P=0.038);而二甲双胍组中4EBP1以及p-mTOR的蛋白水平未见明显变化(P=0.189, 0.808),见图 2。qRT-PCR的结果显示:二甲双胍组中ALDH1,4EBP1以及p-mTOR mRNA的转录水平下调,与对照组比较,差异均有统计学意义(P=0.000, 0.001, 0.000),雷帕霉素组中ALDH1、4EBP1以及p-mTOR mRNA的转录水平也下调,与对照组比较,差异均有统计学意义(P=0.000, 0.001, 0.000);二甲双胍组与雷帕霉素组的ALDH1转录水平比较,二甲双胍组中ALDH1的表达明显降低,差异具有统计学意义(P=0.007),见图 3。

|
| 图 2 四组PANC-1细胞中4EBP1,ALDH1A1,p-mTOR蛋白的表达 Figure 2 Protein expression levels of 4EBP1, ALDH1A1, p-mTOR in four groups evaluated by Western blot |

|
| **: P < 0.01, ***: P < 0.001 compared with Control group; n=3; 1: Control; 2: Metformin; 3: Rapamycin; 4: Metformin+rapamycin A, B, C: qRT-PCR analysis of ALDH1A1, 4EBP1 and p-mTOR 图 3 四组PANC-1细胞中4EBP1, ALDH1A1, p-mTOR mRNA的表达 Figure 3 mRNA levels of 4EBP1, ALDH1A1, p-mTOR in four groups evaluated by qRT-PCR |
免疫荧光法检测结果显示:二甲双胍、雷帕霉素以及联合用药组中ALDH1的表达显著下降,与对照组比较,差异具有统计学意义(F=474.100, 均P=0.000),见图 4。

|
| A: immunofluorescence analysis of ALDH1A1 in control group; B: immunofluorescence analysis of ALDH1A1 in metformin group (20mmol/L); C: immunofluorescence analysis of ALDH1A1 in rapamycin group (100nmol/L); D: immunofluorescence analysis of ALDH1A1 in combination group (Metformin 20mmol/L+ Rapamycin 100nmol/L); E: analysis of immunofluorescence results; ***: P < 0.001, compared with control group; n=5 图 4 免疫荧光检测ALDH1A1在PANC-1细胞胞质中的表达 (×200) Figure 4 Immunofluorescence detection of ALDH1A1 expressin in PANC-1 cytoplasm (×200) |
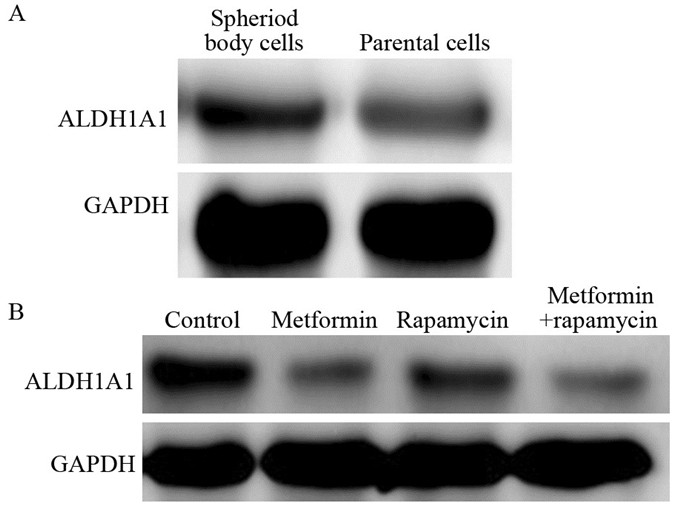
胰腺癌细胞系PANC-1在超低黏附6孔板中使用干细胞培养基培液,并随机分成四组:7天后观察并记录不同干预组中细胞成球数目的差异:相比于对照组成球数目(85.00±5.12),二甲双胍组成球数目为(43.00±3.66),雷帕霉素组为(55.00±3.21),联合用药组为(30.00±2.83)(F=234.439, 均P=0.000),见图 5。为进一步探究二甲双胍对胰腺癌干细胞ALDH1表达的影响,Western blot检测并比较不同组中ALDH1蛋白的表达水平后发现,胰腺癌成球细胞中ALDH1的表达水平明显高于胰腺癌细胞中ALDH1的表达水平(t=18.542, P=0.000);在胰腺癌成球细胞中发现:二甲双胍、雷帕霉素以及联合用药组中ALDH1蛋白的表达均显著下降,与对照组比较差异具有统计学意义(F=1013.499, 均P=0.000),见图 6。

|
| A: the number of spheroid body cells in control group; B: the number of spheroid body cells in metformin group (20mmol/L); C: the number of spheroid body cells in rapamycin group (100nmol/L); D: the number of spheroid body cells in combination group (Metformin 20mmol/L+ Rapamycin 100nmol/L); E: the analysis of spheroid body cells. ***: P < 0.001, compared with Control group; n=6 图 5 四组PANC-1细胞成球数目的比较 (×100) Figure 5 Comparison of PANC-1 spheroid body cells number in four groups (×100) |
|
| A: the expression of ALDH1A1 in pareatal cells and spheroid body cells; B: spheroid body cells were divided into four groups: control group, metformin group (20mmol/L), rapamycin group (100nmol/L) and combination group (Metformin 20mmol/L+Rapamycin 100nmol/L); n=3 图 6 不同组成球细胞中ALDH1A1蛋白的表达 Figure 6 The expressions of ALDH1A1 in different groups of spheroid body cells |
胰腺癌PANC-1细胞的成瘤能力较低(7/10),胰腺癌成球细胞的成瘤能力显著升高(10/10)。在接种细胞后比较两组肿瘤体积后发现,胰腺癌成球细胞组的肿瘤体积明显大于胰腺癌PANC-1细胞组的肿瘤体积,差异具有统计学意义(χ2=8.149, P=0.004),见图 7。

|
| A: the comparison of pancreatic tumors between parental cells group and spheroid body cells group; B: the analysis of tumor volume in parental cells group and spheroid body cells group 图 7 不同组中裸鼠移植瘤体积的比较 Figure 7 The volume comparison of nude mice transplanted tumors in different groups |
研究发现ALDH高表达的胰腺癌细胞具有干细胞的特性,并且与胰腺癌患者的预后以及疾病的进展密切相关[11]。随后,Rasheed等[12]以ALDH为表面标志物分离提取ALDH+胰腺癌干细胞,发现胰腺癌干细胞具有自我更新能力、成瘤以及侵袭转移能力,与胰腺癌的转移,耐药有关。因此,针对ALDH的研究在胰腺癌的治疗中越来越重要。二甲双胍作为2型糖尿病的一线用药,通过抑制肿瘤细胞的增殖、促进肿瘤细胞凋亡、增强肿瘤对化疗药物的敏感度、抑制肿瘤新生血管的生成,进而抑制肿瘤的生长[13]。二甲双胍不仅可以显著降低糖尿病患者胰腺癌的发病率[14];还能够提高非糖尿病胰腺癌患者术后的总生存期[15]。另外,在正常血糖浓度下,二甲双胍能够通过抑制PI3K/Akt/mTOR通路,抑制胰腺癌细胞的增殖[8],其中mTOR是一种存在两个不同功能复合物(mTORC1和mTORC2)的丝氨酸/苏氨酸激酶,在人类癌症患者组织中普遍表达失调,其中mTORC1可以激活S6K1和4EBP1,通过控制mRNA翻译起始和延伸来调节细胞的生长[16]。Mohammed等[9]在p48Cre/+LSL-KrasG12D/+的转基因小鼠诱发的胰腺上皮内瘤变以及胰腺导管腺癌的过程中发现,二甲双胍通过下调CSCs表面标志分化簇ALDH1以及阻断mTOR信号通路,抑制胰腺癌干细胞的增殖,综上推测mTOR的下调可能与mTOR信号通路有关。
在本研究发现,二甲双胍能够明显抑制胰腺癌PANC-1细胞增殖的能力以及ALDH1和p-mTOR蛋白的表达,呈浓度依赖性。雷帕霉素作为mTOR信号通路的抑制剂[17],能够抑制胰腺癌细胞的生长;4EBP1蛋白作为mTOR信号通路的下游基因,在结肠癌、卵巢癌、乳腺癌以及前列腺癌中高表达,预示着患者的预后较差[18-19]。本研究发现,雷帕霉素和二甲双胍均能够显著抑制胰腺癌细胞ALDH1,p-mTOR以及下游基因4EBP1的表达。然而雷帕霉素作为mTOR信号通路的靶点抑制剂,除mTOR信号通路外,目前尚未发现雷帕霉素与二甲双胍存在其他的共同作用通路,因此推测二甲双胍和雷帕霉素可能均通过抑制mTOR通路来降低ALDH1的表达。但是在研究中发现二甲双胍对ALDH1蛋白表达的作用强于雷帕霉素,猜想二甲双胍不仅通过mTOR信号通路,可能还存在其他的信号通路影响ALDH1的表达,这需要进一步的探究。随后,利用无血清培养液悬浮培养胰腺癌成球细胞时发现,胰腺癌成球细胞的体外成瘤能力要明显强于胰腺癌细胞,并且ALDH1在成球细胞中的表达明显升高,说明ALDH+的细胞在成球细胞中富集。胰腺癌成球细胞的自我分化能力和成瘤能力均比胰腺癌细胞高,并且高表达ALDH1,符合胰腺癌干细胞的特性。另外,二甲双胍以及雷帕霉素均能够抑制胰腺癌PANC-1细胞球的形成,还能够抑制胰腺癌成球细胞中ALDH1的表达。
综上所述,二甲双胍以及雷帕霉素均能抑制胰腺癌PANC-1细胞系以及胰腺癌干细胞中ALDH1的表达,并推测二甲双胍可能通过mTOR信号通路来降低ALDH1的表达。这不仅揭示二甲双胍抗肿瘤内在机制以及雷帕霉素对ALDH1表达的影响;而且ALDH1作为胰腺癌干细胞的标志物,与胰腺癌的复发,转移以及耐药密切相关,这将是二甲双胍抗肿瘤干细胞治疗的一个新的研究方向。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–86. DOI:10.1002/ijc.29210 |
| [2] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9–29. DOI:10.3322/caac.21208 |
| [3] | Hermann PC, Huber SL, Herrler T, et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer[J]. Cell Stem Cell, 2007, 1(3): 313–23. DOI:10.1016/j.stem.2007.06.002 |
| [4] | Wang Z, Li Y, Ahmad A, et al. Pancreatic cancer: understanding and overcoming chemoresistance[J]. Nat Rev Gastroenterol Hepatol, 2011, 8(1): 27–33. DOI:10.1038/nrgastro.2010.188 |
| [5] | Li C, Lee CJ, Simeone DM. Identification of human pancreatic cancer stem cells[J]. Methods Mol Biol, 2009, 568: 161–73. DOI:10.1007/978-1-59745-280-9 |
| [6] | Evans JM, Donnelly LA, Emslie-Smith AM, et al. Metformin and reduced risk of cancer in diabetic patients[J]. BMJ, 2005, 330(7503): 1304–5. DOI:10.1136/bmj.38415.708634.F7 |
| [7] | Rizos CV, Elisaf MS. Metformin and cancer[J]. Eur J Pharmacol, 2013, 705(1-3): 96–108. DOI:10.1016/j.ejphar.2013.02.038 |
| [8] | Karnevi E, Said K, Andersson R, et al. Metformin-mediated growth inhibition involves suppression of the IGF-Ⅰ receptor signalling pathway in human pancreatic cancer cells[J]. BMC Cancer, 2013, 13: 235. DOI:10.1186/1471-2407-13-235 |
| [9] | Mohammed A, Janakiram NB, Brewer M, et al. Antidiabetic Drug Metformin Prevents Progression of Pancreatic Cancer by Targeting in Part Cancer Stem Cells and mTOR Signaling[J]. Transl Oncol, 2013, 6(6): 649–59. DOI:10.1593/tlo.13556 |
| [10] | Ning X, Du Y, Ben Q, et al. Bulk pancreatic cancer cells can convert into cancer stem cells (CSCs) in vitro and 2 compounds can target these CSCs[J]. Cell Cycle, 2016, 15(3): 403–12. DOI:10.1080/15384101.2015.1127471 |
| [11] | Rasheed ZA, Yang J, Wang Q, et al. Prognostic significance of tumorigenic cells with mesenchymal features in pancreatic adenocarcinoma[J]. J Natl Cancer Inst, 2010, 102(5): 340–51. DOI:10.1093/jnci/djp535 |
| [12] | Rasheed Z, Wang Q, Matsui W. Isolation of stem cells from human pancreatic cancer xenografts[J]. J Vis Exp, 2010, (43). pⅱ: 2169. |
| [13] | Jara JA, López-Muñoz R. Metformin and cancer: Between the bioenergetic disturbances and the antifolate activity[J]. Pharmacol Res, 2015, 101: 102–8. DOI:10.1016/j.phrs.2015.06.014 |
| [14] | Sadeghi N, Abbruzzese JL, Yeung SC, et al. Metformin use is associated with better survival of diabetic patients with pancreatic cancer[J]. Clin Cancer Res, 2012, 18(10): 2905–12. DOI:10.1158/1078-0432.CCR-11-2994 |
| [15] | Cerullo M, Gani F, Chen SY, et al. Metformin Use Is Associated with Improved Survival in Patients Undergoing Resection for Pancreatic Cancer[J]. J Gastrointest Surg, 2016, 20(9): 1572–80. DOI:10.1007/s11605-016-3173-4 |
| [16] | Guertin DA, Sabatini DM. Defining the role of mTOR in cancer[J]. Cancer Cell, 2007, 12(1): 9–22. DOI:10.1016/j.ccr.2007.05.008 |
| [17] | Xu M, Bu LM, Wu K, et al. Rapamycin inhibits the proliferation of SW1990 pancreatic cancer cell[J]. Eur Rev Med Pharmacol Sci, 2015, 19(16): 3072–9. |
| [18] | No JH, Jeon YT, Park IA, et al. Activation of mTOR signaling pathway associated with adverse prognostic factors of epithelial ovarian cancer[J]. Gynecol Oncol, 2011, 121(1): 8–12. DOI:10.1016/j.ygyno.2010.12.364 |
| [19] | Coleman LJ, Peter MB, Teall TJ, et al. Combined analysis of eIF4E and 4E-binding protein expression predicts breast cancer survival and estimates eIF4E activity[J]. Br J Cancer, 2009, 100(9): 1393–9. DOI:10.1038/sj.bjc.6605044 |
 2017, Vol. 44
2017, Vol. 44


