文章信息
- 放射抗拒鼻咽癌细胞中Annexin A2相互作用蛋白的研究
- Study on Annexin A2 Interacting Proteins in Nasopharyngeal Carcinoma Cells
- 肿瘤防治研究, 2017, 44(2): 88-93
- Cancer Research on Prevention and Treatment, 2017, 44(2): 88-93
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.02.002
- 收稿日期: 2016-05-19
- 修回日期: 2016-09-13
2. 350014 福州,福建省肿瘤医院放疗科;
3. 350108 福州,福州大学生物科学与工程学院
2. Department of Radiotherapy, Fujian Provincial Cancer Hospital, Fuzhou 350014, China;
3. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350108, China
世界卫生组织统计显示全球约80%的鼻咽癌发生在中国,以华南及香港地区发病率最高,达20/10万以上。放射治疗是鼻咽癌首选的治疗方法。虽然现在鼻咽癌5年的局部控制率可达80%~90%,但仍有一些患者治疗失败,局部复发和远处转移仍是死亡的主要原因,这可能与肿瘤中存在或放疗过程中出现对射线抗拒的细胞成分有关[1-2]。Annexin A2是钙离子依赖的磷脂结合蛋白,参与肿瘤浸润、转移等作用,多数研究表明Annexin A2与肿瘤细胞的氧化反应、DNA损伤修复等密切相关[3-4],推测Annexin A 2可能与肿瘤的放射敏感度相关[5]。为探讨Annexin A2在鼻咽癌放射抗拒中的分子机制,本研究采用免疫共沉淀结合质谱的方法,筛选并鉴定Annexin A2的相互作用蛋白,生物信息学分析免疫共沉淀差异蛋白之间的相互作用,为进一步明确Annexin A2蛋白在鼻咽癌放疗抗拒中的作用机制提供基础。
1 材料与方法 1.1 细胞株及主要试剂放射敏感的鼻咽癌细胞CNE-2由福建省肿瘤医院放射生物研究室保存,放射抗拒的人鼻咽癌CNE-2(R743)细胞以鼻咽癌CNE-2细胞经诱导建立并保存[6]。RPMI 1640(Cat# SH30809.01,Lot# ABB212915)购自美国Hclone公司,胰酶(Cat# 0458-250G,ot#1425C425)购自美国Amresco公司,新生牛血清(Cat# 22011-8612/22011-8615,Lot# 150213)购自杭州天杭生物科技有限公司(四季青),Annexin A2一抗(Cat# Sc28385,Lot# CB16)购自美国Santa Cruz公司,Calnexin(Cat# 2679S,Lot# 3)、HSP90(Cat # 4877S,Lot# 1)、GRP78(Cat# 3177S,Lot# 1)、Vimentin(Cat# 5741S,Lot# 1)和HSP27(Cat# 2402S,Lot# 8)等一抗均购自美国CST公司,Co-IP试剂盒(Cat# 26149,Lot# NA16533878)、BCA蛋白定量试剂盒(Cat# 23227,Lot# QL227055)、HRP标记的二抗(Cat# 21460,Lot# LB142282 )和ECL化学发光检测试剂盒(Cat# CNI5080,Lot# PB198218)均购自美国Thermo公司。
1.2 细胞培养及处理CNE-2(R743)和CNE-2细胞用含20%新生牛血清RPMI 1640培养液,于5%CO2、37℃条件下培养。待细胞长到对数生长期时用胰酶消化,冷PBS清洗后离心去除上清液,细胞沉淀加终浓度为1 mmol/L PMSF的PBS重悬,冰浴中超声破碎,4℃、12 000 r/min离心10 min,收集上清液,用BCA试剂盒测定总蛋白浓度。
1.3 蛋白免疫共沉淀(Co-IP)平衡氨基强化偶联树脂、对照树脂和相关试剂至室温,用偶联缓冲液洗涤树脂,加Annexin A2抗体(10~75 μg/200 μl 偶联缓冲液)和适量氰基硼氢化钠到氨基强化偶联树脂,混匀后室温摇动2 h使抗体偶联到树脂上,然后用偶联缓冲液和洗涤缓冲液洗涤树脂,加定量后的总蛋白溶液列含Annexin A2抗体偶联的树脂和无Annexin A2抗体偶联的对照树脂中,4℃轻柔混匀孵育过夜。孵育结束后,4℃离心1 min。用200 μl的IP裂解/洗涤缓冲液洗树脂2次以上,然后4℃离心1 min。加50 μl洗脱缓冲液,室温孵育5 min,4℃离心1 min。收集洗脱液,用10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离共沉淀蛋白,在BIO-RAD的Gel Doc XR+凝胶成像系统上成像并分析。
1.4 质谱MALDI-TOF/TOF鉴定从SDS-PAGE胶上的共沉淀泳道切取与对照树脂泳道有差异的蛋白条带于1.5 ml的EP管中,用50%乙腈和50 mmol/L碳酸氢铵脱色2次;乙腈脱水冷冻干燥。加入消化液(12.5 mg/L胰蛋白酶+20 mmol/L 碳酸氢铵)冰浴作用20 min,37℃酶解12 h,收集上清液用60 μl萃取液(100%乙腈:10%甲酸=1:1)萃取60 min 2次。收集萃取液于0.5 ml EP管,在液氮的保护下冷冻干燥,用0.8 μl的基质液溶解,溶解液上样点在MALDI靶板上,在ABI的4700 MALDI-TOF/TOF质谱仪上进行分析,分析时采用反射模式,正离子谱测定,离子源加速电压20 000 V,反射电压比1.12,N2激光波长355 nm,频率200 Hz,离子延迟提取100 ns,真空度4×10-7 Torr(托),质谱信号单次扫描累加50次,使用胰蛋白酶消化的肌红蛋白作为内校正。获得肽质量指纹图谱用4700用GPS ExplorerTM软件(版本3.6,AB SCIEX)分析。Mascot(v2.3,Matrix Science,London,UK)软件检索NCBInr数据库鉴定蛋白质。
1.5 Western blot验证Annexin A2相互作用蛋白的表达将经Annexin A2免疫共沉淀的蛋白共上6个泳道后,经10%聚丙烯酰胺凝胶电泳(SDS-PAGE),恒流转移至PVDF膜上,用3%BSA封闭1 h,TTBS(Tris-HCl 20 mmol/L pH7.2,NaCl 150 mmol/L,吐温-20 0.05%)洗膜3 min×6次,然后分别加入用TTBS稀释的Annexin A2(1/500)、Calnexin(1/1000)、HSP90(1/1000)、GRP78(1/1000)、Vimentin(1/1000)、HSP27(1/1000)抗体与膜上的抗原结合,用相应的HRP偶联的二抗与其反应后,加ECL化学发光试剂,在Carestream公司的4000MM PRO多功能成像分析系统采集数据并分析。
1.6 生物信息学分析用String在线软件(http://string-db.org/)对质谱鉴定得到的免疫共沉淀差异的相互作用蛋白进行分析,并得出相互作用图。
2 结果 2.1 免疫共沉淀蛋白的SDS-PAGE分析抗Annexin A2抗体与人放射抗拒的鼻咽癌CNE-2(R743)细胞总蛋白进行免疫共沉淀,收集免疫共沉淀蛋白复合物进行SDS-PAGE分离,经考马斯亮蓝染色后的结果如下。与对照组相比,共沉淀实验组检测到6条差异条带,其相对分子质量分别约为22、40、53、67、72、83 kD,其中在约为40 kD的位置上有一条明显的差异蛋白条带,该蛋白条带的分子量与目的蛋白Annexin A2一致,由此推测这些差异蛋白很可能是与Annexin A2相互作用蛋白,见图 1。
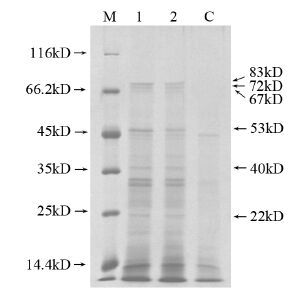
|
| M: marker; 1: Co-immunoprecipitation protein of Annexin A2 from CNE-2(R743) cells; 2: Co-immunoprecipitation protein of Annexin A2 from CNE-2 cells; C: control 图 1 SDS-PAGE检测Annexin A2免疫共沉淀蛋白 Figure 1 Detection of Co-Immunoprecipitation protein of Annexin A2 by SDS-PAGE |
从凝胶中切取差异蛋白条带,进行MALDI-TOF/TOF鉴定分析。利用Mascot查询检索NCBInr蛋白质数据库,搜索的结果以Mascot分数>60分认为是阳性鉴定,否则视为未得到鉴定。6个差异蛋白质都得到鉴定。分子量约为40 kD差异蛋白的肽质量指纹图(PMF)检索NCBInr数据库显示为Annexin A2蛋白。得到鉴定的6个差异蛋白具体的质谱信息分别见表 1(图略)。
为了验证质谱鉴定的结果,采用Western blot检测Annexin A2的免疫共沉淀复合物和对照树脂洗脱产物。结果显示,从CNE-2(R743)和CNE-2细胞提取的Annexin A2的免疫共沉淀复合物能明显检测到Annexin A2、Calnexin、HSP90、GRP78、Vimentin、HSP27等蛋白的存在,而对照树脂洗脱产物均检测不到这些差异蛋白,与SDS-PAGE电泳结果一致,见图 2。
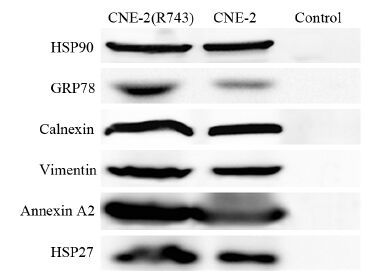
|
| 图 2 Western blot检测Annexin A2与Calnexin、HSP90、GRP78、Vimentin、HSP27的相互作用 Figure 2 Detection of interaction between Annexin A2 and Calnexin,HSP90,GRP78,Vimentin,HSP27 by Western blot |
用String在线软件对质谱鉴定的免疫共沉淀差异蛋白的相互作用进行分析,结果显示Annexin A2与HSP90(HSP90AA1)、GRP78(HSPA5)和HSP27(HSPB1)存在直接相互作用;而Annexin A2与Calnexin和Vimentin虽然没有直接相互作用,但有间接的相互作用。生物信息学分析结果说明Annexin A2可能与这些蛋白存在相互作用,见图 3。
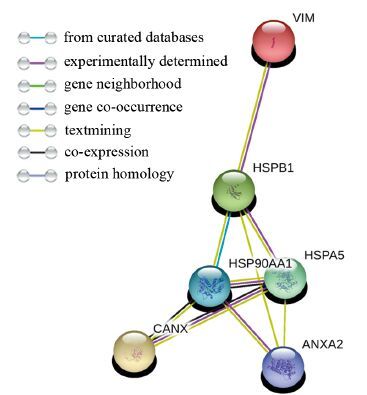
|
| 图 3 生物信息学分析Annexin A2与Calnexin、HSP90、GRP78、Vimentin、HSP27的蛋白相互作用 Figure 3 Bioinformatics analysis of the protein interaction between Annexin A2 and Calnexin,HSP90,GRP78,Vimentin,HSP27 |
放射治疗是鼻咽癌首选的治疗方法。随着影像学与放疗技术的进步,鼻咽癌患者放疗后局部复发率和远处转移率明显降低,尤其是采用调强放疗技术后,3年无局部复发生存率和无远处转移率分别可达90%以上和80%以上,83%的肿瘤复发于X线高照射剂量范围内,且肿瘤局部侵犯的范围(T分期)已经不是复发的独立预后因素[7],说明鼻咽癌的复发和转移可能与肿瘤细胞本身的放射敏感度密切相关。Annexin A2基因被认为是与放射敏感度相关的基因之一,实验研究提示Annexin A2蛋白过表达的鼻咽癌细胞对X射线比较抗拒,低表达的鼻咽癌细胞对X射线比较敏感[5]。
Annexin A2是钙离子依赖的磷脂结合蛋白,其蛋白异常表达和肿瘤的发生发展有密切关系[3, 8]。敲除Annexin A2能明显抑制肝癌细胞的生长并能增加对化疗药物5-氟尿嘧啶的敏感度,其主要机制是通过调控WNT信号通路中的关键分子β-catenin和cyclin D1的表达来实现[9]。Madureira等[4]研究表明,虽然Annexin A2主要定位于细胞质和细胞膜,但细胞核内也有少量的表达,能发挥核蛋白的功能,抗氧化剂N-乙酰半胱氨酸能阻止Annexin A2在核内的积累,而过氧化氢能刺激其在核内的积累,位于细胞核内的Annexin A2可减轻遗传毒性剂(如UV)对DNA的损伤,提示Annexin A2可能与肿瘤细胞的放射敏感度有关。本课题组的前期研究证实了这种推测,即在放射抗拒的鼻咽癌细胞株CNE-2(R743)存在过表达的Annexin A2[5],下调Annexin A2的表达可增强CNE-2(R743)细胞放射敏感度[10],提示Annexin A2可能与鼻咽癌的放射抗拒作用有关。
但有关Annexin A2在鼻咽癌放射抗拒的作用机制至今仍不明确,为此,本研究通过免疫共沉淀并结合质谱技术筛选鉴定5个与Annexin A2相互作用的蛋白,分别是Calnexin、HSP90、GRP78、Vimentin、HSP27。为了进一步证实质谱鉴定的正确性,本研究通过免疫印迹实验测定有Annexin A2抗体结合的树脂和对照树脂洗脱液的成分,结果说明质谱鉴定是正确的,即在Annexin A2相互作用的蛋白复合物中存在Calnexin、HSP90、GRP78、Vimentin、HSP27等蛋白。
为了进一步明确Annexin A2与这些蛋白的相互作用,本研究用生物信息学的方法进行分析,结果显示3个蛋白与Annexin A2存在直接作用,2个蛋白与Annexin A2存在间接作用,对这些蛋白的生物学功能进行分析提示其与肿瘤的发生、发展以及放射敏感度相关。
HSP90是热休克蛋白(HSP) 家族的主要成员之一,在肿瘤发生、发展的众多信号通路中起重要作用:包括生长与生长抑制的调控、逃避凋亡、无限制地复制、肿瘤转移和组织浸润、维持血管生成等。HSP90抑制剂通过诱导大多数抑癌基因的表达能明显抑制肿瘤的增殖、侵袭和迁移能力[11]。最新研究表明,HSP90与肿瘤细胞的放射敏感度密切相关,HSP90抑制剂能提高放射后人血细胞中锰超氧化物歧化酶(MnSOD)和过氧化氢酶(CAT)的表达水平,从而保护血细胞减少放射损伤[12]。抑制HSP90的作用能明显提高肿瘤细胞的放射敏感度,减少肿瘤的复发、提高治疗效果[13-14]。这些结果提示Annexin A2的鼻咽癌的放射抗拒可能与HSP90有密切的关系。本研究通过生物分析也发现两者存在直接作用,至于它们之间是如何相互作用将在后续的实验进行研究。
HSP27是HSP家族的主要成员之一,在正常生理状态下,HSP27表达较低以利于细胞活动的正常进行。HSP27高表达与恶性肿瘤关系密切,在许多恶性肿瘤中均发现有高表达[15-16]。抑制HSP27的表达能明显提高头颈部肿瘤的放射敏感度[17]。本研究通过在线软件String分析发现Annexin A2与HSP27存在直接的相互作用,它们之间具体的相互作用将在后续实验进行研究。
葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)是内质网的分子伴侣蛋白,能够促进细胞蛋白质成熟,是维系细胞机能和生命的关键性调节物质,与肿瘤的侵袭、转移以及耐药性的产生有着密切的关系,上调GRP78的表达能提高肺癌细胞的侵袭和转移能力,而下调GRP78的表达能降低肺癌细胞的侵袭和转移能力[18-19]。近来的研究表明GRP78在多种肿瘤表达上调,提示可能与肿瘤的放射敏感度密切相关。Nishad等通过蛋白质组学技术分析发现:与未放射的细胞相比,放射组人外周血单核细胞(PBMC)的GRP78蛋白的表达量出现明显改变[20]。敲除GRP78能增强药物OSU-03012对胶质瘤细胞的致死率,过表达GRP78会降低OSU-03012对胶质瘤细胞的杀伤作用[21]。Dadey等研究发现放射能诱导胶质瘤细胞的GRP78蛋白的表达上调,该上调与内质网应激ERS有关[22]。胶质瘤干细胞(CD133+GSCs)是多形性胶质母细胞瘤(GBM)形成和对放化疗抵抗以及放疗后肿瘤复发的根源,GRP78的高表达与GSCs形成有关,沉默GRP78的表达能提高GBM细胞的放射敏感度[23]。国内Li等通过研究发现,在乳腺癌细胞MCF-7中GRP78高表达,下调GRP78的表达能明显提高细胞的放射敏感度,上调GRP78的表达则提高细胞的放射抗性[24]。上述这些研究表明,GRP78可能与鼻咽癌细胞的放射敏感度密切相关。我们的前期实验也证实GRP78和Annexin A2在放射抗拒的鼻咽癌细胞中高表达[5]。
钙联蛋白Calnexin是内质网中的一种跨膜蛋白,作为内质网中的一类重要的类凝集素分子伴侣,Calnexin参与细胞内的的代谢、应激反应、参与细胞凋亡、可以作为肺癌血清学诊断的分子标志物[25-26]。
近年来越来越多的文献显示,波形蛋白Vimentin在许多上皮性肿瘤细胞,尤其是低分化癌中异常表达,证实Vimentin在上皮性肿瘤细胞中的异常表达,与肿瘤细胞浸润和转移的能力密切相关[27]。Vimentin表达阴性的宫颈癌患者比阳性患者在放疗后有更好的治疗效果[28]。有关Vimentin与Annexin A2的相互作用将在后续的实验中进行探讨。
本研究在放射抗拒的鼻咽癌细胞中鉴定了5个与Annexin A2相互作用的蛋白,目前尚未见到这一研究报道,它们之间如何相互作用有待后续的深入细致研究,这将有助于进一步探讨Annexin A2在鼻咽癌中放射抗拒的作用机制。
| [1] | Kong F, Ying H, Du C, et al. Patterns of local-regional failure after primary intensity modulated radiotherapy for nasopharyngeal carcinoma[J]. Radiat Oncol, 2014, 9 : 60. DOI:10.1186/1748-717X-9-60 |
| [2] | Luftig M. Heavy LIFting: tumor promotion and radioresistance in NPC[J]. J Clin Invest, 2013, 123 (12) : 4999–5001. DOI:10.1172/JCI73416 |
| [3] | Madureira PA, Hill R, Miller VA, et al. Annexin A2 is a novel cellular redox regulatory protein involved in tumorigenesis[J]. Oncotarget, 2011, 2 (12) : 1075–93. DOI:10.18632/oncotarget |
| [4] | Madureira PA, Hill R, Lee PW, et al. Genotoxic agents promote the nuclear accumulation of annexin A2: role of annexin A2 in mitigating DNA damage[J]. PLoS One, 2012, 7 (11) : e50591. DOI:10.1371/journal.pone.0050591 |
| [5] | Su Y, He HC, Wu JX, et al. Comparative proteomic study of naspharyngeal carcinoma cell lines with different radiosensitivity[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2011, 31 (5) : 536–41. [ 苏颖, 何火聪, 吴君心, 等. 鼻咽癌细胞放射敏感性的比较蛋白质组学研究[J]. 中华放射医学与防护杂志, 2011, 31 (5) : 536–41. ] |
| [6] | Su Y, Wu JX, He HC, et al. Establishment of a radioresistant subline CNE-2(R743) from human nasopharyngeal carcinoma cell line and its differentially expressed proteins[J]. Fujian Yi Ke Da Xue Xue Bao, 2011, 45 (6) : 398–403. [ 苏颖, 吴君心, 何火聪, 等. 鼻咽癌放射抗拒细胞株CNE-2(R743)的建立及其差异表达蛋白的初步分析[J]. 福建医科大学学报, 2011, 45 (6) : 398–403. ] |
| [7] | Chen J, Liu P, Wang Q, et al. Influence of Intensity-Modulated Radiation Therapy on the Life Quality of Patients with Nasopharyngeal Carcinoma[J]. Cell Biochem Biophys, 2015, 73 (3) : 731–6. DOI:10.1007/s12013-015-0638-0 |
| [8] | Lokman NA, Ween MP, Oehler MK, et al. The role of annexin A2 in tumorigenesis and cancer progression[J]. Cancer Microenviron, 2011, 4 (2) : 199–208. DOI:10.1007/s12307-011-0064-9 |
| [9] | Wang C, Guo Y, Wang J, et al. Annexin A2 knockdown inhibits hepatoma cell growth and sensitizes hepatoma cells to 5-fluorouracil by regulating β-catenin and cyclin D1 expression[J]. Mol Med Rep, 2015, 11 (3) : 2147–52. |
| [10] | Su Y, He HC, Wu JX, et al. Effect of silencing Annexin A2 gene expression by siRNA on radiosensitivity of nasopharyngeal carcinoma cells[J]. Zhonghua Fang She Zhong Liu Xue, 2015, 24 (2) : 214–8. [ 苏颖, 何火聪, 吴君心, 等. siRNA沉默Annexin A2基因表达对鼻咽癌细胞放射敏感性的影响[J]. 中华放射肿瘤学, 2015, 24 (2) : 214–8. ] |
| [11] | Chen TL, Gupta N, Lehman A, et al. Hsp90 inhibition increases SOCS3 transcript and regulates migration and cell death in chronic lymphocytic leukemia[J]. Oncotarget, 2016, 7 (9) : 28684–96. |
| [12] | Stankova K, Savova G, Nikolov V, et al. HSP90 Inhibitor Geldanamycin as a Radiation Response Modificator in Human Blood Cells[J]. Dose Response, 2015, 13(1): pii: dose-response. 14-039. Stankova. |
| [13] | Gomez-Casal R, Epperly MW, Wang H, et al. Radioresistant human lung adenocarcinoma cells that survived multiple fractions of ionizing radiation are sensitive to HSP90 inhibition[J]. Oncotarget, 2015, 6 (42) : 44306–22. |
| [14] | Spiegelberg D, Dascalu A, Mortensen AC, et al. The novel HSP90 inhibitor AT13387 potentiates radiation effects in squamous cell carcinoma and adenocarcinoma cells[J]. Oncotarget, 2015, 6 (34) : 35652–66. |
| [15] | Nagaraja GM, Kaur P, Asea A. Role of human and mouse HspB1 in metastasis[J]. Curr Mol Med, 2012, 12 (9) : 1142–50. DOI:10.2174/156652412803306701 |
| [16] | Lee SS, Tsai CH, Ho YC, et al. Heat shock protein 27 expression in areca quid chewing-associated oral squamous cell carcinomas[J]. Oral Dis, 2012, 18 (7) : 713–9. DOI:10.1111/odi.2012.18.issue-7 |
| [17] | Guttmann DM, Hart L, Du K, et al. Inhibition of Hsp27 radiosensitizes head-and-neck cancer by modulating deoxyribonucleic acid repair[J]. Int J Radiat Oncol Biol Phys, 2013, 87 (1) : 168–75. DOI:10.1016/j.ijrobp.2013.05.028 |
| [18] | Gopal U, Gonzalez-Gronow M, Pizzo SV. Activated α2-Macroglobulin Regulates Transcriptional Activation of c-Myc Target Genes Through Cell Surface GRP78[J]. J Biol Chem, 2016, 291 (20) : 10904–15. DOI:10.1074/jbc.M115.708131 |
| [19] | Toyoda K, Fukuda T, Sanui T, et al. Grp78 Is Critical for Amelogenin-Induced Cell Migration in a Multipotent Clonal Human Periodontal Ligament Cell Line[J]. J Cell Physiol, 2016, 231 (2) : 414–27. DOI:10.1002/jcp.v231.2 |
| [20] | Nishad S, Ghosh A. Dynamic changes in the proteome of human peripheral blood mononuclear cells with low dose ionizing radiation[J]. Mutat Res Genet Toxicol Environ Mutagen, 2016, 797 : 9–20. DOI:10.1016/j.mrgentox.2016.01.001 |
| [21] | Booth L, Cazanave SC, Hamed HA, et al. OSU-03012 suppresses GRP78/BiP expression that causes PERK-dependent increases in tumor cell killing[J]. Cancer Biol Ther, 2012, 13 (4) : 224–36. DOI:10.4161/cbt.13.4.18877 |
| [22] | Dadey DY, Kapoor V, Khudanyan A, et al. The ATF6 pathway of the ER stress response contributes to enhanced viability in glioblastoma[J]. Oncotarget, 2016, 7 (2) : 2080–92. |
| [23] | Huynh TT, Lin CM, Lee WH, et al. Pterostilbene suppressed irradiation-resistant glioma stem cells by modulating GRP78/miR-205 axi[J]. J Nutr Biochem, 2015, 26 (5) : 466–75. DOI:10.1016/j.jnutbio.2014.11.015 |
| [24] | Li B, Cheng XL, Yang YP, et al. GRP78 mediates radiation resistance of a stem cell-like subpopulation within the MCF-7 breast cancer cell line[J]. Oncol Rep, 2013, 30 (5) : 2119–26. |
| [25] | Bousette N, Abbasi C, Chis R, et al. Calnexin silencing in mouse neonatal cardiomyocytes induces Ca2+ cycling defects, ER stress, and apoptosis[J]. J Cell Physiol, 2014, 229 (3) : 374–83. DOI:10.1002/jcp.24459 |
| [26] | Kobayashi M, Nagashio R, Jiang SX, et al. Calnexin is a novel sero-diagnostic marker for lung cancer[J]. Lung Cancer, 2015, 90 (2) : 342–5. DOI:10.1016/j.lungcan.2015.08.015 |
| [27] | Liu Z, Chen L, Zhang X, et al. RUNX3 regulates vimentin expression via miR-30a during epithelial-mesenchymal transition in gastric cancer cells[J]. J Cell Mol Med, 2014, 18 (4) : 610–23. DOI:10.1111/jcmm.2014.18.issue-4 |
| [28] | Cheng CW, Wang HW, Chang CW, et al. MicroRNA-30a inhibits cell migration and invasion by downregulating vimentin expression and is a potential prognostic marker in breast cancer[J]. Breast Cancer Res Treat, 2012, 134 (3) : 1081–93. DOI:10.1007/s10549-012-2034-4 |
 2017, Vol. 44
2017, Vol. 44