文章信息
- 青少年颅骨孤立性浆细胞瘤1例报道
- One Case of Solitary Plasmacytoma of Skull Bone with Teenagers
- 肿瘤防治研究, 2017, 44(1): 79-80
- Cancer Research on Prevention and Treatment, 2017, 44(1): 79-80
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.01.017
- 收稿日期: 2016-05-18
- 修回日期: 2016-09-20
2. 071000 保定,保定市第一医院血液内科;
3. 071000 保定,河北大学医学部;
4. 073000 定州,定州市人民医院内科;
5. 071000 保定,保定市第三中心医院内科
2. Department of Hematology, The No.1 Hospital of Baoding, Baoding 071000, China;
3. Hebei University Health Science Center, Baoding 071000, China;
4. Department of Internal Medicine, The People's Hospital of Dingzhou City, Dingzhou 073000, China;
5. Department of Internal Medicine, The No.3 Central Hospital of Baoding, Baoding, 073000, China
浆细胞瘤是来源于骨髓的一种原发性和全身性的恶性肿瘤,起源于高度成熟的B淋巴细胞,具有向浆细胞分化的性质,包括多发性骨髓瘤(multiple myeloma, MM)、孤立性浆细胞瘤(solitary plasmacytoma, SP)、浆细胞性白血病(plasma cell leukemia, PCL)。孤立性浆细胞瘤在浆细胞肿瘤中不足10%[1]。可能与慢性刺激、病毒感染、感染抗原刺激相关,40岁以下者少见[1]。孤立性浆细胞瘤是单个肿瘤性病变,具有浆细胞瘤的组织学特征但没有全身性骨髓瘤的临床或放射学证据,部分患者可转化为多发性骨髓瘤[1]。颅骨浆细胞瘤通常是孤立性浆细胞瘤的一个亚型,而青少年颅骨浆细胞瘤国内外相关报道罕见。保定市第一医院收治1例12岁男性患者,现报道如下。
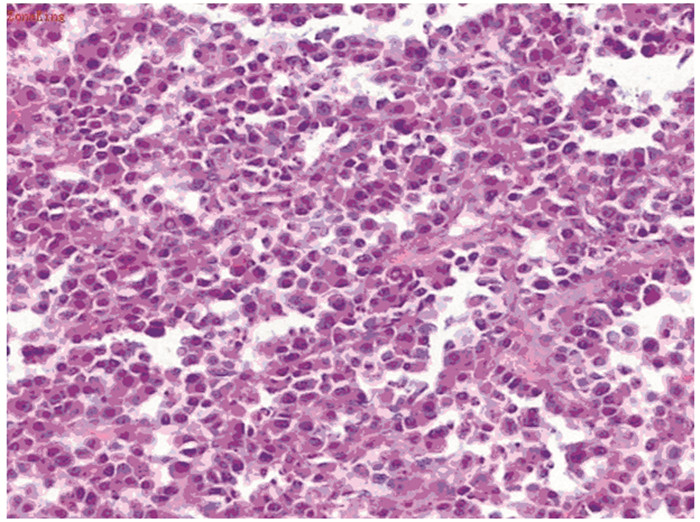
1 临床资料患者,男,12岁,学生,主因头部肿物进行性增大伴疼痛20余天于2015年5月10日入院。既往体健,其居住所在地居民多以毛皮印染及毛皮加工业为主,空气、土地及饮用水等污染严重。20余天前,患者无明显诱因出现额顶部两肿物,并进行性增大,伴有局部疼痛,发热一次,体温最高38.5℃,抗感染治疗无效,无其他骨骼及关节疼痛,后就诊于保定市第一医院。查体:体温36.5℃、神清、无贫血貌、皮肤黏膜无黄染、出血点,周身浅表淋巴结未触及肿大、胸骨无压痛、双肺呼吸音清、未闻及干湿罗音,心率86次/分,律齐、无杂音、腹部平软、无压痛、肝脾未及、双下肢无水肿。头左侧额顶部可见约4 cm×3 cm×4 cm大小肿物,枕部可见约3 cm×2 cm×0.5 cm大小肿物,均质韧、表面光滑、边界清、压痛明显、活动度差。患者入院后再次出现发热,体温最高至38.4℃,伴有头痛、恶心、呕吐,呕吐物为胃内容物,为非喷射性。血常规示,WBC 14.7×109/L,RBC 4.65×1012/L,Hb 124 g/L,PLT 534×109/L,N 69.9%,L 28.5%,β2微球蛋白2.5 μg/ml,免疫球蛋白定量IgG 11.5 g/L,IgA 2.3 g/L,IgM 1.8 g/L。血单克隆免疫球蛋白电泳未见M蛋白,尿本周蛋白尿阴性,肝肾功能正常,血沉15 mm/h,抗核抗体谱正常、肿瘤标志物正常。颈、胸、腰椎、骨盆等全身骨骼X线检查未见明显异常。头颅X片示,于左侧额顶部及枕部可见软组织肿块且局部可见颅板破坏、受侵,破坏区边缘较清,密度较均匀一致。核磁共振示,左侧额顶部头皮下及枕部可见新月状突向表面或不规则的等T1等T2信号影,临近颅板不连续,压水像亦呈等信号改变,扫及双侧大脑半球、小脑及脑干内未见明显异常,腰椎椎体及腰脊髓内未见明显异常改变。全身骨扫描示,左侧额顶部、枕部血运丰富、代谢旺盛灶。行头部肿物穿刺活检病理回报,考虑浆细胞瘤,见图 1。免疫组织化学:肿瘤细胞CD35、CD138、CD38、CD56、Mum-1、Lambda阳性,CD3、CD20、MPO阴性,Ki67约50%,见图 2。骨髓像检查示:骨髓增生活跃,粒系占58.5%、红系占22%,粒:红为2.66:1。粒系中性分叶核粒细胞比例增高,形态大致正常,余各阶段比值及形态未见明显异常。红系各阶段比例及形态未见明显异常。成熟红细胞形态未见明显异常。淋巴细胞占19.5%,形态大致正常。全片巨核细胞30个。血小板成堆可见。未见异常浆细胞。骨髓活检:HE及PAS染色示骨髓增生活跃(56%),粒红比例增大,粒系各阶段细胞可见,以中幼及以下阶段细胞为主,红系各阶段细胞可见,以中晚幼红细胞为主,巨核细胞可见,以分叶核为主。网状纤维染色0级,未见异常浆细胞浸润。综合上述检查,诊断为髓外浆细胞瘤。给予放疗1周期,30 Gy,4周,肿瘤较前有所缩小,后给予VAD化疗方案(长春新碱1.4 mg d1,阿霉素10 mg d1~4,地塞米松20 mg d1~4、9~12、17~20)治疗2周期,患者肿瘤进行性增大至10 cm×6 cm×9 cm,伴有局部疼痛及肿胀,家属放弃治疗,半年后患儿死亡。
|
| 图 1 颅骨孤立性浆细胞瘤(HE×400) Figure 1 Solitary plasmacytoma of skull bone (HE×400) |

|
| 图 2 颅骨孤立性浆细胞瘤CD138免疫组织化学染色(×400) Figure 2 CD138 immunohistochemical staining of solitary plasmacytoma of skull bone (×400) |
孤立性浆细胞瘤可发生于全身各个部位,研究报道不一致[2],普遍认为最高发的部位是头颈部,其次可见于喉、咽、甲状腺、腮腺、椎体及其他部位[3]。大多数发病缓慢,常在体检或检查其他疾病时发现。活检是唯一准确可靠的诊断依据,在影像学上缺乏特征性表现,计算机断层扫描,有助于发现骨破坏;磁共振成像有助于确定所述多个椎体病变或骨髓疾病[4]。孤立性浆细胞瘤发病原因目前没有肯定的结论,多倾向于病毒感染或慢性炎性反应刺激或某种原因造成的机体免疫功能抑制所致[4]。骨的孤立性浆细胞瘤一般病变较局限,多表现为由于骨质破坏造成的局部骨性肿块和疼痛,以及颅底神经血管受累症状,并无明显全身症状。本例患儿12岁,既往体健,无家族史,无病毒性感染及慢性炎性反应刺激史,但患儿居住地存在环境污染。本例患儿病史短,进展快,肿瘤侵袭性较强,并经病理及免疫组织化学证实。目前对于孤立性浆细胞瘤的治疗,首选放疗或放疗结合手术、化疗。手术治疗创伤大,术后各种并发症多,复发率高,一般情况下不提倡外科手术治疗,仅对于累及重要器官、危及生命的患者行手术治疗,单独化疗有效率低。孤立性浆细胞瘤的预后依赖于肿瘤体积、侵及部位及淋巴结受累情况等,肿瘤直径>5 cm、伴有淋巴结转移的患者预后不佳[5],其10年总生存期在70%左右[6]。死因主要为肿瘤的扩散、复发及转化为多发性骨髓瘤。除传统放化疗外,目前蛋白酶体抑制剂硼替佐米应用于多发性骨髓瘤,使患者生存期明显延长,并应用于孤立性浆细胞瘤患者[7],并取得了一定疗效,该患者因经济原因未予应用。目前尚有研究显示,部分中草药如青蒿琥酯等对多发性骨髓瘤治疗亦有一定疗效[8]。通过本病例说明,青少年型颅骨孤立性浆细胞瘤罕见,但发生后多预后不良,进展较快,对放化疗等敏感度差,预后欠佳,而是否所有青少年型颅骨孤立性浆细胞瘤均具有上述临床特点需要大样本进行综合分析。
| [1] | Tefferi A, Vardiman JW. Classification and diagnosis of myeloproliferative neoplasms: The 2008 World Health Organization criteria and point-of-care diagnostic algorithms[J]. Leukemia, 2008, 22 (1) : 14–22. DOI:10.1038/sj.leu.2404955 |
| [2] | Krishnamoorthy N, Bal MM, Ramadwar M, et al. A rare case of primary gastric plasmacytoma: an unforeseen surprise[J]. J Cancer Res Ther, 2010, 6 (4) : 549–51. DOI:10.4103/0973-1482.77067 |
| [3] | Wang J, Jing HM, Li M, et al. Clinical analysis and treatment of 14 multiple myeloma patients with extramedullary plasmacytoma[J]. Zhongguo Zhong Liu Lin Chuang, 2014, 41 (10) : 639–42. [ 王晶, 景红梅, 李敏, 等. 14例髓外浆细胞瘤患者的临床特征分析及治疗[J]. 中国肿瘤临床, 2014, 41 (10) : 639–42. ] |
| [4] | Warsame R, Gertz MA, Lacy MQ, et al. Trends and outcomes of modern staging of solitary plasmacytoma of bone[J]. Am J Hematol, 2012, 87 (7) : 647–51. DOI:10.1002/ajh.23201 |
| [5] | Lin L. New progress in extramedullary plasma cell tumor study[J]. Guo Ji Shu Xue Ji Xue Ye Xue Za Zhi, 2012, 35 (6) : 543–5. [ 林丽. 髓外浆细胞瘤研究的新进展[J]. 国际输血及血液学杂志, 2012, 35 (6) : 543–5. ] |
| [6] | Dores GM, Landgren O, Mcglynn KA, et al. Plasmacytoma of bone, extramedullary plasmacytoma, and multiple myeloma: incidence and survival in the United States, 1992-2004[J]. Br J Haematol, 2009, 144 (1) : 86–94. DOI:10.1111/bjh.2008.144.issue-1 |
| [7] | Katodritou E, Kartsios C, Gastari V, et al. Successful treatment of extramedullary gastric plasmacytoma with the combination of bortezomib and dexamethasone: First reported case[J]. Leuke Res, 2008, 32 (2) : 339–41. DOI:10.1016/j.leukres.2007.04.016 |
| [8] | Jiang HY, Yao AG, Jiang SF. Research progresses of artesunate in inducing tumor cell apoptosis[J]. Zhongguo Sheng Hua Yao Wu Za Zhi, 2014, 34 (6) : 181–3. [ 蒋红艳, 姚安贵, 江尚飞. 青蒿琥酯诱导肿瘤细胞凋亡的研究进展[J]. 中国生化药物杂志, 2014, 34 (6) : 181–3. ] |
 2017, Vol. 44
2017, Vol. 44


