文章信息
- 骨盆区域复发骨与软组织肿瘤手术加术中放疗的围手术期安全性评价
- Perioperative Security Evaluation of Intra-operative Radiotherapy for Recurrent Bone and Soft Tissue Sarcomas Around Pelvis
- 肿瘤防治研究, 2017, 44(1): 53-56
- Cancer Research on Prevention and Treatment, 2017, 44(1): 53-56
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.01.011
- 收稿日期: 2016-04-25
- 修回日期: 2016-10-31
2. 450008 郑州,郑州大学附属肿瘤医院,河南省肿瘤医院放疗科
2. Department of Radiotherapy, The Affiliated Cancer Hospital of Zhengzhou University, He'nan Cancer Hospital, Zhengzhou 450008, China
骨盆区域二次或多次复发的骨与软组织肿瘤治疗是目前临床工作的难点,由于骨盆的解剖学特点及骨与软组织肉瘤的浸润、转移特性,单纯手术治疗不能做到广泛的切除,局部复发率很高[1]。在新辅助化疗之外,常规术前放疗已成为手术治疗的主要辅助手段,并且一定程度上降低了术后局部复发率。多年来,术前放疗的应用虽然取得长足的进步,但由于射线照射面积大、剂量高,体外照射条件下常产生严重的并发症[2-3],严重影响了术前放疗的效果。
术中放疗(intra-operative radiation therapy, IORT)是一种在手术中直接对肿瘤组织和肿瘤切除后的可疑瘤床区域进行放射线单次大剂量照射,以最大限度的杀灭残存肿瘤细胞,并保护正常组织的放射治疗方法[4-6]。近年来研究[6-7]显示,IORT能降低骨与软组织肉瘤患者的局部复发率,并提高患者的生存率。
为了探讨IORT在骨盆复发性骨与软组织肿瘤治疗过程中的安全性,本课题组对郑州大学附属肿瘤医院住院化疗后分别行术前放疗联合手术和手术联合术中放疗的40例骨盆复发性骨与软组织肿瘤患者进行了术后的临床观察。
1 资料与方法 1.1 研究对象2014年5月至2015年5月间,在郑州大学附属肿瘤医院住院的骨盆复发性骨与软组织肉瘤患者为研究对象,将符合标准的研究对象按照入院时间排序,然后采用随机数字表法进行随机选取。纳入标准:(1)肿瘤再次或多次复发,且复发部位局限于骨盆单一区域的患者;(2)肿瘤病理类型均为对放疗较敏感的患者。排除标准:(1)病理证实肿瘤组织来源于淋巴造血系统、泌尿生殖系统;(2)术前CT和(或)MRI已发现肿瘤病变范围广泛,盆腔或腹膜后多处受累。按照纳入和排除标准共筛选出40例患者,将其分为两组:手术+IORT组(n=20),行骨盆肿瘤切除手术联合IORT;术前放疗+手术组(n=20),术前常规放疗后单纯行肿瘤切除手术。其中手术+IORT组(n=20),肿瘤病理类型分别为:乳腺癌髂骨转移6例、未分化多型性肉瘤(UPS)4例、横纹肌肉瘤3例、尤文氏肉瘤3例、脊索瘤2例、原始神经外胚层肿瘤(PNET)1例、肺癌髂骨转移1例。术前放疗+手术组(n=20),肿瘤病理类型分别为:UPS 5例、乳腺癌髂骨转移5例、脊索瘤3例、横纹肌肉瘤3例、尤文氏肉瘤2例、PNET 2例。经卡方检验,两组患者的肿瘤类型分布,差异无统计学意义。两组研究对象的外科手术切除边界均为边缘性切除,两组患者肿瘤切除的外科边界是一致的。
1.2 术前准备手术前向患者详细讲述手术及IORT的必要性,使患者积极配合治疗。指导患者合理膳食,增强体质。对我院可移动式术中肿瘤放射治疗机进行消毒处置,所有物体表面用1:200的84消毒液擦拭,紫外照射30 min以上,限光筒及挡铅块在专用消毒箱内用福尔马林熏蒸6~12 h,加速器机头消毒达到无菌手术要求标准。
1.3 手术过程全部入组患者均在IORT手术室进行手术,麻醉方式为全麻。
术前放疗+手术组患者为术前行全量或半量放疗患者,手术方式为:根据影像学检查所示行肿瘤区域的单纯肿瘤边缘切除手术。
手术+IORT组患者根据影像学检查所示行肿瘤区域的扩大切除手术后,暴露可疑瘤床范围的手术创面作为拟治疗位置,照射范围为瘤床外放3~5 cm,照射深度2~2.5 cm,把不需要照射的组织(如神经、血管、皮肤等)用铅块遮挡或缝合线牵拉于射野外。根据肿瘤区域可疑残余肿瘤组织情况,选择相应的加速器机头和治疗剂量,本组术中照射剂量为11~14 Gy,其中7例术中照射剂量为13 Gy,6例12 Gy,4例11 Gy,3例14 Gy。由控制系统确定照射时间,经物理师确认后,由外科手术医师将加速器机头通过承载系统锁定在拟治疗位置,照射部位以外覆以盐水纱垫保护正常软组织,全部准备工作完成后即可实施术中直接照射治疗。IORT的整个过程严格保持手术创面的无菌操作,严密监测患者的各项生命体征。两组患者手术结束后,均常规冲洗创腔、放置引流管并逐层关闭切口。
1.4 观察指标记录患者术后的手术时间、术中出血量,术后的血液生化白细胞计数、创腔引流量、切口感染、切口液化、住院天数、切口拆线时间,评估患者术后并发症如肠炎、膀胱炎的发生例数。血液生化白细胞计数方法为:分别记录术后第1天、第3天、第7天、第14天的数值,求平均值,用均数±标准差来表示。放射性直肠炎、膀胱炎的诊断标准参照2002年卫生部颁布实施的《中华人民共和国国家职业卫生标准》来评估。
1.5 统计学方法采用SPSS21.0进行统计分析,计量资料用(x±s)表示,两组间均数的比较采用双侧t检验,计数资料的比较采用Chi-Square检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者术中指标比较两组患者术中指标,如手术时间、术中出血量比较结果;手术+IORT组术中出血量多于术前放疗+手术组,差异有统计学意义(P < 0.05);而手术时间在两组间比较,差异无统计学意义(P > 0.05),见表 1。
 |
两组患者术后感染指标、手术+IORT组患者术后白细胞计数、术后创腔引流量、术后切口液化及切口感染的发生率与术前放疗+手术组患者比较,差异均无统计学意义(P > 0.05),见表 2。
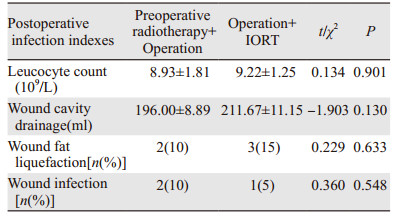 |
手术+IORT组患者住院时间和切口拆线时间与术前放疗+手术组患者相比,均显著缩短,差异均具有统计学意义(P < 0.05),见表 3。
 |
20例手术+IORT组患者术后仅有1例出现直肠、膀胱并发症,而术前放疗+手术组有6例出现此并发症,两组比较差异有统计学意义(P < 0.05),见表 4。
 |
骨与软组织肉瘤是一种临床表现和组织学表现多样化的恶性肿瘤,其虽在人群中的发病率相对较低,但恶性程度很高[8-9]。美国2013年癌症统计结果显示,在新增的1 660 290例癌症患者中,骨与软组织肉瘤大约14 420例,约占总发病人数的0.87%[9]。在过去的30年里,外科手术治疗是骨与软组织肿瘤主要的治疗手段,其中包含骨与软组织原发恶性肿瘤及转移性肿瘤[10]。骨盆部位分布着重要的血管和神经[11],解剖关系复杂且骨的形态不规则。因此,对于发生在此部位的骨与软组织恶性肿瘤很难进行根治性扩大切除,往往只能行边缘切除或是囊内切除,从而导致局部高复发的风险。
随着放疗技术的发展,术前放疗已成为治疗肿瘤的主要手段之一,尤其对软组织肉瘤及部分骨肿瘤的治疗,放疗已成为手术治疗的主要辅助手段,并且一定程度上降低了术后局部复发率[7]。但由于常规放疗放射线照射面积大、剂量高,体外照射条件下常产生严重的并发症,如皮肤、肌肉、骨关节的损伤,血管、神经的纤维化和放射性骨坏死等[3, 12],特别是骨盆部位直肠、膀胱的低耐受量,严重影响放疗的效果,并可能增加术后并发症的发生。
目前IORT已发展到匹配可移动式放疗系统。移动式放疗系统的独特性在于其使用灵活、精确、安全、无需对手术室进行特殊辐射防护改造,其产生的低能X射线通过适配器各向同性发射,直接对准肿瘤组织及肿瘤切除后的残余组织,进行单次大剂量照射,照射深度为1~2 cm,其生物学效应是体外照射的2~2.5倍,最大限度地杀死肿瘤细胞,照射范围以外辐射能量急速下降,使周围健康组织得到保护。
目前有研究报道IORT在骨与软组织肿瘤治疗中的远期疗效良好[7, 13],徐立斌等[8]和张宗春等[13]研究表明,应用手术联合IORT治疗骨与软组织肉瘤,能显著提高肿瘤局部控制率和患者的生存率,并具有一定的止痛效果。但手术联合IORT治疗骨与软组织肿瘤的早期安全性却少有报道。
本研究比较20例行手术联合IORT与20例行术前放疗联合手术治疗的骨与软组织患者术中指标、术后感染与并发症等早期临床疗效指标,结果显示手术联合IORT组患者出现术后直肠、膀胱并发症例数减少,术后住院时间与切口拆线时间明显缩短,说明手术联合IORT能够保护肿瘤切口组织,促进伤口恢复,并且行IORT后,可适当减少术后照射剂量,以减轻术后的放疗不良反应,也能促进患者进一步恢复。本文两组研究对象共发生直肠、膀胱并发症7例,其中手术+IORT组1例,仅出现术后尿急、尿频症状,评估为轻度(一级)放射性膀胱炎;术前放疗+手术组6例,其中2例出现术后尿急、尿频、尿痛等轻微症状,评估为轻度(一级)放射性膀胱炎,1例出现血尿,膀胱镜检发现膀胱三角区后壁黏膜水肿,评估为中度(二级)放射性膀胱炎,3例拉稀便但无明显虚弱表现,评估为轻度(一级)放射性直肠炎。判断该并发症的出现主要为放疗后直肠膀胱黏膜脆弱,手术应激促进症状出现所致。经规律使用止血敏、止血芳酸及奥硝唑等药物后症状缓解。
同时手术联合IORT组患者手术时间、术后白细胞计数、术后创腔引流量、术后切口感染、切口液化与术前放疗联合手术组患者比较,差异无统计学意义,提示虽进行术中放疗,但并没有过多延长手术时间;术中直接进行瘤床放射线照射,并未明显增加手术创口液化率及全身和局部的感染率,说明手术联合IOPT治疗骨与软组织肿瘤的临床安全性良好。
手术联合IORT组患者术中出血量略多于术前放疗联合手术组,可能是因为术前对于肿瘤区域的常规放疗,能够使局部水肿减轻,肿瘤组织内微血管闭塞,肿瘤血供减少,有助于分离及手术操作;虽然手术联合IORT组术中出血量略多,但是平均为946 ml,是骨盆外科手术能够接受的出血量,不会增加手术的相关风险。
综上所述,手术联合IORT治疗骨盆复发性骨与软组织肿瘤,具有术后易恢复、安全性好、常规放疗相关并发症少等优点,在临床应用中是安全可行的,值得在骨与软组织肉瘤的综合治疗中进一步推广。
| [1] | Farfalli GL, Albergo JI, Ritacco LE, et al. Oncologic and clinical outcomes in pelvic primary bone sarcomas treated with limb salvage surgery[J]. Musculoskelet Surg, 2015, 99 (3) : 237–42. DOI:10.1007/s12306-015-0379-7 |
| [2] | O'Sullivan B, Davis AM, Turcotte R, et al. Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: a randomised trial[J]. Lancet, 2002, 359 (9325) : 2235–41. DOI:10.1016/S0140-6736(02)09292-9 |
| [3] | Davis AM, O'Sullivan B, Turcotte R, et al. Late radiation morbidity following randomization to preoperative versus postoperative radiotherapy in extremity soft tissue sarcoma[J]. Radiother Oncol, 2005, 75 (1) : 48–53. DOI:10.1016/j.radonc.2004.12.020 |
| [4] | Roeder F, Timke C, Uhl M, et al. Aggressive local treatment containing intraoperative radiation therapy (IORT) for patients with isolated local recurrences of pancreatic cancer: a retrospective analysis[J]. BMC Cancer, 2012, 12 : 295. DOI:10.1186/1471-2407-12-295 |
| [5] | Roeder F, Goetz JM, Habl G, et al. Intraoperative Electron Radiation Therapy (IOERT) in the management of locally recurrent rectal cancer[J]. BMC Cancer, 2012, 12 : 592. DOI:10.1186/1471-2407-12-592 |
| [6] | Roeder F, Ulrich A, Habl G, et al. Clinical phase I/II trial to investigate preoperative dose-escalated intensity-modulated radiation therapy (IMRT) and intraoperative radiation therapy (IORT) in patients with retroperitoneal soft tissue sarcoma: interim analysis[J]. BMC Cancer, 2014, 14 : 617. DOI:10.1186/1471-2407-14-617 |
| [7] | Najafipour F, Hamouzadeh P, Arabloo J, et al. Safety, effectiveness and economic evaluation of intra-operative radiation therapy: a systematic review[J]. Med J Islam Repub Iran, 2015, 29 : 258. |
| [8] | Xu LB, Yu SJ, Feng QF, et al. Value of intraoperative electron radiation therapy in the treatment of malignant bone or soft tissue tumors around the joints[J]. Zhonghua Zhong Liu Za Zhi, 2012, 34 (12) : 923–6. [ 徐立斌, 于胜吉, 冯勤付, 等. 术中电子线放射治疗技术在肢体关节周围骨与软组织恶性肿瘤保肢手术中的应用[J]. 中华肿瘤杂志, 2012, 34 (12) : 923–6. ] |
| [9] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63 (1) : 11–30. DOI:10.3322/caac.v63.1 |
| [10] | Dolan RT, Butler JS, Wilson-MacDonald J, et al. Quality of Life and Surgical Outcomes After Soft-Tissue Reconstruction of Complex Oncologic Defects of the Spine and Sacrum[J]. J Bone Joint Surg Am, 2016, 98 (2) : 117–26. DOI:10.2106/JBJS.N.01353 |
| [11] | Sun YQ. The progression of treatment of pelvic injury using minimally invasive internal fixation[J]. Zhonghua Chuang Shang Za Zhi, 2013, 29 (8) : 736–8. [ 孙玉强. 微创内固定治疗骨盆损伤新进展[J]. 中华创伤杂志, 2013, 29 (8) : 736–8. ] |
| [12] | van Kampen M, Eble MJ, Lehnert T, et al. Correlation of intraoperatively irradiated volume and fibrosis in patients with soft-tissue sarcoma of the extremities[J]. Int J Radiat Oncol Biol Phys, 2001, 51 (1) : 94–9. DOI:10.1016/S0360-3016(01)01620-0 |
| [13] | Zhang ZC, Gao GX, Liu SL, et al. Clinicai study of surgical treatment combined with intraoperative radiotherapy for the patients with soft tissue sarcomas[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2007, 14 (23) : 1821–2. [ 张宗春, 高国香, 刘松龄, 等. 软组织肉瘤手术加术中放疗的临床研究[J]. 中华肿瘤防治杂志, 2007, 14 (23) : 1821–2. ] |
 2017, Vol. 44
2017, Vol. 44
