文章信息
- 调强放疗联合卡培他滨同步化疗及HIFU治疗非手术老年胰腺癌患者疗效观察
- Efficacy of IMRT Combined with Capecitabine Concurrent Chemotherapy and High Intensity Focused Ultrasound for Elderly Patients with Non-operatable Pancreatic Cancer
- 肿瘤防治研究, 2017, 44(1): 48-52
- Cancer Research on Prevention and Treatment, 2017, 44(1): 48-52
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.01.010
- 收稿日期: 2015-12-22
- 修回日期: 2016-07-31
2. 442000 十堰,湖北医药学院附属人民医院超声科
2. Department of Ultrasound, People's Hospital, Hubei Medical University, Shiyan 442000, China
胰腺癌恶性程度高,5年生存率约6%左右,手术切除是根治胰腺癌的唯一方式[1]。我国胰腺癌的发病率呈逐年上升的趋势,2/3患者大于65岁;由于胰腺解剖位置隐蔽,临床症状多不典型,就诊时多为中晚期,手术切除率仅为20%左右,另外40%为局部进展期、40%为晚期[2]。近半个世纪以来,外科治疗技术和肿瘤综合治疗水平取得了长足进步,但胰腺癌治疗进展缓慢,其生物学行为具有很强的侵袭性及各种治疗手段的效果欠佳,以致其生存期短,75%患者确诊后一年内死亡[3]。如何控制中晚期胰腺癌的进展、缓解患者临床症状、提高患者生活质量成为急需研究解决的问题。本研究对60例老年非手术胰腺癌患者采用前瞻性随机对照研究,比较调强放疗联合卡培他滨同步化疗及HIFU治疗与单纯调强放疗联合卡培他滨同步化疗治疗老年非手术胰腺癌患者的临床疗效和不良反应,评价其临床应用的可行性。
1 资料与方法 1.1 入组条件经影像及病理学诊断为胰腺癌的患者;无远处转移,TNM(AJCC 2010第七版)分期ⅡA~Ⅲ期;均初治患者;经肝胆胰腺外科会诊不能行根治性切除或患者受心肺功能及其他基础疾病影响不能耐受手术治疗或拒绝手术治疗的;年龄68~80岁;ECOG评分≤2分;既往无肿瘤病史或可能影响治疗完成的疾病;预期生存时间 > 3月;无放化疗禁忌证;患者知情同意并签署知情同意书。
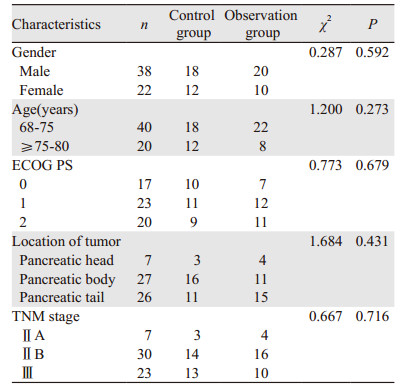
1.2 临床资料收集2010年9月1日-2013年9月1日十堰市人民医院诊治的胰腺癌患者60例。将患者按入院顺序以随机数字法分为对照组(30例)和观察组(30例),对照组行调强放疗联合卡培他滨同步化疗,观察组行调强放疗联合卡培他滨同步化疗及HIFU治疗,一般资料各项构成比差异无统计学意义(P > 0.05),见表 1。
采用Varian 600直线加速器6-MV X线IMRT技术行放射治疗。采用热塑网状体模及真空负压垫固定体位,所有患者均经静脉注射碘海醇造影剂动态扫描,3 mm层厚连续扫描,扫描时嘱患者平静呼吸,获取定位图像后在Eclipse计划系统内勾画出病灶及重要功能器官的轮廓。根据CT确定原发肿瘤大体肿瘤体积(gross tumor volume of primary tumor, GTVT);短径大于5 mm淋巴结定义为转移淋巴结,其大体肿瘤体积定义为转移淋巴结大体肿瘤体积(gross tumor volume of lymph node, GTVN)。因本组均为老年患者,部分患者合并心肺功能不全,故所有患者均未行淋巴引流区预防照射。计划靶区体积(planng target vomume, PTV)为GTV外放0.8cm。处方剂量:GTVT:4 500~6 400 cGy;GTVN:6 000~6 400 cGy;98%体积的剂量(PTVT和PTVN)≥目标剂量的95%,允许5%PTVT体积的剂量≥目标剂量的105%,允许3%PTVN的剂量≥目标剂量的110%。勾画肝脏、胃、小肠、脊髓、肾脏等重要危及器官,危及器官受照剂量不超过其耐受剂量。
1.4 化疗患者于放疗第一天开始,卡培他滨片(正大天晴制药公司提供,商品名首辅)800~1 000 mg/m2早晚饭后各口服一次,连续用药14天,休息7天行下一周期化疗,放疗结束后巩固化疗2~4周期。化疗前后检查血常规、肝肾功能及心电图,每周复查一次,并予止吐药减轻恶心呕吐症状。出现Ⅱ~Ⅳ度骨髓抑制予G-CSF(粒细胞集落刺激因子)支持。
1.5 HIFU治疗方案HIFU治疗设备为上海交大新地实业公司生产的HIFU-2001高强度聚焦超声肿瘤治疗系统(编号:国食药监械(准)字2004第3230631号)。主要治疗参数:超声波频率(1±0.05)MHZ,水介质中焦点处最大声强2000 W/cm2,焦域尺寸5 mm×5 mm×8 mm,最大有效治疗深度150 mm,焦点定位精度误差小于1.5 mm。治疗前行B型超声测定靶区至皮肤表面距离,并在皮肤标记肿瘤位置,治疗体位为俯卧位。在机载B型超声探头的监控下,将焦点移至肿瘤病灶最深处,圈定治疗区域,采用点累积治疗方式,通过治疗盆的位移,使焦点呈点点成线、线线成面、面面成体的方式覆盖治疗区域。HIFU治疗时的参数:单点发射70~100次,发射时间100~120 ms,间歇时间60~120 ms,治疗功率800~1600 W,列距、行距、层距分别不超过5 mm、5 mm、8 mm。必要时分层治疗,前后两次治疗必须重叠一层,或圈定靶区时必须重叠部分靶区,防止病灶漏靶。HIFU和IMRT同步治疗,5次/周,4~6周。
1.6 观察指标 1.6.1 疼痛缓解治疗前后对患者局部疼痛症状采用数字分级法打分,以治疗后疼痛减轻两个数字级别为有效。
1.6.2 近期疗效治疗结束后1月采用RECIST标准评价近期疗效,测量指标为肿瘤的最长径的总和。
1.6.3 近期不良反应按照美国放射治疗肿瘤协作组(radiation therapy oncology group,RTOG)对急性放射反应进行评价;化疗不良反应按照常见治疗不良反应(common terminology criteria adverse events v3.0,CTCAE)进行评价。
1.6.4 远期疗效所有入组病例在治疗结束后2年内至少每3月随访一次,生存大于2年至少每6月随访一次。随访内容包括肿瘤标志物CA199、胸部CT、全腹增强CT及腹部彩超等。评价以下指标:总生存率和无进展生存率。随访截至2015年9月1日,全部病例随访满2年,随访率100%。
1.7 统计学方法采用SPSS 18.0统计软件进行数据分析,临床资料比较采用χ2检验或Fisher精确检验;疼痛评分组内治疗前后比较采用配对T检验,组间比较采用Two-way ANOVA检验;近期疗效、不良反应按单向有序等级资料处理,之间比较采用Mann-Whitney U检验;生存率和无进展生存率采用Kaplan-Meier法计算,Log rank检验其差异,检验水准α=0.05。
2 结果 2.1 疼痛缓解情况对照组治疗后疼痛完全缓解(疼痛完全消失)0例,部分缓解(疼痛减轻在2个数字级别以上)12例,疼痛稳定(疼痛减轻在2个数字级别以下)13例,无效(疼痛加重)5例,疼痛缓解率为40%,治疗前疼痛评分为(5.3±2.246),治疗后疼痛评分为(4.133±1.676),对照组治疗前后疼痛缓解比较差异有统计学意义(P=0.001)。观察组治疗后疼痛完全缓解1例,部分缓解26例,疼痛稳定3例,无效0例,疼痛缓解率为90%,治疗前疼痛评分为(5.633±1.956),治疗后疼痛评分为(2.867±1.167),观察组治疗前后疼痛缓解比较差异有统计学意义(P < 0.0001)。对照组和观察组间治疗前后疼痛减轻程度比较差异有统计学意义(P=0.0162)。
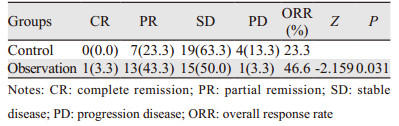
2.2 近期疗效对照组和观察组总有效率分别为23.3%和46.6%,组间比较差异有统计学意义(P < 0.05),见表 2。
 |
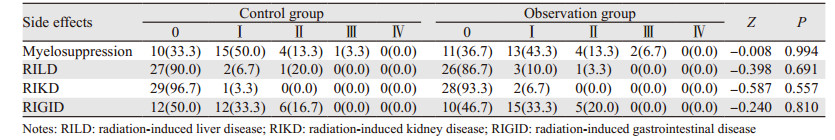
所有患者均可以评价不良反应,观察组和对照组在骨髓抑制、急性放射性肝损伤、急性放射性胃肠道损伤及急性放射性肾脏损伤不良反应发生率等方面比较差异无统计学意义,见表 3。观察组因行HIFU治疗有3例患者出现超声通路皮肤Ⅰ度烫伤;8例治疗过程中出现治疗区域轻微疼痛,调整治疗功率后缓解。
 |
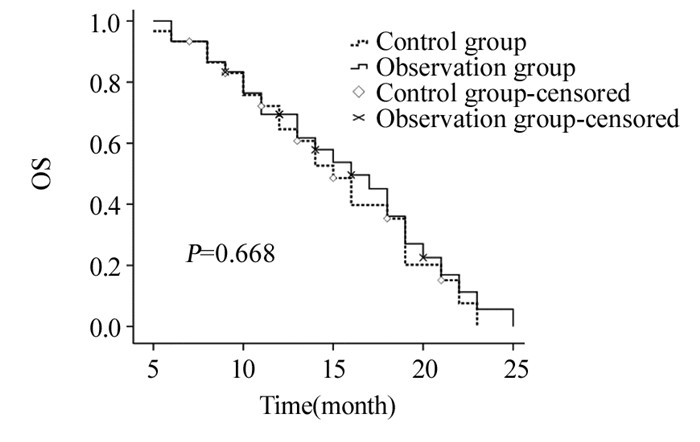
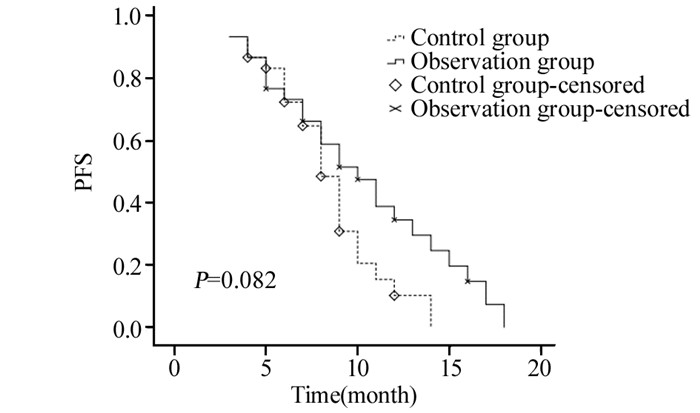
对照组和观察组1、2年总生存率分别为64.5%、0和69.4%、5.6%,中位生存时间为15月和16月,两组总生存率差异无统计学意义(χ2=0.184, P=0.668),见图 1。对照组和观察组1年无进展生存率为10.3%和34.6%,中位无进展生存时间为8月和10月,两组无进展生存率比较差异无统计学意义(χ2=3.016, P=0.082),见图 2。
|
| 图 1 两组胰腺癌患者总生存率的比较 Figure 1 Comparison of 1-, 2-year overall survival rates between two groups in pancreatic cancer patients |
|
| 图 2 两组胰腺癌患者进展生存率的比较 Figure 2 Comparison of 1-year progression-free survival rate between two groups in pancreatic cancer patients |
对照组失败23例,其中局部未控或复发19例(63.3%),远处转移20例(66.7%);观察组失败24例,其中局部未控或复发13例(43.3%),远处转移19例(63.3%)。两组病例的局部未控或复发率及远处转移率间差异均无统计学意义(χ2=0.465, P=0.495)。
3 讨论不能切除的局部进展期胰腺癌约占初诊患者的1/3,其中位生存期约9月[4]。本研究入组患者中88.3%为局部进展期。对于局部进展期胰腺癌的治疗目前尚存在争议,在美国多首先采用同步放化疗;基于GERCOR和FFCD/SFRO研究结果,在欧洲多先行2到3月化疗后,病情无进展再采用同步放化疗,其主要原因是局部进展期患者大部分在几月时间出现远处转移,这样可使短期内出现远处转移患者避免同步放化疗的不良反应,同时节约治疗费用[5]。NCCN指南推荐一线化疗方案包括吉西他滨、吉西他滨联合脂质体紫杉醇、吉西他滨联合卡培他滨或FOLFOXIRI,部分患者推荐行同步放化疗。同步放化疗时化疗药物可选用5-Fu、卡培他滨或吉西他滨,SCALOP研究比较吉西他滨或卡培他滨联合放疗治疗局部进展期胰腺癌,因吉西他滨同步放化疗不良反应较卡培他滨或5-Fu更大,推荐5-Fu或卡培他滨联合同步放疗[6]。卡培他滨为Fu前体药物,在体内经过一系列的酶促反应如胸苷磷酸化酶(TP)作用而活化,经二氢嘧啶脱氢酶(DPD)降解而灭活,有研究表明,胰腺癌组织中TP的含量平均为癌旁正常组织的74倍,TP/DPD比值也比正常胰腺组织明显升高,提示卡培他滨在胰腺癌组织中选择性活化,对治疗胰腺癌有一定的应用价值,且口服使用方便[7]。本组患者均为老年患者,各系统代偿功能较差,考虑到不良反应、患者耐受性及用药方便,本研究采用以卡培他滨为基础的同步放化疗。
HIFU较其他消融技术有如下优势:无创,无需经皮穿刺,无针道种植转移风险[8]。Wang等[9]应用HIFU治疗无法手术晚期胰腺癌患者,疼痛缓解率与本研究观察组(87.5% vs.90%)相近,中位生存期(8月vs.16月)及1年生存率(30.1% vs.69.4%)较本研究观察组低,考虑与上述研究入组患者中部分为Ⅳ期,且本研究采用多种治疗联合的综合治疗模式有关。Zhao等[10]应用HIFU联合吉西他滨同步化疗治疗局部进展期胰腺癌,中位生存时间12.6月,疼痛缓解率78%,长期生存本研究观察组较上述研究略高(16月vs.12.6月),疼痛缓解率更高(90% vs.78%),考虑与本研究观察组采用同步放化疗联合HIFU三种治疗方式有关,治疗强度较上述研究更大;不良反应方面本研究骨髓抑制发生率更高(63.3% vs.21%),考虑与本研究采用同步放化疗,且入组多为老年患者,骨髓储备功能较差有关。HIFU的热效应可以提高细胞膜的通透性,利于化疗药物的渗透吸收,并阻止肿瘤细胞对化疗药物或放射损伤的修复,HIFU联合放化疗是一种安全有效的治疗方案[11]。
Wang等[3]对IMRT治疗局部进展或转移胰腺癌进行回顾性分析,63例患者中36例采用单纯放疗,27例采用同步放化疗,同步化疗药物包括吉西他滨、卡培他滨,中位处方剂量46 Gy,中位生存时间同步放化疗组与单纯放疗组分别为16月和7.4月。LAP-07研究[12]对局部晚期胰腺癌患者行4周期吉西他滨诱导化疗后再行卡培他滨同步放化疗,中位生存时间分别为15.2月。上述两个研究与本研究对照组(15月)和观察组(16月)中位生存时间相近。本研究观察组在疼痛缓解及近期疗效上明显优于对照组,考虑与观察组HIFU治疗有关;但两组在长期生存上差异无统计学意义。从失败模式上看,局部控制观察组优于对照组,但两组远处转移比例均较大,是影响患者长期生存的重要因素。
上述国内外临床研究多为HIFU或放疗联合同步化疗治疗治疗局部晚期胰腺癌,HIFU联合放疗尚无报道。因肿瘤中央区域血供较差,乏氧细胞较多,放射敏感度欠佳,但行HIFU治疗时能量容易沉积,疗效更好;肿瘤周围区域血供相对丰富,乏氧细胞较少,放疗敏感,但HIFU治疗时能量沉积困难,疗效欠佳。同时当病灶靠近肋骨、膈顶或胃肠道时,因肋骨遮挡超声不能穿透或因气体导致超声散射时疗效欠佳;但放射线穿透性强,不会受肋骨或气体干扰。因此,IMRT和HIFU联合应用可起到扬长避短、优势互补的作用[13]。
综上所述,调强放疗联合卡培他滨同步化疗及HIFU治疗老年非手术胰腺癌可缓解患者疼痛,提高生活质量,近期疗效确切,但未延长患者长期生存。因此,联合治疗后辅助何种化疗方案或靶向治疗能否降低远处转移及延长生存,尚需进一步研究。
| [1] | Herman JM, Chang DT, Goodman KA, et al. Phase 2 multi-institutional trial evaluating gemcitabine and stereotacticbody radiotherapy for patients with locally advanced unresectable pancreatic adenocarcinoma[J]. Cancer, 2015, 121 (7) : 1128–37. DOI:10.1002/cncr.v121.7 |
| [2] | Zhao H. Non-invasive technology in treatment of pancreatic cancer: high intensity focused ultrasound therapy[J]. Shanghai Yi Yao, 2014, 35 (8) : 8–11. [ 赵洪. 胰腺癌的局部微无创治疗-高强度聚焦超声[J]. 上海医药, 2014, 35 (8) : 8–11. ] |
| [3] | Wang Z, Ren ZG, Ma NY, et al. Intensity modulated radiotherapy for locally advanced and metastatic pancreatic cancer: a mono-institutional retrospective analysis[J]. Radiat Oncol, 2015, 10 : 14. DOI:10.1186/s13014-014-0312-5 |
| [4] | Li ZC, Zhou Y, Luo SQ. Clinical Analysis of Multimodality Treatments for Pancreatic Cancer Patients with Liver Metastases[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42 (2) : 154–8. [ 李泽朝, 周勇, 罗诗樵. 胰腺癌肝转移患者多学科综合治疗临床分析[J]. 肿瘤防治研究, 2015, 42 (2) : 154–8. ] |
| [5] | Cascinu S. Locally advanced versus metastatic pancreatic cancer: two different diseases with two different treatment approaches?[J]. Chin Clin Oncol, 2013, 2 (3) : 26. |
| [6] | Mukherjee S, Hurt CN, Bridgewater J, et al. Gemcitabine-based or capecitabine-based chemoradiotherapy for locally advanced pancreatic cancer (SCALOP): a multicentre, randomised, phase 2 trial[J]. Lancet Oncol, 2013, 14 (4) : 317–26. DOI:10.1016/S1470-2045(13)70021-4 |
| [7] | Shi SB, Ma TH, Tang XY, et al. Effect of second-line treatment with capecitabine and thalidomide in patients with advanced pancreatic cancer[J]. Zhonghua Zhong Liu Za Zhi, 2013, 35 (4) : 301–4. [ 时圣彬, 马廷行, 唐晓勇, 等. 卡培他滨联合沙利度胺二线治疗晚期胰腺癌的疗效观察[J]. 中华肿瘤杂志, 2013, 35 (4) : 301–4. ] |
| [8] | Zhou Y. High-intensity focused ultrasound treatment for advanced pancreatic cancer[J]. Gastroenterol Res Pract, 2014 : 205325. |
| [9] | Wang K, Chen Z, Meng Z, et al. Analgesic effect of high intensity focused ultrasound therapy for unresectable pancreatic cancer[J]. Int J Hyperthermia, 2011, 27 (2) : 101–7. DOI:10.3109/02656736.2010.525588 |
| [10] | Zhao H, Yang G, Wang D, et al. Concurrent gemcitabine and high-intensity focused ultrasound therapy in patients with locally advanced pancreatic cancer[J]. Anticancer Drugs, 2010, 21 (4) : 447–52. DOI:10.1097/CAD.0b013e32833641a7 |
| [11] | Keane MG, Bramis K, Pereira SP, et al. Systematic review of novel ablative methods in locally advanced pancreatic cancer[J]. World J Gastroenterol, 2014, 20 (9) : 2267–78. DOI:10.3748/wjg.v20.i9.2267 |
| [12] | Hammel P, Huguet F, Van Laethem JL, et al. Comparison of chemoradiotherapy (CRT) and chemotherapy (CT) in patients with locally advanced pancreatic cancer (LAPC) controlled after 4 months of gemcitabine with or without erlotinib: Final results of the international phase III LAP 07 study[J]. Pancreatology, 2013, 13 (3) : S89. |
| [13] | Li D, Kang J, Golas BJ, et al. Minimally invasive local therapies for liver cancer[J]. Cancer Biol Med, 2014, 11 (4) : 217–36. |
 2017, Vol. 44
2017, Vol. 44