文章信息
- FOXP3在乳腺癌细胞中表达的研究进展
- Progress on FOXP3 Expression in Breast Cancer cells
- 肿瘤防治研究, 2016, 43(12): 1076-1080
- Cancer Research on Prevention and Treatment, 2016, 43(12): 1076-1080
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.12.014
- 收稿日期: 2016-07-04
- 修回日期: 2016-09-20
2. 050011石家庄,河北医科大学第一医院血管外科
2. Department of Vascular Surgery, The First Hospital of Hebei Medical University, Shijiazhuang 050011, China
FOXP3(Forkhead box protein 3)作为叉头/翼状螺旋转录因子家族成员之一,在自身免疫、器官移植、感染等疾病中发挥着巨大作用。近些年来研究发现FOXP3不仅仅表达于CD4+CD25+调节性T细胞(Treg),在正常上皮细胞及多种肿瘤细胞中均有表达,影响肿瘤的发生、发展[1],本文就其在乳腺癌方面的相关研究进展作一综述。
1 FOXP3简介人类FOXP3基因位于Xq11.23,包含11个外显子和10个内含子,其编码的FOXP3蛋白由431个氨基酸组成,相对分子质量为47.25 kD,结构包括4部分:N末端富含脯氨酸的转录调节区、锌指蛋白区、亮氨酸拉链区和C末端高度保守的DNA结合区即翼状/螺旋叉头区(forkhead domain, FKH)。各部分功能如下:FKH结构域促进FOXP3蛋白的入核及与靶基因启动子的结合;亮氨酸拉链结构域介导与其他转录因子形成转录复合物;N端脯氨酸富集区则在调节靶基因的转录中发挥主要的调节作用。FOXP3蛋白的FKH结构域约含110个氨基酸,核心部分由3个α螺旋依次排列组成,两侧通过β链连接了两个称之为“翼”的环状结构,这种“螺旋-转角-螺旋”的三级结构类似于蝴蝶形状,“翼状螺旋转录因子家族”也因此得名[2]。
2 FOXP3在乳腺癌细胞中的表达及意义 2.1 FOXP3在乳腺癌细胞中的表达部位FOXP3作为一种转录因子在细胞质内合成后被转运到细胞核中发挥转录调控作用,其在淋巴细胞中的主要表达部位是细胞核,但在乳腺癌细胞中FOXP3的表达部位存在差异,最常见的表达部位为细胞质,其次为细胞质与细胞核均表达,少数为仅细胞核表达[1]。影响其定位的因素如下:FOXP3基因(包括FKH区域即DNA结合区中核定位序列即NLS区域)的突变、缺失及翻译后修饰、剪接异构均会导致FOXP3无法转运到细胞核,继而定位于细胞质[3] ;多种转录调节因子间相互作用亦影响FOXP3的定位[4]:如TCR活化介导的转录后模式、HSP70可促进FOXP3成熟并转运到细胞核内与DNA相互作用[5]。不同的细胞内表达部位可能具有不同的功能,一些临床前研究显示未定位至细胞核的FOXP3可能丧失抑癌作用,从而促进肿瘤形成[6]。而Merlo等[7]的研究显示FOXP3在胞质表达与胞核表达具有相似的预后意义。FOXP3在细胞内表达部位的差异是否可反映不同的基因翻译后修饰模式以及是否影响乳腺癌的发病及预后,这些问题仍需要进一步的阐明。
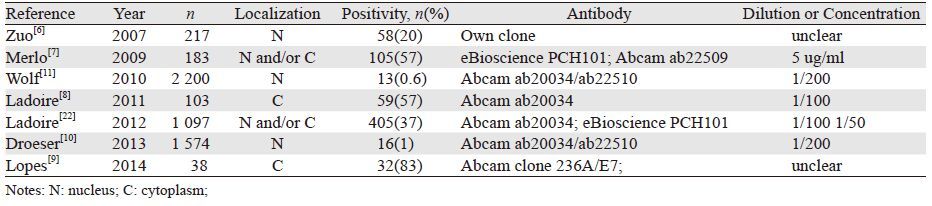
2.2 FOXP3在乳腺癌细胞中的表达程度各项研究显示FOXP3在乳腺癌细胞中的表达程度是不一的。Zuo等[6]考虑FOXP3作为转录因子参与HER2原癌基因的转录调节过程应在细胞核内完成,因而仅将胞核阳性定义为表达阳性,检测到FOXP3在乳腺癌细胞核表达率为20%,低于正常乳腺组织上皮细胞核表达率(80%)。Merlo等[7]报道了Milan 3和Milan 1实验中乳腺癌组织的FOXP3表达率分别占到57%和73%,且细胞内表达部位存在异质性,表现为细胞质为主的表达、细胞质与细胞核均表达或仅细胞核表达。随着研究的进展,Ladoire等[8]检测HER2阳性型乳腺癌细胞质中FOXP3表达率占57%,Lopes等[9]报道了三阴性乳腺癌(triple negative breast cancer, TNBC)细胞质中FOXP3表达率高达83%。FOXP3在TNBC中的表达率高于HER2阳性型乳腺癌,分析可能与FOXP3下调HER2原癌基因相关,表明FOXP3的表达程度可能与分子亚型有关。各项研究中FOXP3的表达率不尽相同,亦有研究几乎未检测到阳性表达。Droeser等[10]在5种乳腺癌细胞系(ZR75-1, MCF7-WH, BT20, T47D, SKBR3)及乳腺癌组织中均未发现有意义的表达水平,胞核表达率仅1%。Wolf 等[11]也报道了更低的胞核表达率(0.6%)。各研究的FOXP3表达率不同可能与判断表达阳性的评价标准、使用的抗体浓度及抗原修复时间不同有关,见表 1。
 |
FOXP3在肿瘤细胞中可上调、下调多个基因发挥转录激活或抑制的双重作用[12]。但FOXP3是直接影响肿瘤形成,还是通过激活沉默基因发挥作用,从而影响乳腺癌发生、发展及其临床预后价值,仍需进一步研究。
2.3.1 FOXP3的相关体外实验越来越多的体外实验认为FOXP3在乳腺癌中发挥抑癌作用,可通过直接与原癌基因及miR-146a启动子结合,抑制转录和翻译[13]。临床前研究显示乳腺上皮细胞的FOXP3表达缺失将导致肿瘤形成[1],而FOXP3过表达细胞的生长及转移受到抑制[14]。体外实验转染FOXP3 cDNA至MCF-7细胞系后,促进了细胞凋亡,抑制了细胞生长,继而抑制肿瘤形成[15]。
FOXP3在体外发挥抑癌作用的潜在机制可能是:FOXP3作为转录因子调控多种基因的表达,参与多条信号转导通路影响肿瘤的发生发展。Zuo等[6]的研究发现表达在正常乳腺上皮细胞的野生型FOXP3可以抑制HER2、SKP2这两个原癌基因的转录,而肿瘤细胞中的突变型FOXP3并无此作用。SATB1是参与乳腺癌上皮间充质转化(epithelial-mesenchymal transitions, EMT)及转移的一个原癌基因,McInnes等[16]在BT549乳腺癌细胞系中发现,FOXP3可以通过直接与启动子结合抑制SATB1基因表达或是通过产生两个miRs (miR-7及miR-155)来沉默该基因,从而发挥抑癌作用。p21抑癌基因可将细胞阻滞在细胞增殖周期的G1期,FOXP3可通过阻止组蛋白去乙酰酶(HDAC2和HDAC4)结合至p21启动子,增加H3乙酰化,使其活化,从而诱导p21抑癌基因的表达[15]。LATS2及Yes相关蛋白(Yes associated protein, YAP)是参与Hippo通路中调节细胞增殖和凋亡的效应分子,FOXP3可直接诱导LATS2抑癌基因的表达继而导致YAP蛋白分子泛素化降解,抑制细胞增殖、诱导细胞凋亡[17] 。FOXP3亦可以与其他转录因子相互作用,共同发挥转录调控功能。Recouvreux等[18]首次发现Runx1作为转录因子促进乳腺癌细胞系Rspo3(R-spondin 3)原癌基因的表达、抑制GJA1(gap junction protein alpha 1)抑癌基因的表达,与不良预后相关,而FOXP3可抑制Runx1基因的转录,继而抑制Runx1基因发挥促癌作用。亦有研究认为FOXP3与p53相互作用调控细胞周期[19]。
最近Zhang等[14]在体外实验通过双荧光素酶报告基因、染色质免疫沉淀分析(CHIP)和电泳迁移率实验(EMSA),判定细胞黏附分子CD44也是FOXP3的直接靶标,FOXP3可通过下调CD44的表达来抑制乳腺癌细胞的黏附、侵袭、转移。因而,FOXP3-CD44信号通路可望成为抑制乳腺癌转移的治疗靶点。IRAK1及TRAF6是参与Toll样受体4(toll like receptors 4, TLR4)/NF-κB信号转导通路中重要的蛋白分子,TLR4主要通过释放炎性因子和免疫抑制因子参与肿瘤的免疫耐受,促进免疫逃逸。体外实验发现FOXP3诱导产生的miR-146a/b可通过下调IRAK1靶基因、TRAF6靶基因来下调NF-κB活性,也可以通过直接作用于NF-κB亚组p65产生miR-146a-NF-κB负反馈调节,阻断TLR4/NF-κB信号通路,继而降低细胞增殖、迁移,促进细胞凋亡,发挥抑癌作用。miR-146a-NF-κB轴的发现为FOXP3缺陷相关肿瘤提供了新的治疗方法[20]。FOXP3可能通过以上所述机制参与信号转导通路中抑制乳腺癌细胞系的生长、迁移、黏附过程,发挥抑癌作用。
2.3.2 FOXP3的相关临床研究Ladoire等[8]检测了103例接受过新辅助化疗的HER2阳性型乳腺癌组织中FOXP3的表达情况,结果显示胞质表达的FOXP3预示着更好的无复发生存率及总生存率(overall survival, OS),与临床病理特征无关。而Nair等[21]发现FOXP3高表达的TNBC及ER阳性型乳腺癌患者的复发风险更高。推理FOXP3通过抑制HER2这个原癌基因的信号转导通路来发挥抑癌作用。FOXP3表达在乳腺癌的意义可能与分子亚型相关,在HER2阳性型中是一个反映预后良好的指标,在其他类型中可能代表预后不良。随后,Ladoire等[22]又报道了在PACS01试验中1 097名接受过蒽环类新辅助化疗的患者中,FOXP3表达阳性者获得了生存率改善(P=0.003),且与分子分型无关。另外他们认为FOXP3也可能影响化疗敏感度,基因缺失可能会导致细胞对DNA损伤类化疗药物的耐药,继而推断FOXP3可能是一个精确预测蒽环类化疗药敏感度的生物学指标。
然而越来越多的临床试验数据显示,在乳腺癌细胞中FOXP3的表达与预后不良相关,促进肿瘤发生远处转移。Merlo等[7]报道了乳腺癌细胞中FOXP3表达与较差的OS相关,与其在细胞内表达部位无关,且这种关联随其表达强度的增加而增加,尤其是在淋巴结转移阴性患者中。该研究显示FOXP3是无远处转移生存(distant metastases-free survival, DMFS)及OS的有力预后因素,但无法预测局部复发风险,而且该研究中多因素分析显示FOXP3是与淋巴结转移状态具有相似预后价值的一项独立预后因素。
研究亦表明FOXP3表达的乳腺癌更容易发生淋巴结转移[7]。Kim等[23]报道淋巴结转移阳性的乳腺癌患者FOXP3高表达代表着更差的无病生存(disease-free survival, DFS)及疾病特异性生存(disease specific survival, DSS),且Logistic回归模型分析显示FOXP3与高Ki-67表达具有相关性,暗示FOXP3阳性肿瘤具有高增殖能力。表明FOXP3过表达是淋巴结阳性乳腺癌患者复发及预后的重要预测因子。
分析其导致临床预后不良的机制探讨有:Triulzi等[1]认为FOXP3可诱导与肿瘤侵袭、转移相关的基因表达,如TGF-β信号通路、EMT过程相关基因(TGFBR2-3, TGFB2, SNAIL, TWIST1, ID1, ID2, ID3)及焦点粘连相关基因(ITGA6-A3-AV, PDGFC, LAMC1-2)。亦有文献报道FOXP3可上调肿瘤细胞TGF-β1的表达,继而促进EMT,促进肿瘤的进展和转移[24-25]。Zhang等[14]认为在正常乳腺上皮细胞中存在野生型FOXP3的表达,而在乳腺癌细胞中FOXP3低表达甚至缺失。FOXP3在乳腺癌中表达水平的下降导致了多种乳腺癌相关癌基因的表达调控异常,进而促进了乳腺癌的发生发展。亦有研究认为FOXP3可模仿免疫逃逸机制,发挥类Treg样的免疫抑制作用[25]。FOXP3亦可能通过信号转导和转录活化因子(signal transducer and activator of transcription 3, STAT3)等分子建立肿瘤细胞与周围免疫微环境之间的联系,提高免疫抑制分子活性、刺激Treg分化,从而产生肿瘤相关免疫逃逸[26]。但Merlo等[7]分析FOXP3与生存期相关,但与局部复发无关,因此认为FOXP3可能与转移过程相关,并非依靠抑制局部免疫反应产生免疫逃逸。CCR7和CXCR4是在肿瘤侵袭、转移过程中发挥重要作用的两个趋化因子受体,FOXP3可通过上调这两个趋化因子受体的转录水平影响肿瘤的转移和预后[7, 27]。
2.3.3 FOXP3相关研究间的差异与矛盾体外实验显示FOXP3的抑癌作用,而多数临床研究发现乳腺癌细胞中FOXP3表达与预后不良相关,针对这种矛盾存在多种解释:Takenak[28]等的研究显示FOXP3在乳腺癌中的预后意义与其细胞内表达部位有关,胞质表达与预后不良相关(P=0.058),而胞核表达却可获得OS获益(P=0.016)。分析由于FKH区突变、缺失或是转录后修饰的影响,FOXP3未能定位到细胞核内,而表达在细胞质中的FOXP3可能因丧失了抑癌作用而促进肿瘤形成,即不同的表达部位具有不同的生物活性及预后价值。体外实验中野生型FOXP3与乳腺癌组织中突变型FOXP3作用不同似乎可以佐证这种假设。但阐明FOXP3在肿瘤细胞中不同的表达部位是否具有不同的预后价值及胞质表达发挥促癌作用等问题还需要更多的研究完善。
FOXP3也可能具备促癌和抑癌的双重作用,既可以通过降低细胞增殖来改善预后,也可以通过促进EMT过程及转移肿瘤细胞的存活来促进肿瘤进展和转移。这一点在小鼠模型中也得到验证,FOXP3在肿瘤早期阶段发挥抑制增殖作用,在后期肿瘤微环境的改变可能导致抗增殖能力受损而发挥促转移作用[1]。
这种矛盾也可能与种族、遗传背景、疾病分期、治疗方式等差异相关。Lin等[29]在2015年针对16项试验共13 217例患者进行了荟萃分析,因为显著的异质性,这项Meta分析并未显示出FOXP3高表达水平与DFS、OS显著相关,认为FOXP3表达在乳腺癌中的预后意义与其细胞内表达部位、阳性表达的判断标准、激素受体状态及地域差异相关,即可能受不同的遗传背景、手术方式及化疗方案等因素影响。分析结果显示在ER阳性组、亚洲地区、以中位数作为判断表达阳性的cut-off值这三种情况下,FOXP3表达与DFS及OS获益显著相关,表达量超过cut-off值导致预后不良。正如最近的研究表明不同激素受体状态的乳腺癌具有不同的CD8+淋巴细胞数目,即激素受体状态影响免疫应答,继而影响FOXP3的临床预后作用[30]。
3 结语乳腺癌是女性最常见的恶性肿瘤之一,亦是一种多基因疾病。FOXP3作为Treg最特异的分子标志,近些年来发现在正常上皮细胞及多种肿瘤细胞中均有表达,影响肿瘤发生、发展,继而成为肿瘤信号转导网络中的新晋分子。但FOXP3在乳腺癌细胞中的表达及意义仍存在争议。临床前研究认为FOXP3作为抑癌基因抑制肿瘤细胞增殖,但临床研究大多显示乳腺癌组织表达FOXP3与预后不良相关,可能与基因突变、缺失、翻译后修饰或是基因启动子区CpG岛异常甲基化等表观遗传学修饰等机制相关,后续可通过基因全编码序列的突变检测、基因启动子区CpG岛甲基化状态检测、基因敲除等研究技术进行深入探讨。阐明FOXP3在乳腺癌中的作用及分子机制还需更多的体内、体外实验研究,FOXP3有望成为一个新的分子标志物及治疗靶点。
| [1] | Triulzi T, Tagliabue E, Balsari A, et al. FOXP3 expression in tumor cells and implications for cancer progression[J]. J Cell Physiol, 2013, 228 (1) : 30–5. DOI:10.1002/jcp.24125 |
| [2] | Martin F, Ladoire S, Mignot G, et al. Human FOXP3 and cancer[J]. Oncogene, 2010, 29 (29) : 4121–9. DOI:10.1038/onc.2010.174 |
| [3] | Hancock WW, Ozkaynak E. Three distinct domains contribute to nuclear transport of murine Foxp3[J]. PLoS One, 2009, 4 (11) : e7890. DOI:10.1371/journal.pone.0007890 |
| [4] | Lam EW, Brosens JJ, Gomes AR, et al. Forkhead box proteins: tuning forks for transcriptional harmony[J]. Nat Rev Cancer, 2013, 13 (7) : 482–95. DOI:10.1038/nrc3539 |
| [5] | Wachstein J, Tischer S, Figueiredo C, et al. HSP70 enhances immunosuppressive function of CD4(+)CD25(+)FoxP3(+) T regulatory cells and cytotoxicity in CD4(+)CD25(-) T cells[J]. PLoS One, 2012, 7 (12) : e51747. DOI:10.1371/journal.pone.0051747 |
| [6] | Zuo T, Wang L, Morrison C, et al. FOXP3 is an X-linked breast cancer suppressor gene and an important repressor of the HER-2/ErbB2 oncogene[J]. Cell, 2007, 129 (7) : 1275–86. DOI:10.1016/j.cell.2007.04.034 |
| [7] | Merlo A, Casalini P, Carcangiu ML, et al. FOXP3 expression and overall survival in breast cancer[J]. J Clin Oncol, 2009, 27 (11) : 1746–52. DOI:10.1200/JCO.2008.17.9036 |
| [8] | Ladoire S, Arnould L, Mignot G, et al. Presence of Foxp3 expression in tumor cells predicts better survival in HER2-overexpressing breast cancer patients treated with neoadjuvant chemotherapy[J]. Breast Cancer Res Treat, 2011, 125 (1) : 65–72. DOI:10.1007/s10549-010-0831-1 |
| [9] | Lopes LF, Guembarovski RL, Guembarovski AL, et al. FOXP3 transcription factor: a candidate marker for susceptibility and prognosis in triple negative breast cancer[J]. Biomed Res Int, 2014, 2014 : 341654. |
| [10] | Droeser RA, Obermann EC, Wolf AM, et al. Negligible nuclear FOXP3 expression in breast cancer epithelial cells compared with FOXP3-positive T cells[J]. Clin Breast Cancer, 2013, 13 (4) : 264–70. DOI:10.1016/j.clbc.2013.02.009 |
| [11] | Wolf D, Wolf AM, Tzankov A. Comment on “Cutting edge: depletion of Foxp3+ cells leads to induction of autoimmunity by specific ablation of regulatory T cells in genetically targeted mice”[J]. J Immunol, 2010, 184 (8) : 4051. |
| [12] | Katoh H, Zheng P, Liu Y. Signalling through FOXP3 as an X-linked tumor suppressor[J]. Int J Biochem Cell Biol, 2010, 42 (11) : 1784–7. DOI:10.1016/j.biocel.2010.07.015 |
| [13] | Liu R, Liu C, Chen D, et al. Foxp3 controls an miR-146/NF-κB negative feedback loop that inhibits apoptosis in breast cancer cells[J]. Cancer Res, 2015, 75 (8) : 1703–13. DOI:10.1158/0008-5472.CAN-14-2108 |
| [14] | Zhang C, Xu Y, Hao Q, et al. FOXP3 suppresses breast cancer metastasis through downregulation of CD44[J]. Int J Cancer, 2015, 137 (6) : 1279–90. DOI:10.1002/ijc.29482 |
| [15] | Liu R, Wang L, Chen G, et al. FOXP3 up-regulates p21 expression by site-specific inhibition of histone deacetylase 2/histone deacetylase 4 association to the locus[J]. Cancer Res, 2009, 69 (6) : 2252–9. DOI:10.1158/0008-5472.CAN-08-3717 |
| [16] | McInnes N, Sadlon TJ, Brown CY, et al. FOXP3 and FOXP3-regulated microRNAs suppress SATB1 in breast cancer cells[J]. Oncogene, 2012, 31 (8) : 1045–54. DOI:10.1038/onc.2011.293 |
| [17] | Li W, Wang L, Katoh H, et al. Identification of a tumor suppressor relay between the FOXP3 and the Hippo pathways in breast and prostate cancers[J]. Cancer Res, 2011, 71 (6) : 2162–71. DOI:10.1158/0008-5472.CAN-10-3268 |
| [18] | Recouvreux MS, Grasso EN, Echeverria PC, et al. RUNX1 and FOXP3 interplay regulates expression of breast cancer related genes[J]. Oncotarget, 2016, 7 (6) : 6552–65. |
| [19] | Won K Y, Kim H S, Sung J Y, et al. Tumoral FOXP3 has potential oncogenic function in conjunction with the p53 tumor suppressor protein and infiltrated Tregs in human breast carcinomas[J]. Pathol Res Pract, 2013, 209 (12) : 767–73. DOI:10.1016/j.prp.2013.08.010 |
| [20] | Etikala DM, Liu R, Wang L. FOXP3-microRNA-146-NF-kappaB as oncotarget[J]. Oncoscience, 2015, 2 (10) : 839–40. |
| [21] | Nair S, Aldrich AJ, Mcdonnell E, et al. Immunologic targeting of FOXP3 in inflammatory breast cancer cells[J]. PLoS One, 2013, 8 (1) : e53150. DOI:10.1371/journal.pone.0053150 |
| [22] | Ladoire S, Mignot G, Dalban C, et al. FOXP3 expression in cancer cells and anthracyclines efficacy in patients with primary breast cancer treated with adjuvant chemotherapy in the phase III UNICANCER-PACS 01 trial[J]. Ann Oncol, 2012, 23 (10) : 2552–61. DOI:10.1093/annonc/mds028 |
| [23] | Kim MH, Koo JS, Lee S. FOXP3 expression is related to high Ki-67 index and poor prognosis in lymph node-positive breast cancer patients[J]. Oncol, 2013, 85 (2) : 128–36. DOI:10.1159/000351473 |
| [24] | Wartenberg M, Zlobec I, Perren A, et al. Accumulation of FOXP3+ T-cells in the tumor microenvironment is associated with an epithelial-mesenchymal-transition-type tumor budding phenotype and is an independent prognostic factor in surgically resected pancreatic ductal adenocarcinoma[J]. Oncotarget, 2015, 6 (6) : 4190–201. DOI:10.18632/oncotarget |
| [25] | Niu J, Jiang C, Li C, et al. Foxp3 expression in melanoma cells as a possible mechanism of resistance to immune destruction.[J]. Cancer Immunol Immunother, 2011, 60(8): 1109-18. |
| [26] | Draghiciu O, Lubbers J, Nijman HW, et al. Myeloid derived suppressor cells—An overview of combat strategies to increase immunotherapy efficacy[J]. Oncoimmunology, 2015, 4 (1) : e954829. DOI:10.4161/21624011.2014.954829 |
| [27] | Douglass S, Meeson AP, Overbeck-Zubrzycka D, et al. Breast cancer metastasis: demonstration that FOXP3 regulates CXCR4 expression and the response to CXCL12[J]. J Pathol, 2014, 234 (1) : 74–85. DOI:10.1002/path.2014.234.issue-1 |
| [28] | Takenaka M, Seki N, Toh U, et al. FOXP3 expression in tumor cells and tumor-infiltrating lymphocytes is associated with breast cancer prognosis[J]. Mol Clin Oncol, 2013, 1 (4) : 625–32. |
| [29] | Lin SC, Gan ZH, Yao Y. The prognostic value of forkhead box P3 expression in operable breast cancer: a large-scale meta-analysis[J]. PloS one, 2015, 10 (8) : e0136374. DOI:10.1371/journal.pone.0136374 |
| [30] | Liu S, Foulkes WD, Leung S, et al. Prognostic significance of FOXP3+ tumor-infiltrating lymphocytes in breast cancer depends on estrogen receptor and human epidermal growth factor receptor-2 expression status and concurrent cytotoxic T-cell infiltration[J]. Breast Cancer Res, 2014, 16 (5) : 432. DOI:10.1186/s13058-014-0432-8 |
 2016, Vol. 43
2016, Vol. 43


