文章信息
- 沉默B7-H3基因表达对人肝癌细胞侵袭能力的影响
- Effects of Silencing B7-H3 Gene on Invasion of Human Hepatocellular Carcinoma Cells
- 肿瘤防治研究, 2016, 43(12): 1043-1048
- Cancer Research on Prevention and Treatment, 2016, 43(12): 1043-1048
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.12.007
- 收稿日期: 2016-06-01
- 修回日期: 2016-09-19
2. 050011 石家庄,河北医科大学第四医院肿瘤研究所
2. Hebei Cancer Institute, The Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
肝细胞癌(hepatocellular carcinoma, HCC)是我国高发的恶性肿瘤之一,据估计约占全球新增和死亡病例的50%以上[1]。因早期诊断率低、进展迅速且易于转移,我国肝癌患者5年生存率仍仅为10.1%[2]。高侵袭性是肝细胞癌预后不良的主要原因之一,寻找影响、控制肝细胞癌侵袭性的关键分子将有助于为肿瘤的风险预测和干预治疗提供理论基础和有效途径[3]。
B7-H3是由316个氨基酸组成的Ⅰ型跨膜糖蛋白,在机体正常组织中的表达水平极低,但在包括黑色素瘤、淋巴瘤、急性白血病、胰腺癌、肾细胞癌等多种肿瘤组织中却显著高表达[4-7]。Chen等[8]研究提示下调B7-H3水平可减少恶性黑色素瘤和乳腺癌高达50%的细胞-纤维连接蛋白黏附率和超过70%的侵袭转移。Yuan等[9]也发现B7-H3水平与人前列腺癌细胞的侵袭能力呈显著正相关。在MDA-MB-435细胞移植瘤裸鼠模型中,下调B7-H3降低了肿瘤的侵袭水平并可显著增加动物的无症状存活时间[10]。我们通过临床研究也发现,B7-H3分子不仅在肝细胞癌组织中高表达,而且表达水平与肿瘤的血管侵袭、淋巴结转移和微卫星病灶形成等病理特征密切相关,提示B7-H3可能影响或参与了肝细胞癌及食管鳞癌侵袭的相关机制[11-12]。本研究旨在通过体外实验进一步探究B7-H3分子对肝细胞癌侵袭能力的影响。
1 材料与方法 1.1 材料与试剂人肝癌细胞株HepG2由白求恩国际和平医院全军肝病诊治中心实验室保存。B7-H3 shRNA沉默质粒由美国Origene公司以HuSH pGFP-V-RS为载体设计并构建,沉默序列信息见表 1。cDNA反转录试剂盒(美国Fermentas公司);8.0 μm孔径的Transwell小室(美国Corning公司);WST-1细胞增殖和毒性检测试剂盒(上海碧云天试剂有限公司);ELISA细胞凋亡检测试剂盒(美国Roche公司);Lipofectamine® 3000转染试剂盒(美国Invitrogen公司);反转录试剂盒(美国Fermentas公司);GoTaq® Green Master Mix(美国Promega公司);BCA法蛋白定量试剂盒(上海捷瑞生物工程有限公司);ECL化学发光试剂盒(美国Thermo试剂公司);聚偏二氟乙烯(PVDF)膜(美国Milipore公司);兔抗人MMP-2、MMP-9抗体(美国CST公司);兔抗人B7-H3单克隆抗体(美国Abcam公司);兔抗人GAPDH抗体(美国Santa Cruz公司);辣根过氧化物酶(HRP)标记的抗兔IgG抗体(美国CST公司);胎牛血清(杭州四季青试剂有限公司);高糖DMEM培养液(美国Gibco公司)。
人肝癌细胞株HepG2细胞采用含10%胎牛血清高糖DMEM培养液培养于含5% CO2的37℃恒温恒湿培养箱(德国Heraeus公司)中,取对数生长期细胞进行实验。
1.2.2 细胞外源DNA转染转染前24 h撤胎牛血清,单独采用高糖DMEM培养,实验设未转染组、对照质粒转染组和B7-H3 shRNA转染组,按照Lipofectamine® 3000转染试剂盒说明书,分别向对数生长期的HepG2细胞转入Scramble质粒和B7-H3 shRNA质粒。
1.2.3 反转录PCR(RT-PCR)实验检测B7-H3mRNA的表达收集目的细胞,依照TRIzol试剂说明书提取总RNA,采用美国Thermo公司ND2000型微量核酸蛋白仪测定RNA浓度。取5 μg总RNA反转录RNA为cDNA,用Go Taq® Green Master Mix进行PCR扩增。引物及反应条件见表 2。PCR产物经1.5%琼脂糖凝胶电泳分离,UVP凝胶成像分析系统扫描。
目的细胞裂解、离心并收集上清液,采用BCA法蛋白定量试剂盒,按照说明书步骤进行蛋白定量。10% SDS-PAGE凝胶电泳分离,溴酚蓝至胶底部时终止。采用半干转印系统将蛋白转移至PVDF膜。转膜完毕后,封闭、冲洗,加一抗4℃孵育过夜。次日洗膜,加HRP标记的二抗(1:3 000)37℃孵育1 h后再次洗膜。按照ECL化学发光试剂盒说明书,取等体积A和B液混合,将膜完全浸入,室温孵育3 min,取膜沥干工作液,置于X光胶片暗盒内曝光显影。
1.2.5 划痕修复实验检测HepG2细胞移行能力收集各组细胞,以1×105每毫升密度接种于24孔板,细胞增殖至铺满孔底80%时更换无血清培养液继续培养,待细胞铺满孔底并完全融合,用10 μl加样枪头划痕,在划痕边缘等距间隔标记。更换含10%胎牛血清的高糖DMEM培养液并继续培养,在24、48、72 h时间点用倒置显微镜观察并拍照,测量划痕直径距离,计算占基线距离的百分比。
1.2.6 Transwell实验检测HepG2细胞侵袭能力各组对数生长期HepG2细胞接种于Transwell小室的上室,置于培养箱内分别孵育24 h后取出,用棉签头拭去Matrigel胶及胶上细胞,4%多聚甲醛固定,Gimesa染色后风干。剪下聚碳酸酯膜,树胶封片,在高倍显微镜下观察至少5个视野内细胞数取均值作为穿过Matrigel基质膜的细胞数。
1.2.7 WST-1法检测HepG2细胞的增殖能力按照WST-1细胞增殖和毒性检测试剂盒说明书,将电子耦合试剂1 ml加入到WST-1粉末中至完全溶解,即为WST-1溶液。收集细胞接种于96孔板,细胞贴壁12、24、48及72 h后,每孔分别加WST-1溶液10 μl,以无细胞孔作为空白对照,继续孵育2 h后摇匀,在450 nm处测定吸光度值。
1.2.8 ELISA凋亡试剂盒检测HepG2细胞凋亡水平收集细胞,离心弃上清液并裂解,再次离心吸取上清液备用。样本分别加入到96孔板链霉亲和素包被中,每孔再加入80 μl含生物素标记抗组蛋白抗体和过氧化物酶标记抗DNA抗体的混合液,孵育2 h并冲洗,100 μl ABTS底物显色,以底物溶液作空白对照,用酶标仪(北京六一厂;型号:WD-2102B)在405 nm处测定吸光度值。
1.2.9 明胶酶谱实验检测MMP-2、MMP-9活性取对数生长期细胞,撤血清继续培养24 h,收集培养上清液备用。BCA法测定蛋白浓度确定上样体积。配置5%浓缩胶和含0.1%明胶的10%分离胶,加电泳缓冲液满溢上样孔,每孔上样20 μl进行SDS-PAGE电泳。电泳结束后切取72 kD和92 kD凝胶,用含50 mmol/L Tris-HCL、2.5%Triton X-100、1 μmol/L ZnCl2、5 mmol/L CaCl2的洗脱液洗脱并用含50 mmol/L Tris-HCL、1 μmol/L ZnCl2、5 mmol/L CaCl2的漂洗液漂洗。置于含0.02% Brij-35的孵育液中37℃水浴48 h,含0.05%考马斯亮兰R-250、10%乙酸和30%甲醇的染色液中振荡染色3 h,依次置于脱色液A、B、C(分别含甲醇30%、20%、10%,乙酸10%、10%、5%)中脱色、照相并用凝胶图像分析系统分析各条带光密度值。
1.3 统计学方法采用SPSS20.0软件进行统计学分析,计量资料采用(x±s)表示,B7-H3 shRNA沉默效果检测实验独立重复3次,其余实验均独立重复5次,多组间差异采用单因素方差分析,组间均数的两两比较采用SNK(Student-Newman-Keuls)检验,P<0.05为差异有统计学意义。
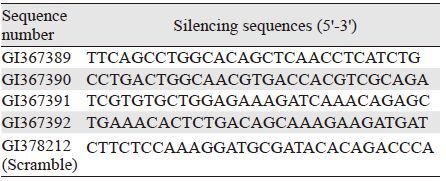
2 结果 2.1 RT-PCR和Western blot检测B7-H3 shRNA的沉默效果B7-H3 shRNA沉默质粒和对照质粒均有绿色荧光蛋白标签,可采用荧光显微镜观察。结果显示,转染48 h可观察到大量绿色荧光,两者转染效率均为80%,见图 1A。采用RT-PCR检测HepG2细胞B7-H3基因沉默效果,转染B7-H3 shRNA组HepG2细胞B7-H3 mRNA表达的相对灰度值为(0.22±0.06), 明显低于对照质粒转染组(0.85±0.09)及未转染组(1.01±0.12)。Western blot检测转染B7-H3 shRNA组HepG2细胞B7-H3蛋白表达相对灰度值(0.36±0.11), 明显低于对照质粒转染组(0.80±0.09)及未转染组(1.11±0.09)。B7-H3的mRNA和蛋白表达水平差异均有统计学意义(mRNA: P<0.001; 蛋白:P<0.001),见图 1B~1C。
|
| A: the transfection efficiency of plasmids observed by fluorescence microscope (×100) ; B: B7-H3 mRNA expressions in HepG2 cells after B7-H3 shRNA transfection analyzed by RT-PCR; C: B7-H3 protein expressions in HepG2 cells after B7-H3 shRNA transfection analyzed by western blot; *: P<0.01, compared with control or scramble-siRNA group 图 1 B7-H3 shRNA质粒的转染效率和沉默效果 (x±s, n=3) Figure 1 The transfection efficiency and gene silence effect of B7-H3 shRNA plasmid (x±s, n=3) |
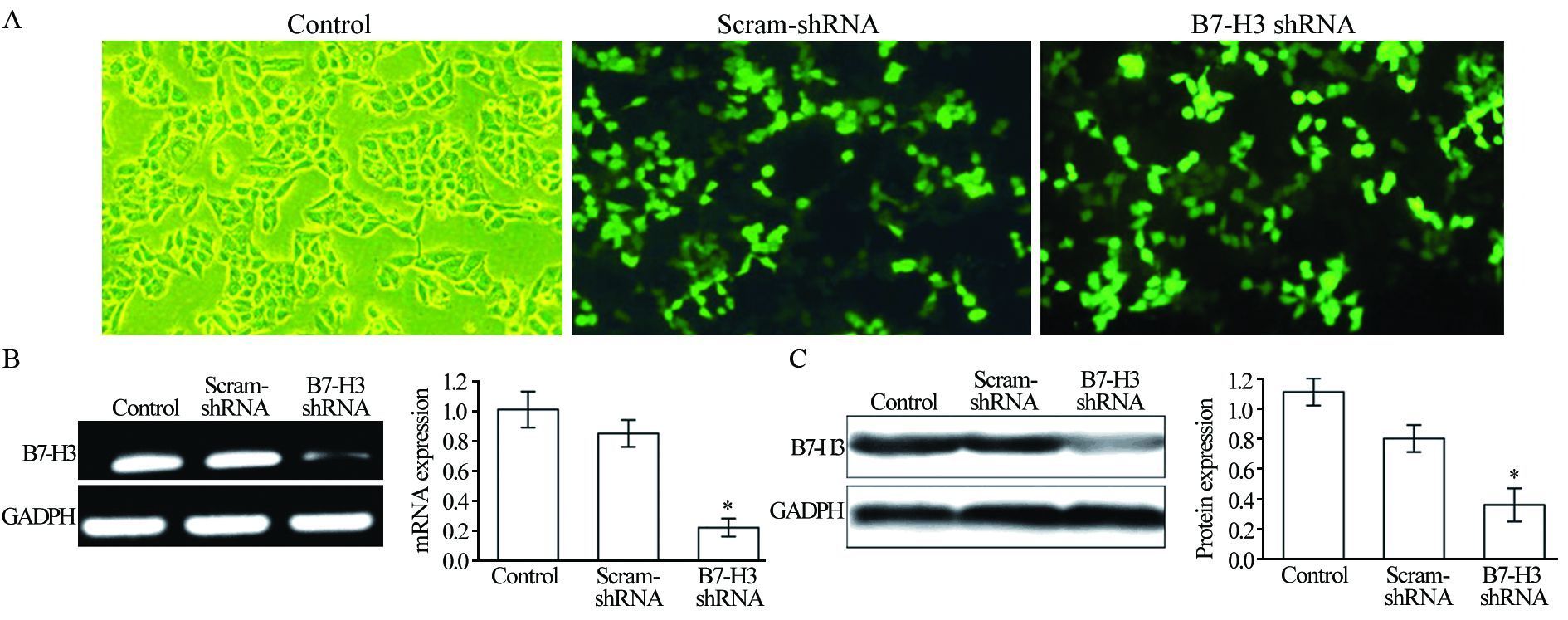
通过划痕修复实验检测沉默B7-H3基因表达对HepG2细胞移行能力的影响,以各时间点划痕距离分别占对应组基线划痕距离的百分比表示。结果显示,B7-H3 shRNA组HepG2细胞于24、48和72 h划痕距离分别占基线的(71.50±7.90)%、(52.19±6.53)%和(34.15±3.70)%,与对照质粒转染组(53.00±5.35)%、(36.45±6.02)%、(14.69±3.11)%及未转染组(50.00±8.09)%、(30.31±3.84)%、(11.51±2.34)%比较,各时间点的差异均有统计学意义(24 h: P=0.001; 48 h: P<0.001;72 h: P<0.001),提示沉默B7-H3基因后HepG2细胞平面移行能力显著下降,见图 2。
|
| *: P<0.01, compared with control or scramble-shRNA group 图 2 通过划痕修复实验检测B7-H3基因沉默对HepG2细胞移行能力的影响 (x±s, n=5) Figure 2 Effects of B7-H3 gene silencing on the movement abilities of HepG2 cells measured by scratch wound healing assay (x±s, n=5) |
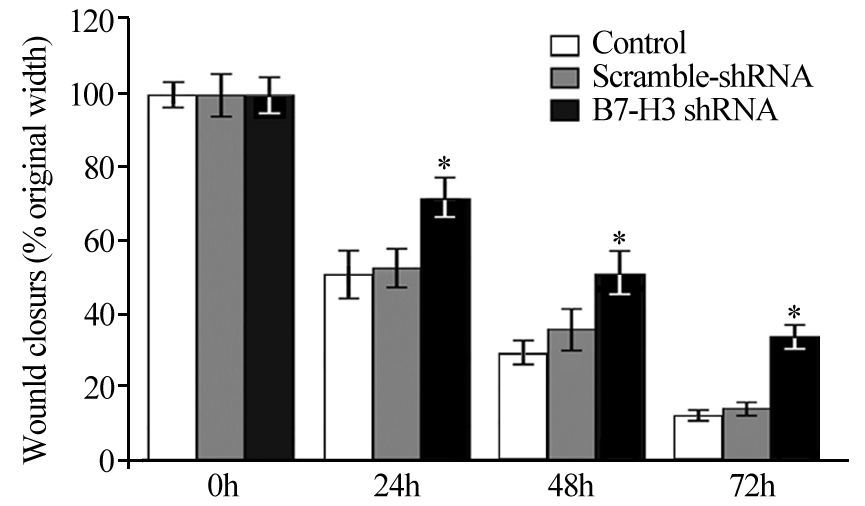
B7-H3 shRNA沉默组HepG2细胞孵育24 h,在100倍光学显微镜下观察每视野跨膜细胞数量为(82.17±7.00),而对照质粒转染组和未转染组分别为(208.37±23.98)和(243.26±14.07),组间比较差异有统计学意义(P<0.001),见图 3。可见,下调B7-H3的表达可导致HepG2细胞侵袭能力明显下降。
|
| *: P<0.05, compared with control or scramble-shRNA group 图 3 通过Transwell实验检测B7-H3基因沉默对HepG2细胞侵袭能力的影响 (×100) (x±s, n=5) Figure 3 Effects of B7-H3 gene silencing on the invasive abilities of HepG2 cells measured by Transwell invasion model (×100) (x±s, n=5) |
通过WST-1法检测沉默B7-H3表达后HepG2细胞增殖水平的变化,并与对照质粒转染组和未转染组比较发现,下调B7-H3的表达在72 h内对HepG2细胞增殖能力无显著影响(P>0.05),见图 4A。利用组蛋白-DNA凋亡试剂盒检测发现,各组间在HepG2细胞B7-H3基因沉默48和72 h的凋亡水平均无明显变化(P>0.05),见图 4B。
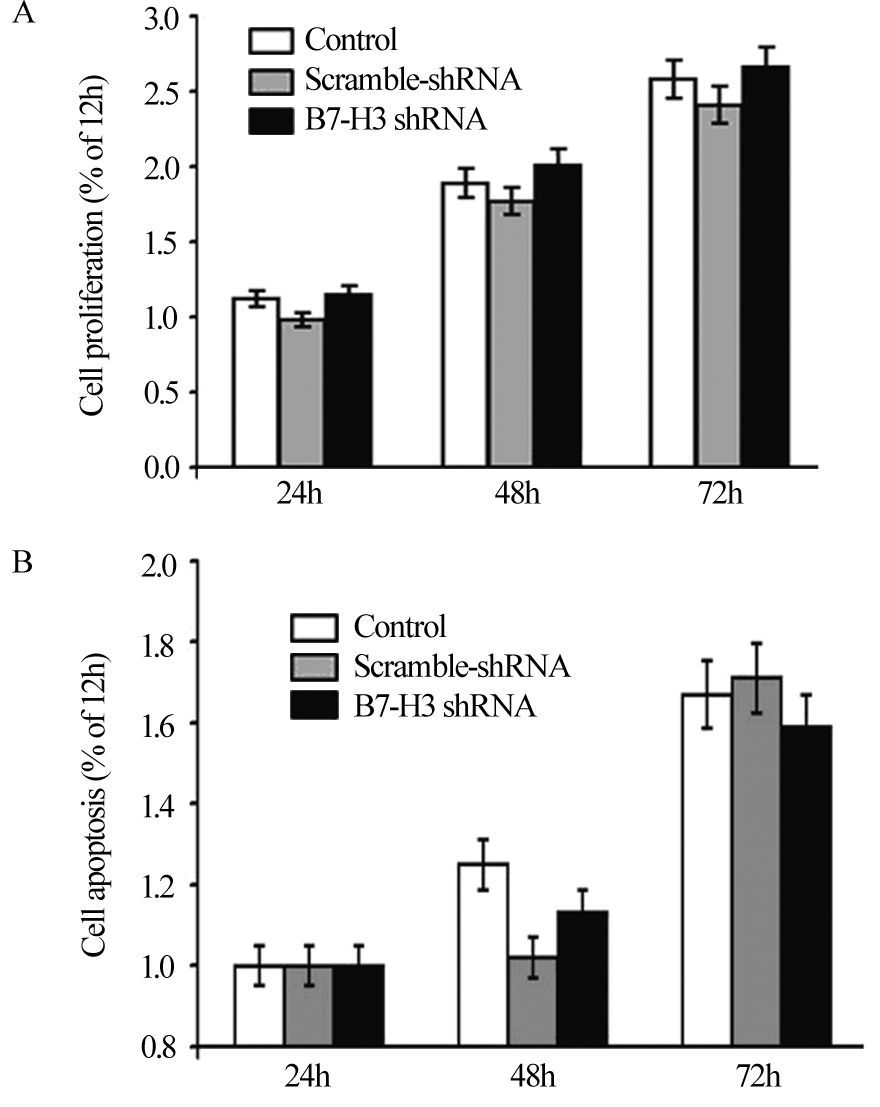
|
| A: Cell proliferation was measured by WST-1 assay; B: Cell apoptosis was measured by ELISA apoptosis detection kit 图 4 B7-H3基因沉默对HepG2细胞增殖和凋亡的影响 Figure 4 Effects of B7-H3 gene silencing on HepG2 cells’ proliferation and apoptosis of HepG2 cells |
Western blot结果显示,沉默B7-H3表达后,HepG2细胞MMP-2(0.41±0.11)和MMP-9(0.68±0.15)的蛋白表达均显著低于对照质粒转染组(1.27±0.25; 1.00±0.12)和未转染组(1.37±0.27; 1.22±0.33),差异具有统计学意义(MMP-2: P<0.001; MMP-9: P=0.007),见图 5A。
明胶酶谱实验结果显示,转染B7-H3 shRNA 48 h时,HepG2细胞MMP-2和MMP-9的活性(2589±211、3112±308)明显低于对照质粒转染组(4725±413、5100±387)和未转染组(5102±306、5962±519),组间比较差异均有统计学意义 (MMP-2: P<0.001; MMP-9: P<0.001),见图 5B。
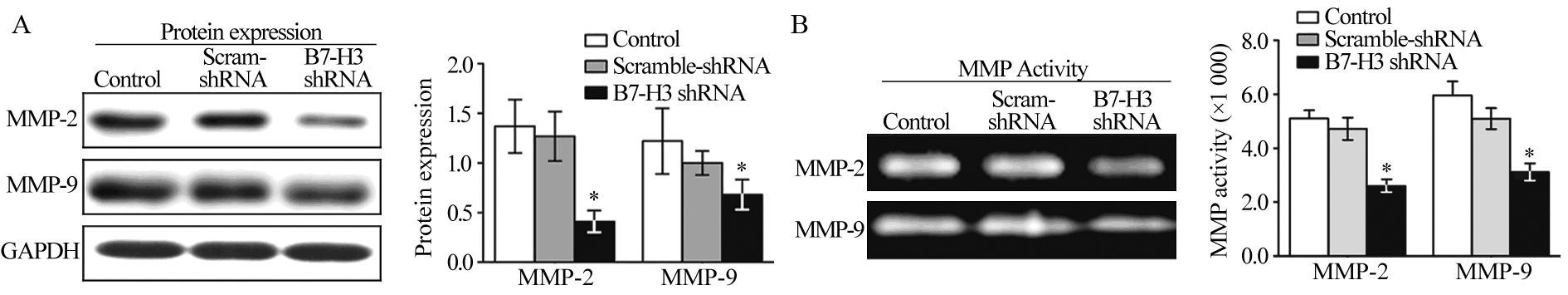
|
| A: the protein expressions of MMP-2 and MMP-9 were measured by Western blot; B: the activities of MMP-2 and MMP-9 were measured by gelatin zymography experiment; *: P<0.05, compared with control or scramble-siRNA group 图 5 B7-H3基因沉默对侵袭相关分子MMP-2、MMP-9蛋白表达和活性的影响 Figure 5 Effects of B7-H3 gene silencing on the expressions and activities of invasion related molecules MMP-2, MMP-9 |
随着早期诊断和临床技术的发展,近年来肝细胞癌外科手术率已明显提高,但是肝癌术后累积5年复发率仍然高达50%~80%[13-14]。高复发和转移率被认为与肿瘤的侵袭性有关[3]。因此,对肝细胞癌侵袭机制的阐释将有助于寻找有效治疗靶点,进而改善疾病预后。
B7-H3属于B7家族成员,作为第二信号系统分子发挥免疫调节作用[4]。不仅如此,B7-H3还可通过非免疫学途径参与肿瘤发生机制,被发现与黑色素瘤、乳腺癌、前列腺癌等多种肿瘤细胞的侵袭、转移有关[8-9]。沉默B7-H3改变了多种侵袭、转移相关的基因如MMP-2、TIMP-1、TIMP-2、IL-8和Stat3的表达[10]。我们在临床研究中也发现,肝细胞癌组织B7-H3的表达与衡量肿瘤侵袭性的病理特征如血管侵犯、微卫星病灶、淋巴结转移等关系密切[11-12]。但是,B7-H3是否可直接影响肝细胞癌的侵袭性目前并不清楚。为此我们通过siRNA沉默肝癌细胞系B7-H3表达,观察肿瘤细胞移行、侵袭能力及相关分子表达的变化。
本课题选择HepG2细胞是来源于人的肝癌细胞株,经检测在mRNA和蛋白水平上均组成性高表达B7-H3[15-16]。实验设计针对B7-H3的shRNA,通过质粒转染细胞,并以未转染细胞和转染空质粒细胞作为对照组。通过荧光显微镜观察,转染效率约80%,可满足实验要求。RT-PCR和Western blot实验结果显示,转染B7-H3 shRNA沉默质粒的HepG2细胞B7-H3在mRNA和蛋白水平表达均显著下降。
细胞移行和细胞间质降解是肿瘤侵袭过程中的重要环节[17]。划痕修复实验用以评价细胞的移行能力,结果显示沉默B7-H3基因后HepG2细胞的移行能力显著下降。肿瘤细胞分泌胶原酶水解Transwell上室Matrigel胶并穿过聚碳酸酯膜微孔,计数下室面细胞数量可用以评价肿瘤细胞的侵袭能力。与对照组比较,HepG2细胞在B7-H3基因表达下调后穿过基底胶的细胞数量明显减少。两组实验说明,B7-H3下调显著降低了HepG2细胞的侵袭能力。由于肿瘤细胞的增殖和抗凋亡能力可能影响细胞数量进而影响体外侵袭性实验结果,为此我们分别检测了沉默B7-H3基因对HepG2细胞增殖和凋亡的影响,发现下调B7-H3表达HepG2细胞的增殖能力和凋亡水平并无明显变化,提示B7-H3并非通过影响HepG2细胞的增殖和抗凋亡能力而间接影响HepG2细胞的侵袭性结果,据此我们推测B7-H3可能通过特定信号通路直接参与了肿瘤侵袭的相关机制。
基质金属蛋白酶(MMPs)是一组内肽酶,目前至少已发现23个成员[18]。其中,MMP-2、MMP-9又被称为明胶酶,在肝癌等多种肿瘤中均高活性表达[19]。明胶酶是目前已知唯一能降解Ⅳ型胶原的基质蛋白水解酶,而Ⅳ型胶原正是构成细胞外基质的基本骨架,因此MMP-2、MMP-9在促进癌细胞突破基底膜和细胞外基质屏障中发挥重要作用[20]。先前研究提示,MMP-2参与了B7-H3调节骨肉瘤的侵袭机制[21]。Tekle等[10]发现B7-H3可以通过调节MMP-2和Stat3的活性影响黑色素瘤细胞的侵袭转移。本研究发现沉默HepG2细胞B7-H3基因后,MMP-2和MMP-9的表达水平和活性均显著下降,可能是肝癌细胞在B7-H3表达下调后侵袭能力降低的重要原因之一。
综上所述,肝细胞癌高表达B7-H3是肿瘤适应性生存的重要机制,靶向干扰B7-H3基因表达能显著抑制HepG2细胞的侵袭性,为探索肝细胞癌的生物治疗提供了可靠的实验证据和新思路。
| [1] | Liu HC. Interpretation on guideline of treatment of primary hepatocellular carcinoma[J]. Gan Dan Wai Ke Za Zhi, 2013, 21 (1) : 12–4. [ 刘会春. 中国原发性肝癌治疗指南解读[J]. 肝胆外科杂志, 2013, 21 (1) : 12–4. ] |
| [2] | Zeng H, Zheng R, Guo Y, et al. Cancer survival in China, 2003-2005: a population-based study[J]. Int J Cancer, 2015, 136 (8) : 1921–30. DOI:10.1002/ijc.29227 |
| [3] | Liu WT, Jing YY, Yu GF, et al. Toll like receptor 4 facilitates invasion and migration as a cancer stem cell marker in hepatocellular carcinoma[J]. Cancer Lett, 2015, 358 (2) : 136–43. DOI:10.1016/j.canlet.2014.12.019 |
| [4] | Chapoval AI, Ni J, Lau JS, et al. B7-H3: a costimulatory molecule for T cell activation and IFN-gamma production[J]. Nat Immunol, 2001, 2 (3) : 269–74. DOI:10.1038/85339 |
| [5] | Wang L, Kang FB, Shan BE. B7-H3-mediated tumor immunology: Friend or foe?[J]. Int J Cancer, 2014, 134 (12) : 2764–71. DOI:10.1002/ijc.v134.12 |
| [6] | Hu Y, Lv X, Wu Y, et al. Expression of costimulatory molecule B7-H3 and its prognostic implications in human acute leukemia[J]. Hematology, 2015, 20 (4) : 187–95. DOI:10.1179/1607845414Y.0000000186 |
| [7] | Zhang W, Wang Y, Wang J, et al. B7-H3 silencing inhibits tumor progression of mantle cell lymphoma and enhances chemosensitivity[J]. Int J Oncol, 2015, 46 (6) : 2562–72. |
| [8] | Chen YW, Tekle C, Fodstad O. The immunoregulatory protein human B7H3 is a tumor-associated antigen that regulates tumor cell migration and invasion[J]. Curr Cancer Drug Targets, 2008, 8 (5) : 404–13. DOI:10.2174/156800908785133141 |
| [9] | Yuan H, Wei X, Zhang G, et al. B7-H3 over expression in prostate cancer promotes tumor cell progression[J]. J Urol, 2011, 186 (3) : 1093–9. DOI:10.1016/j.juro.2011.04.103 |
| [10] | Tekle C, Nygren MK, Chen YW, et al. B7-H3 contributes to the metastatic capacity of melanoma cells by modulation of known metastasis-associated genes[J]. Int J Cancer, 2012, 130 (10) : 2282–90. DOI:10.1002/ijc.v130.10 |
| [11] | Wang L, Cao NN, Shan BE, et al. Expression and clinical significance of costimulatory molecule B7-H3 in human hepatocellular carcinoma[J]. Zhongguo Ai Zheng Za Zhi, 2013, 23 (2) : 81–6. [ 王玲, 曹娜娜, 单保恩, 等. 共刺激分子B7-H3在人原发性肝癌中的表达及临床意义[J]. 中国癌症杂志, 2013, 23 (2) : 81–6. ] |
| [12] | Cao NN, Wang L, Wang S, et al. Expression of costimulatory molecule B7-H3 in human esophageal squamous cell carcinoma and clinical significance[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41 (12) : 1300–3. [ 曹娜娜, 王玲, 王珊, 等. 共刺激分子B7-H3在人食管鳞癌中的表达及临床意义[J]. 肿瘤防治研究, 2014, 41 (12) : 1300–3. ] |
| [13] | Forner A, Gilabert M, Bruix J, et al. Treatment of intermediate-stage hepatocellular carcinoma[J]. Nat Rev Clin Oncol, 2014, 11 (9) : 525–35. DOI:10.1038/nrclinonc.2014.122 |
| [14] | Liu YY, Lai JX, Liu XX. Reasonable option of management approaches for recurrent liver cancer[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2012, 32 (10) : 796–8. [ 刘允怡, 赖俊雄, 刘晓欣. 肝癌术后复发治疗方式合理选择[J]. 中国实用外科杂志, 2012, 32 (10) : 796–8. ] |
| [15] | Kang FB, Wang L, Li D, et al. Hepatocellular carcinomas promote tumor-associated macrophage M2-polarization via increased B7-H3 expression[J]. Oncol Rep, 2015, 33 (1) : 274–82. |
| [16] | Wang F, Wang G, Liu T, et al. B7-H3 was highly expressed in human primary hepatocellular carcinoma and promoted tumor progression[J]. Cancer Invest, 2014, 32 (6) : 262–71. DOI:10.3109/07357907.2014.909826 |
| [17] | Man YG, Stojadinovic A, Mason J, et al. Tumor-infiltrating immune cells promoting tumor invasion and metastasis: existing theories[J]. J Cancer, 2013, 4 (1) : 84–95. DOI:10.7150/jca.5482 |
| [18] | Kessenbrock K, Wang CY, Werb Z. Matrix metalloproteinases in stem cell regulation and cancer[J]. Matrix Biol, 2015, 44-46 : 184–90. DOI:10.1016/j.matbio.2015.01.022 |
| [19] | Roomi MW, Monterrey JC, Kalinovsky T, et al. Patterns of MMP-2 and MMP-9 expression in human cancer cell lines[J]. Oncol Rep, 2009, 21 (5) : 1323–33. |
| [20] | No?l A, Gutiérrez-Fernández, A, Sounni NE, et al. New and paradoxical roles of matrix metalloproteinases in the tumor microenvironment[J]. Front Pharmacol, 2012, 3 : 140. |
| [21] | Wang L, Zhang Q, Chen W, et al. B7-H3 is overexpressed in patients suffering osteosarcoma and associated with tumor aggressiveness and metastasis[J]. PLoS One, 2013, 8 (8) : e70689. DOI:10.1371/journal.pone.0070689 |
 2016, Vol. 43
2016, Vol. 43