文章信息
- 甲状腺激素受体βΔ对大鼠乳腺癌SHZ-88细胞增殖及凋亡的影响
- Effect of Thyroid Hormone Receptor βΔ on Proliferation and Apoptosis of Rat Breast Cancer Cells SHZ-88
- 肿瘤防治研究, 2016, 43(12): 1018-1022
- Cancer Research on Prevention and Treatment, 2016, 43(12): 1018-1022
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.12.002
- 收稿日期: 2016-02-02
- 修回日期: 2016-06-13
甲状腺激素受体(thyroid hormone receptor, TR)是一种配体依赖性转录因子,在哺乳动物组织中广泛分布,在转录水平调控靶基因的表达,对维持机体正常发育和代谢平衡具有重要作用[1-2]。此前,在哺乳动物中已发现的多种不同的TR亚型,分别是由Trα和Trβ两个基因由于转录起始位点的不同或选择性剪接而产生的同功体,其中仅TRα1、TRβ1 、TRβ2 和TRβ3既可结合T3又可结合甲状腺激素DNA调控原件(thyroid hormone response elements, TREs)[3],被视为功能性受体。
近年来大量研究报告显示,Trβ还具有肿瘤抑制基因的功能[4-5],目前TRβ1作为肿瘤治疗的一个新的分子靶标备受关注[4, 6]。而大鼠体内新发现的“加长型” TRβ同功体TRβΔ(GenBank登记注册,编号为DQ191165.1),与TRβ1高度同源,且研究已证实TRβΔ是功能性TR,具有转录因子的特性[7]。为了探讨TrβΔ是否具有肿瘤抑制基因的功能,本研究以大鼠乳腺癌SHZ-88细胞为研究对象,探讨TRβΔ对SHZ-88细胞增殖、凋亡的影响及其可能机制。
1 材料与方法 1.1 细胞及试剂大鼠乳腺癌SHZ-88细胞系购自中国科学院上海生命科学研究院;真核表达载体pcDNA3.1-TrβΔ、可磷酸化短肽(基序为“LLLRRRDNEY*FY*VRRLL”)均为前期构建保存;壳聚糖及T3(Sigma,美国);胎牛血清(HyClone,南美);RT-qPCR试剂盒(TaKaRa,日本);BCA蛋白测定试剂盒(Pierce,美国);细胞组蛋白/DNA碎片ELISA检测试剂盒(Roche, 德国);Caspase-3/9分光光度法检测试剂盒及JC-1试剂盒(凯基生物科技发展有限公司,南京);Annexin V-FITC凋亡试剂盒(Life, 美国);CCK-8检测试剂盒(东仁化学科技有限公司,日本);兔抗TRβΔ IgG由本实验室制备并保存;HRP标记的山羊抗兔IgG(博奥森生物技术有限公司, 北京)。
Caspase-3上游引物:5’-gAACggACCTgTggACCTg-3’,下游引物:5’- gggTgCggTAgAgTAAgC-3’,扩增产物长度214 bp;Caspase-9上游引物:5’-CACACCAgAAACACCCAg-3’,下游引物:5’-gCAgAAgTTCACgTTgTTg-3’,扩增产物长度154 bp;内参基因Gapdh上游引物:5’-ACAgCAACTCCCATTCTT-3’,下游引物:5’-TCCAgggTTTCTTACTCC-3’,扩增产物长度198 bp。上述引物均委托北京奥科生物技术有限公司合成。
1.2 实验方法 1.2.1 pSP-CS/pDNA复合物的制备使用可磷酸化短肽(pSP)修饰壳聚糖形成pSP-CS,并以pSP-CS作为基因运输载体包被pcDNA3.1及重组质粒pcDNA3.1-TrβΔ形成pSP-CS/pcDNA(pSP-CS/pcDNA3.1和pSP-CS/pcDNA3.1-TrβΔ)纳米粒复合物,具体方法见前报道[8]。
1.2.2 Western blot印迹实验pSP-CS/pcDNA纳米复合物,瞬时转染SHZ-88细胞,48 h后裂解细胞提取核蛋白,进行SDS-PAGE。湿转法将凝胶中蛋白转至NC膜,室温封闭2 h,加入1:800稀释的兔抗TRβΔ IgG,4℃过夜后,加入1:5 000稀释的HRP标记的山羊抗兔IgG,37℃ 2 h后进行曝光及显影,GAPDH作为内参。
1.2.3 细胞培养及转染SHZ-88细胞培养于含10%FBS及双抗的1640培养液中,待细胞达85%~90%融合后,分别以5×104、2.5×105和1×106/孔接种于96、24和6孔板中,生长至75%融合后进行转染,DNA用量分别为0.1、0.5和2.5微克每孔,实验分四组:pcDNA3.1(pSP-CS/pcDNA3.1)、pcDNA3.1+T3(pSP-CS/pcDNA3.1+T3)、pcDNA3.1-TrβΔ (pSP-CS/pcDNA3.1-TrβΔ)及pcDNA3.1-TrβΔ+T3(pSP-CS/pcDNA3.1-TrβΔ+T3)。其中T3组为转染pcDNA3.1和pcDNA3.1-TrβΔ后给予T3(10 nmol/L)干预,然后分别进行相关指标的检测。
1.2.4 CCK-8法检测细胞增殖待上述接种于96孔板细胞转染48 h后, 每孔加入10 μl CCK-8溶液,设置空白调零组6孔(CCK溶液、培养液)。孵育3 h后,450 nm波长测定OD值,OD450值经公式换算后,得出各组SHZ-88细胞增殖活力。
1.2.5 细胞凋亡及线粒体跨膜电位检测待上述接种于6孔板细胞转染48 h后,收集4×105个细胞,按照试剂盒说明进行Annexin V-FITC及碘化丙啶(PI)染色,流式细胞仪检测;收集细胞,按照ELISA试剂盒说明检测细胞组蛋白/DNA碎片,405 nm波长检测吸光度值并计算富集系数(反映各实验组相对于对照组核小体富集的程度, 即各实验组样品中细胞凋亡的相对水平);收集细胞,JC-1染色后,流式细胞仪检测各组线粒体跨膜电位。
1.2.6 Caspase-9和Caspase-3mRNA检测待上述接种于6孔板细胞转染48 h后,收集细胞提取总RNA,反转录生成cDNA。普通PCR扩增Caspase-9、Caspase-3及内参基因GAPDH,1.5%琼脂糖凝胶电泳初步鉴定PCR产物并行DNA序列分析。实时荧光定量PCR检测各cDNA样本,20 µl反应体系:SYBY Green Mix 10.0 µl、cDNA模板1.0 µl、上、下游引物(10 pmol/µl)各1.0 µl、灭菌双蒸水7.0 µl。反应条件: 95℃预变性30 s;95℃ 5 s、57℃ 20 s、72℃ 20 s,40个循环,每个循环延伸末检测荧光信号,计算各cDNA样本Caspase-9、Caspase-3及GAPDH的Ct值,Caspase-9、Caspase-3 的Ct值与相对应GAPDH的Ct值相减得到∆Ct进行标准化,以此来校正样本之间RNA的质量和反转录效率的差异,以2-∆∆Ct计算得到Caspase-9、Caspase-3基因的相对表达水平。
1.2.7 Caspase-9、Caspase-3活性检测待上述接种于6孔板细胞转染48 h后,收集5×106细胞裂解,取上清测定蛋白浓度后,按照试剂盒说明检测405 nm波长吸光度值,通过计算OD转染组/OD空白对照组的倍数,确定各组Caspase-9、Caspase-3的活化程度。
1.3 统计学方法应用SPSS17.0软件进行分析。计量资料以x±s表示,组间比较采用方差分析,两两比较应用LSD法。P<0.05为差异有统计学意义。
2 结果 2.1 Western blot印迹鉴定表达产物结果SHZ-88细胞内存在TRβΔ少量基础表达,pSP-CS/pcDNA纳米粒复合物可成功将TrβΔ转运进入SHZ-88细胞内并高效表达,见图 1。
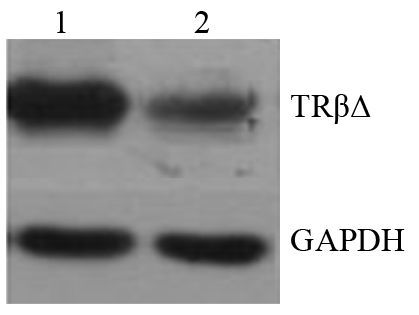
|
| 图 1 Western blot印迹检测SHZ-88细胞内TRβΔ过表达 Figure 1 Overexpression of TRβΔ in SHZ-88 cells analyzed by Western blot |
与pcDNA3.1组相比,pcDNA3.1-TrβΔ组SHZ-88细胞增殖活力下降(P=0.04),给予T3后抑制作用进一步加强(P=0.04),T3对pcDNA3.1组影响差异无统计学意义(P=0.86),见图 2。
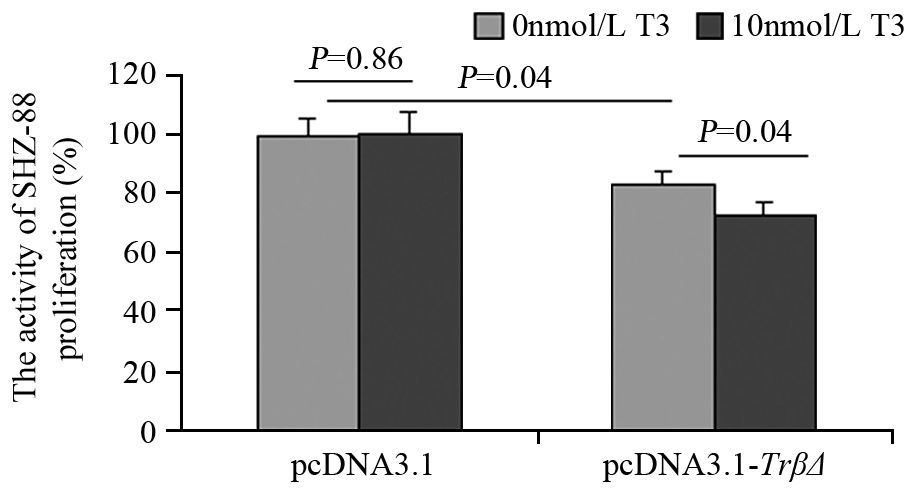
|
| A: SHZ-88 cells were transfected with pSP-CS/pcDNA for 48h, then the cells were collected and double stained with Annexin V/PI and detected by flow cytometry; B: the total number of apoptotic cells was determined by calculating the sum of the early apoptotic cells (Annexin V-FITC +/PI-) and the late apoptotic cells (Annexin V-FITC+/PI+); C: the cells were collected and detected histone/DNA fragments by ELISA 图 2 TRβΔ对SHZ-88细胞增殖的影响 Figure 2 Effect of TRβΔ on proliferation of SHZ-88 cells |
流式细胞仪及组蛋白/DNA碎片定量检测结果均显示:与pcDNA3.1组相比,pcDNA3.1-TrβΔ组对SHZ-88细胞凋亡有明显的促进作用(P=0.03),给予T3后促凋亡作用进一步加强(P=0.00);T3对pcDNA3.1组影响差异无统计学意义(P=0.88),见图 3A。
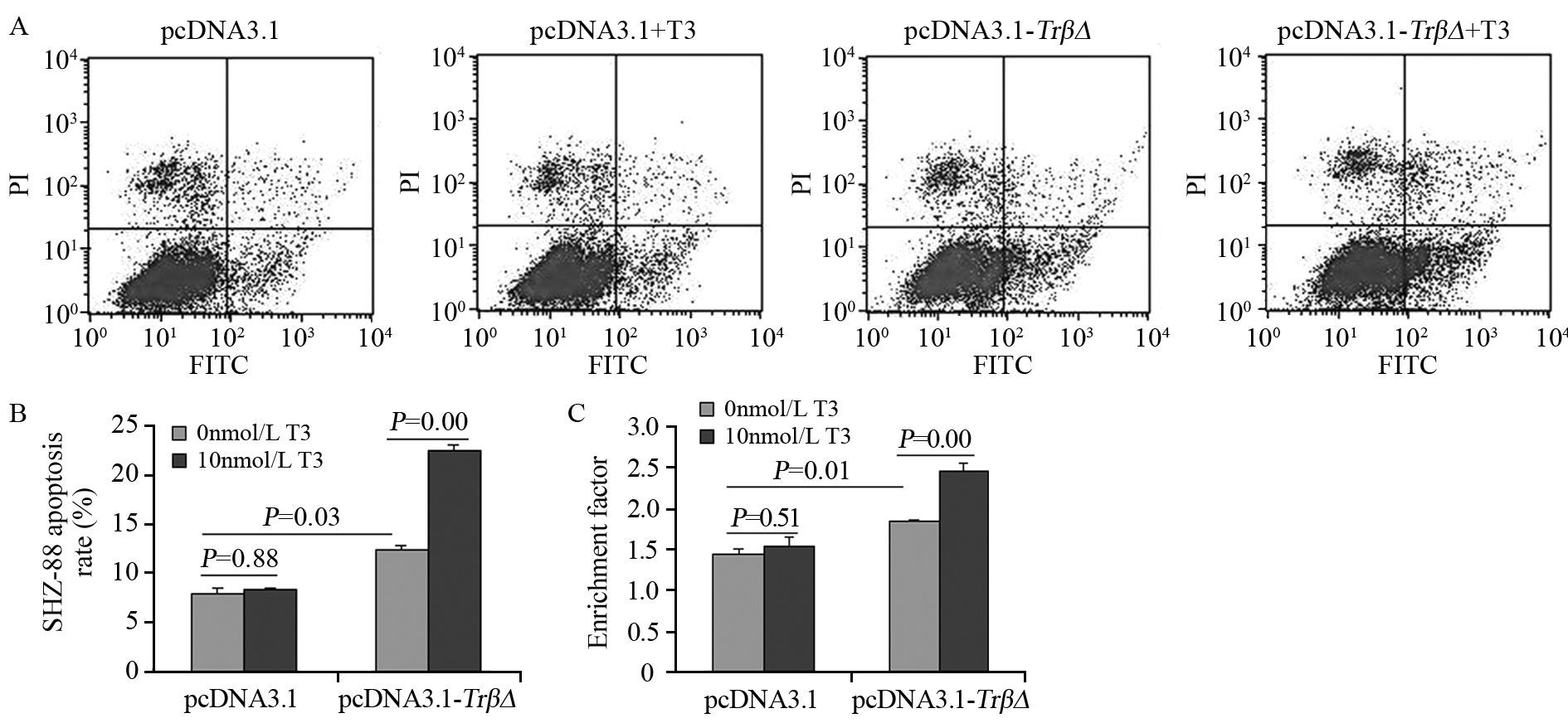
|
| 图 3 TRβΔ对SHZ-88细胞凋亡的影响 Figure 3 Effect of TRβΔ on apoptosis of SHZ-88 cells |
无论T3存在与否,pcDNA3.1组主要为发射红色荧光的细胞,细胞膜电位较高,与pcDNA3.1+T3组比较,差异无统计学意义(P=0.57);pcDNA3.1-TrβΔ转染后,发射红色荧光的细胞数减少,发射绿色荧光的细胞数增加,膜电位下降(P=0.00),T3作用后膜电位进一步下降(P=0.00),见图 4。
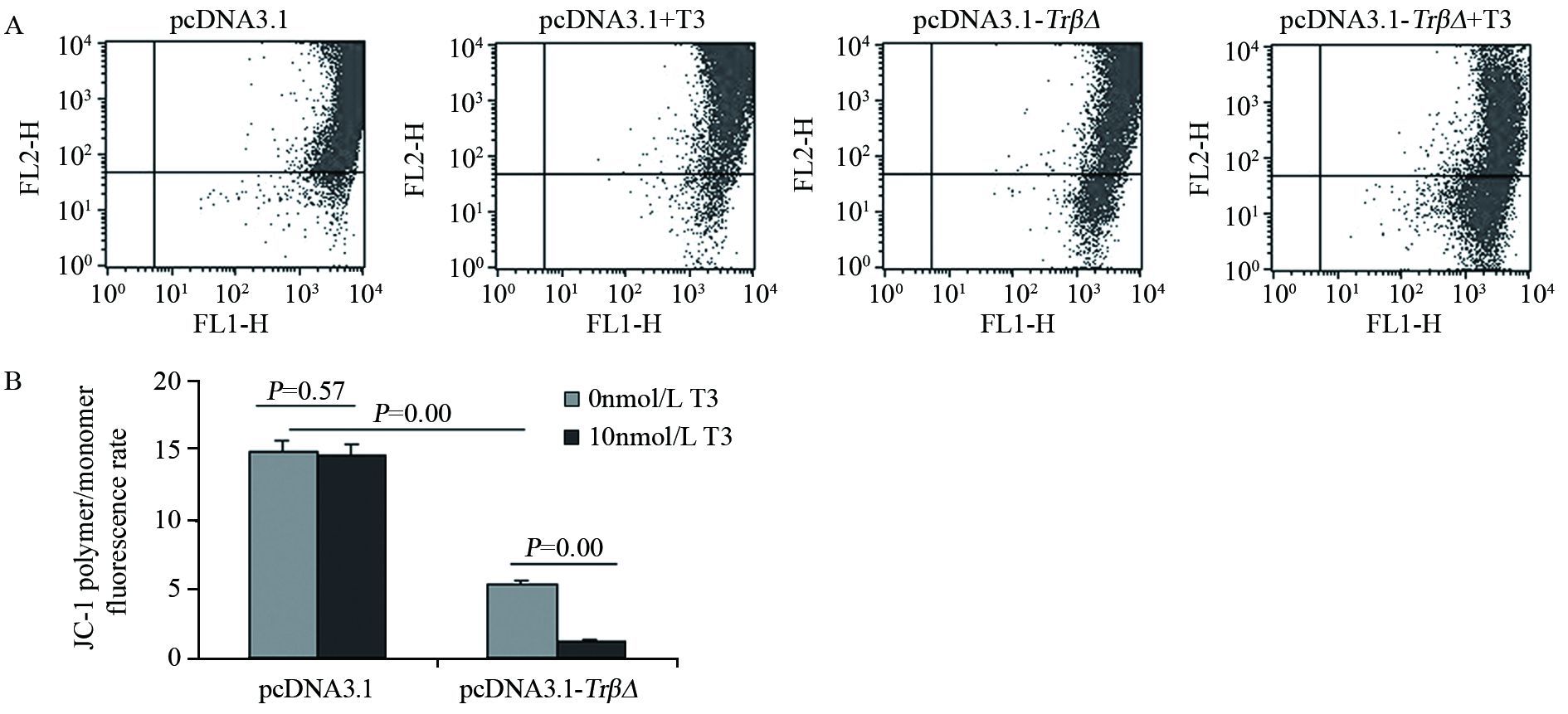
|
| 图 4 TRβΔ对SHZ-88细胞线粒体膜电位的影响 Figure 4 Effect of TRβΔ on mitochondrial membrane potential of SHZ-88 cells |
定量PCR结果提示,与pcDNA3.1组相比,pcDNA3.1-TrβΔ组明显上调Caspase-9和Caspase-3基因表达(P=0.02, P=0.02),给予T3后该作用进一步加强(P=0.02, P=0.00);T3对pcDNA3.1组影响差异无统计学意义(P=0.72, P=0.71),见图 5。
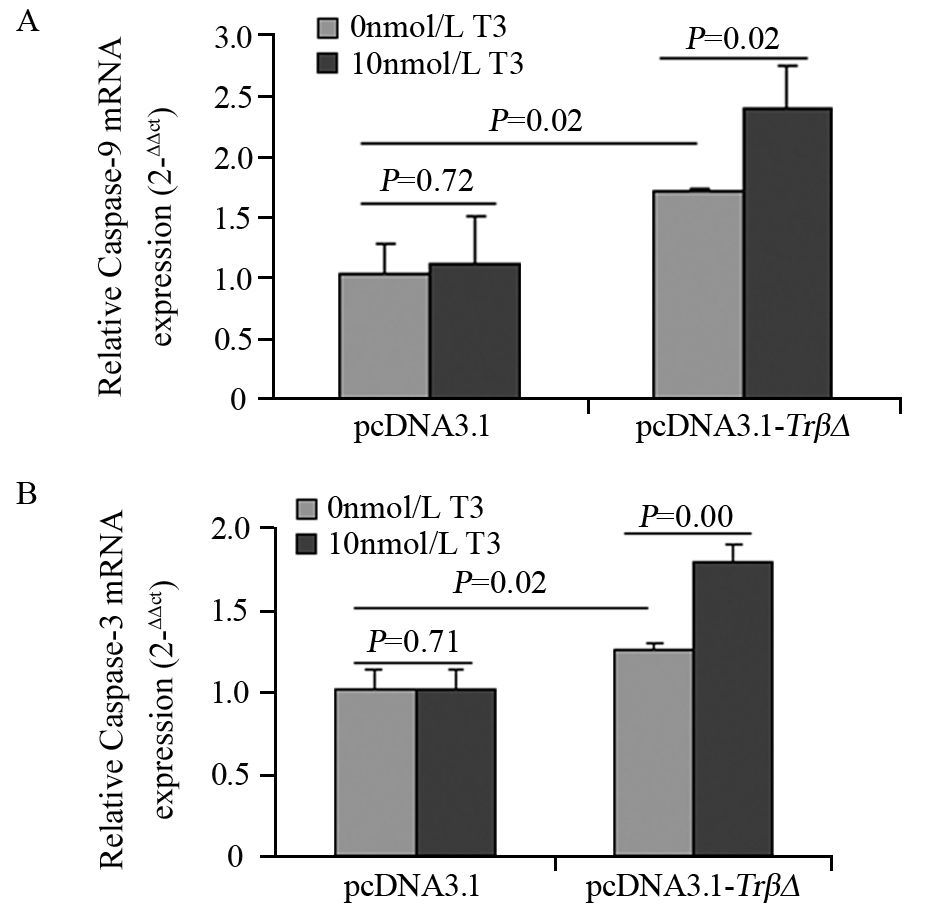
|
| 图 5 TRβΔ对SHZ-88细胞Caspase-9(A)和Caspase-3(B) mRNA水平的影响 Figure 5 Effect of TRβΔ on Caspase-9(A) and Caspase-3(B) mRNA level in SHZ-88 cells |
与pcDNA3.1组相比,pcDNA3.1-TrβΔ组Caspase-9和Caspase-3活性明显升高(P=0.01, P=0.03),T3作用后活性进一步升高(P=0.01, P=0.01);T3对pcDNA3.1组影响差异无统计学意义(P=0.46, P=0.89),见图 6。
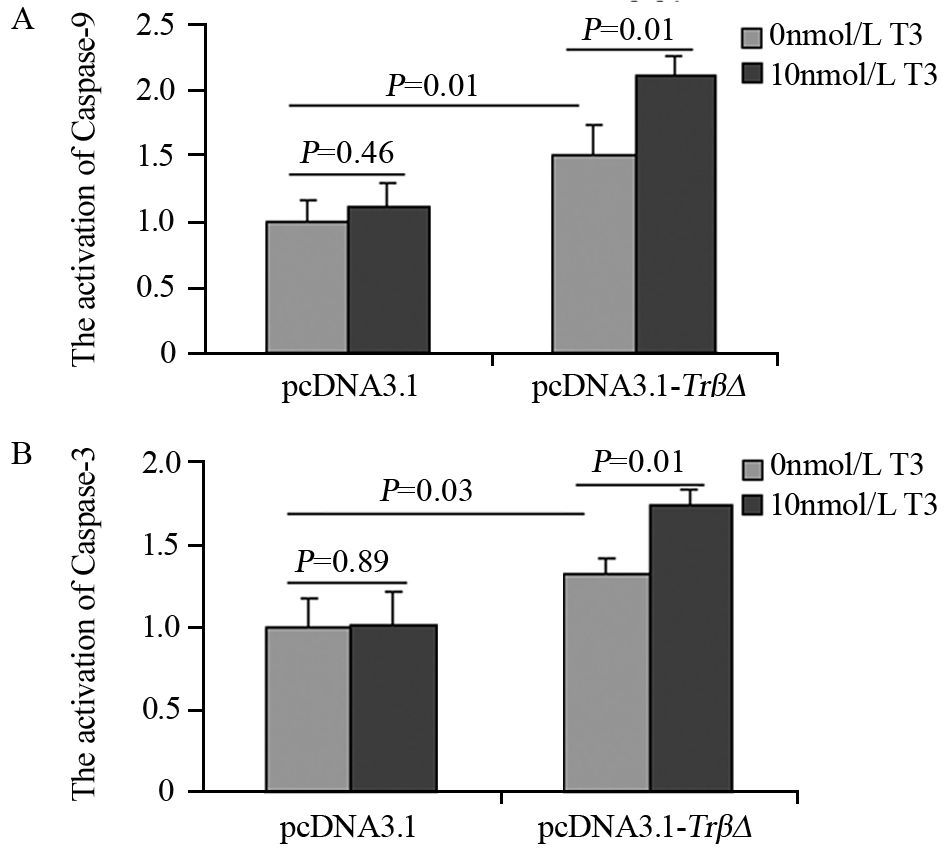
|
| 图 6 TRβΔ对SHZ-88细胞Caspase-9(A)和Caspase-3(B)活性的影响 Figure 6 Effect of TRβΔ on Caspase-9(A) and Caspase-3 (B) activation in SHZ-88 cells |
TR除具有代谢调节作用外,近年被越来越多的研究证实还具有肿瘤发生调节作用,尤其是TRβ受体亚型表现出了明显的肿瘤抑制功能[6-7]。在已发现的多种TRβ亚型中以TRβ1在体内的分布和生物学活性最为广泛,其在乳腺癌发生发展中的作用也越来越受到重视,而甲状腺激素及其受体与乳腺癌的发生发展长期存在矛盾性结论[9]。有研究显示乳腺癌患者血清甲状腺激素T3水平升高[10],同时亦有研究显示乳腺癌患者血清T3水平下降[11],T3可促进乳腺癌细胞的凋亡[12],上述研究表明甲状腺激素在乳腺癌细胞生长中可能具有双向的作用。本研究显示,在TRβΔ过表达的乳腺癌SHZ-88细胞中,T3促进了乳腺癌细胞的凋亡。
大量研究显示在乳腺癌肿瘤组织中检测到了Trβ1基因突变、表达的降低甚至缺失[13-14],在乳腺癌细胞中转染Trβ1基因可有效抑制癌细胞的生长及转移[15]。而大鼠体内新发现的TRβ同功体TRβΔ,与TRβ1高度同源,仅在DNA结合域(DNA-binding domain, DBD)比TRβ1多了36个氨基酸残基。前期研究已经证实TRβΔ是功能性TR, 具有转录因子的特性[7]。TRβΔ是否与TRβ1相似同样对肿瘤细胞具有重要作用,本研究结果证实TRβΔ可有效抑制乳腺癌细胞的增长,并促进其发生凋亡。
细胞凋亡是一种独特的细胞死亡方式,是在基因调控下,由内外环境的改变或死亡信号触发引起的细胞程序性死亡。在凋亡细胞的胞质中出现核小体或寡聚核小体,通过ELISA可以对细胞凋亡进行定量检测。本研究中的ELISA及流式检测结果均显示TRβΔ明显促进SHZ-88细胞的凋亡。目前研究表明,调节细胞凋亡的途径主要分为三种:死亡受体途径、线粒体途径及内质网相关细胞凋亡途径,其中线粒体凋亡途径涉及线粒体膜电位的改变及Caspase-3, -9的活化等[16]。线粒体受到凋亡信号刺激时,膜电位下降,膜通透性增加是细胞凋亡的早期特征。线粒体对JC-1的摄取依赖于跨膜电位,在膜电位正常的细胞,JC-1通过线粒体膜极性进入线粒体,浓度升高形成多聚体发射红色荧光;细胞凋亡时线粒体跨膜电位去极化,JC-1自线粒体内释出,浓度降低形成单体发射绿色荧光。通过检测红色和绿色荧光可以对线粒体膜电位的变化进行定量(细胞群荧光强度)和定性(细胞群偏移)检测。Caspase家族主要分为三大类:炎性反应介导因子、凋亡启动因子和凋亡执行因子,后两者在线粒体凋亡途径中起重要作用。凋亡启动因子包括Caspase-10、Caspase-9、Caspase-8等,能在其他蛋白辅助下活化并激活下游的凋亡执行因子Caspase-7、Caspase-6、Caspase-3等,其中的Caspase-3是Caspase家族中重要的凋亡执行者之一,是调控细胞凋亡的主要效应因子,其活化标志着凋亡进入不可逆性阶段。本研究结果显示,TRβΔ可降低线粒体膜电位,上调Caspase-3及Caspase-9基因表达同时促进Caspase-3及Caspase-9的活化,从而促进乳腺癌细胞的凋亡,且该作用明显受T3调控。这些表明TRβΔ可通过激活线粒体凋亡途径诱导乳腺癌SHZ-88细胞的凋亡。
综上所述,TRβΔ可抑制SHZ-88细胞的增殖并诱导其发生凋亡,为今后深入研究TRβΔ的肿瘤抑制功能提供了良好的实验基础。当然TRβΔ对肿瘤细胞的作用,可能还存在其他信号通路及各信号通路之间的复杂联系等,有待于我们今后重点研究。
| [1] | Ortiga-Carvalho TM, Sidhaye AR, Wondisford FE. Thyroid hormone receptors and resistance to thyroid hormone disorders[J]. Nat Rev Endocrinol, 2014, 10 (10) : 582–91. DOI:10.1038/nrendo.2014.143 |
| [2] | Sirakov M, Boussouar A, Kress E, et al. The thyroid hormone nuclear receptor TRα1 controls the Notch signaling pathway and cell fate in murine intestine[J]. Development, 2015, 142 (16) : 2764–74. DOI:10.1242/dev.121962 |
| [3] | Cheng SY, Leonard JL, Davis PJ. Molecular aspects of thyroid hormone actions[J]. Endocr Rev, 2010, 31 (2) : 139–70. DOI:10.1210/er.2009-0007 |
| [4] | Kim WG, Zhao L, Kim DW, et al. Inhibition of tumorigenesis by the thyroid hormone receptor β in xenograft models[J]. Thyroid, 2014, 24 (2) : 260–9. DOI:10.1089/thy.2013.0054 |
| [5] | Kim WG, Zhu X, Kim DW, et al. Reactivation of the silenced thyroid hormone receptor β gene expression delays thyroid tumor progression[J]. Endocrinology, 2013, 154 (1) : 25–35. DOI:10.1210/en.2012-1728 |
| [6] | Park JW, Zhao L, Webb P, et al. Src-dependent phosphorylation at Y406 on the thyroid hormone receptor β confers the tumorsuppre-ssor activity[J]. Oncotarget, 2014, 5 (20) : 10002–16. DOI:10.18632/oncotarget |
| [7] | Xie W, Zhao RL, Zhang Y, et al. The transactivation of thyroid hormone receptor βΔ on target genes through thyroid hormone responsive element[J]. Zhonghua Nei Fen Mi Dai Xie Za Zhi, 2011, 27 (4) : 335–6. [ 谢伟, 赵荣兰, 张莹, 等. 甲状腺激素受体TRβΔ通过TRE增强靶基因转录的研究[J]. 中华内分泌代谢杂志, 2011, 27 (4) : 335–6. ] |
| [8] | Zhao R, Peng X, Li Q, et al. Effects of phosphorylatable short peptide- conjugated chitosan-mediated IL-1Ra and igf-1 gene transfer onarticular cartilage defects in rabbits[J]. PLoS One, 2014, 9 (11) : e112284. DOI:10.1371/journal.pone.0112284 |
| [9] | De Sibio MT, de Oliveira M, Moretto FC, et al. Triiodothyronine and breast cancer[J]. World J Clin Oncol, 2014, 5 (3) : 503–8. DOI:10.5306/wjco.v5.i3.503 |
| [10] | Tosovic A, Bondeson AG, Bondeson L, et al. T3 levels in relation to prognostic factors in breast cancer: a population-based prospective cohort study[J]. BMC Cancer, 2014, 14 : 536. DOI:10.1186/1471-2407-14-536 |
| [11] | Wu WM, Zhang Y. Clinical study of the changes in expression of THRβ1 and thyroid hormone level in breast cance[J]. Lin Chuang He Shi Yan Yi Xue Za Zhi, 2014, 13 (18) : 1513–7. [ 吴万敏, 张艳. 乳腺癌中THRβ1表达与甲状腺激素改变的临床研究[J]. 临床和实验医学杂志, 2014, 13 (18) : 1513–7. ] |
| [12] | Sar P, Peter R, Rath B, et al. 3, 3'5 Triiodo L thyronine induces apoptosis in human breast cancer MCF-7 cells, repressing SMP30 expression through negative thyroid response elements[J]. PLoS One, 2011, 6 (6) : e20861. DOI:10.1371/journal.pone.0020861 |
| [13] | Ling YQ, Xu XY, Zhang Q, et al. Expression and clinical significance of TRβ1 gene mRNA in breast cancer[J]. Tianjin Yi Yao, 2010, 38 (12) : 1032–4. [ 令亚琴, 许小英, 张茜, 等. 乳腺癌组织中甲状腺受体β1基因表达及临床意义[J]. 天津医药, 2010, 38 (12) : 1032–4. ] |
| [14] | Ling Y, Ling X, Fan L, et al. Mutation analysis underlying the downregulation of the thyroid hormone receptor β1 gene in the Chinese breast cancer population[J]. Onco Targets Ther, 2015, 8 : 2967–72. |
| [15] | Ruiz-Llorente L, Martínez-Iglesias O, García-Silva S, et al. The thyroid hormone receptors as tumor suppressors[J]. Horm Mol Biol Clin Investig, 2011, 5 (2) : 79–89. |
| [16] | Macha MA, Matta A, Chauhan S, et al. 14-3-3 zeta is a moleculartarget in guggulsterone induced apoptosis in head and neck cancercells[J]. BMC Cancer, 2010, 10 : 655. DOI:10.1186/1471-2407-10-655 |
 2016, Vol. 43
2016, Vol. 43


