文章信息
- 纳米刀治疗不可切除结肠癌肝转移1例报道
- One Case Report of Ablation by Nano Knife on Unresectable Liver Metastases from Colon Cancer
- 肿瘤防治研究, 2016, 43(11): 1005-1007
- Cancer Research on Prevention and Treatment, 2016, 43(11): 1005-1007
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.11.017
- 收稿日期: 2016-04-02
- 修回日期: 2016-05-23
2. 430079 武汉,湖北省肿瘤医院胸部放疗科
2. Department of Thoracic Radiotherapy,Hubei Cancer Hospital,Wuhan 430079,China
对于肝转移灶不可切除的结直肠癌患者,如果化疗后可能转化为潜在可切除,继而行手术切除,可以获得最大生存收益[1],而仍有部分患者因肝内病灶侵犯重要血管,转化治疗后仍然不能采用手术完整切除结直肠癌肝转移病灶。现报道1例湖北省肿瘤医院利用纳米刀技术成功根治因侵犯肝内重要血管而导致手术不可切除的结肠癌肝转移病灶,以供同行们学习交流。
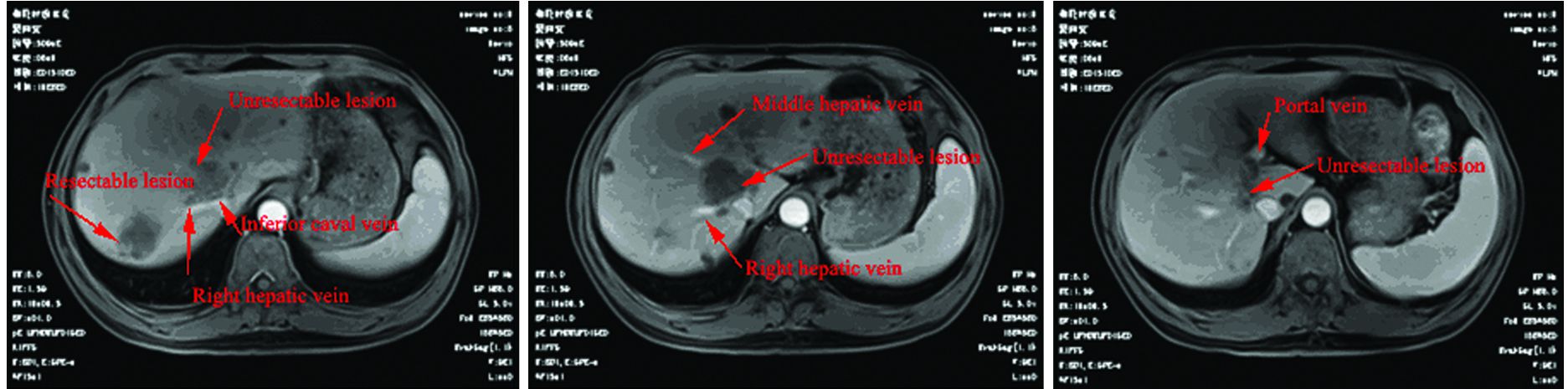
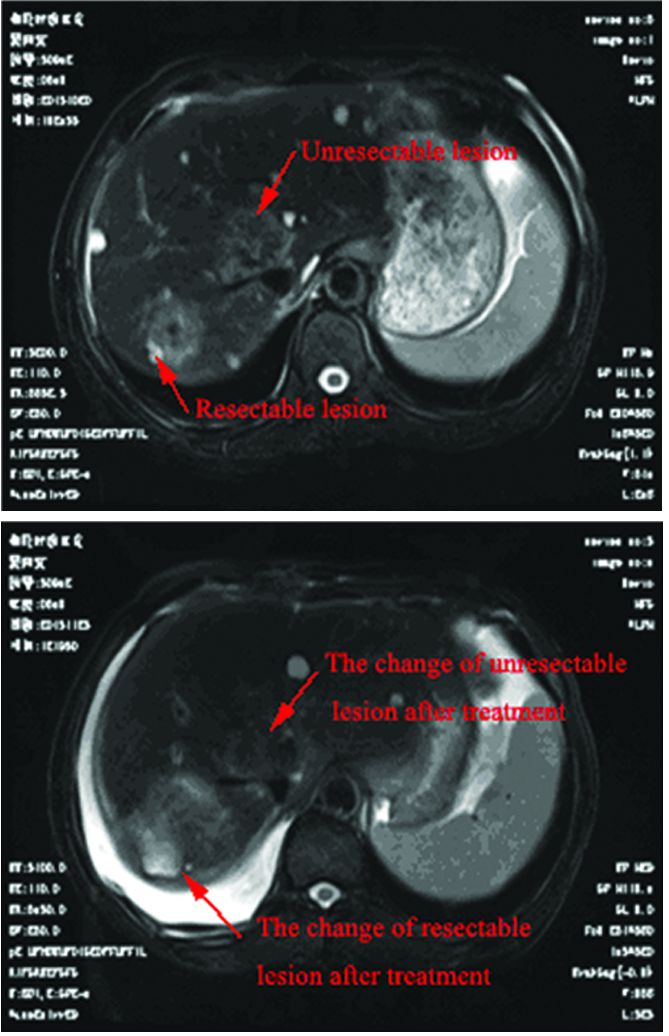
1 临床资料患者,男,63岁,主诉:右下腹间断腹痛2月余,伴发结肠占位病变4天,于2015年04月收治于湖北省肿瘤医院胃肠科。入院检查:结肠镜示:升结肠近肝曲处可见溃疡型肿块;活检病理:腺癌。基因检测KRAS可见突变。CT检查示:右半结肠癌(约5.4 cm×3.9 cm)累及周围脂肪间隙、右侧腹膜,并周围肠系膜多发淋巴结肿,肝内多发转移瘤(最大者长径约3.8 cm),肝内多发囊肿,诊断为结肠癌肝转移,cT4NXM1 Ⅳ期。肝脏有两个转移病灶,一个位于肝脏右后叶,为可切除病灶,另一个位于肝脏右前叶,包绕肝内多处血管(包绕肝中静脉、肝右静脉根部,并侵犯部分门静脉右支及下腔静脉),为不可切除的肝转移病灶,见图 1。患者于2015年04月接受FOLFOX4方案化疗3周期,无特殊化疗反应。6月17日开始出现右腹部疼痛,行腹部CT可见肿瘤破溃突入腹壁,提示肠穿孔,给予输血、抗感染、静脉营养、补液等对症支持治疗后,患者全身状况好转,于6月23日在全麻下行剖腹探查+右半结肠癌切除术,术后病检示:(右半结肠肿瘤)中分化管状腺癌,侵透肠壁全层达浆膜下纤维脂肪组织;未侵犯脉管和神经;上、下切缘系膜切缘未见癌组织。阑尾未见明显异常。肠系膜淋巴结(1/14枚)转移癌;右腰大肌肿块见癌组织累及。诊断为结肠癌肝转移分期pT4N1M1 Ⅳ期。患者术后继续接受FOLFOX4方案化疗2周期,2015年09月06日,复查腹部CT:肝脏多发转移瘤较前增大(最大者长径约4.8 cm)。因患者肝内两处转移灶较前增大,疗效评估为PD,转入肝胆胰科,9月25日行经皮动脉造影肝脏肿瘤化学灌注(奥沙利铂100 mg)及栓塞术联合肝动脉置泵术,并于2015年10月24日行肝右前叶肿瘤纳米刀消融术、肝右后叶肿瘤切除术、胆囊切除术。术后病理显示为中分化管状腺癌。患者2015年11月住院复查CT可见肝右叶团片状影,未见明显强化,考虑术后改变,建议复查,行肝动脉灌注化学治疗(顺铂10 mg+氟尿嘧啶0.25 g,d1~10)。患者于2016年01月02日再次住院复查MRI依旧报告为:可见肝右叶团片影,考虑术后改变(肝内病灶手术前后MRI表现),见图 2。给予FOLFIRI全身化疗3周期,最后随访时间为2016年3月,疾病无进展。
|
| 图 1 结肠癌肝转移病灶侵犯血管情况 Figure 1 Situation of vessels invaded by liver metastases from colon cancer |
|
| 图 2 结肠癌肝转移病灶治疗前后MRI改变 Figure 2 MRI of liver metastases from colon cancer before and after treatment |
患者特征及诊疗原则对于因肝内转移灶侵犯血管而导致肝脏肿瘤不可切除的结肠癌肝转移患者,转化治疗未能成功缩小侵犯血管的肝内转移灶,手术及以往微创技术不能达到根治肿瘤目的,纳米刀技术能弥补既往治疗手段的不足,成功根治肝内病灶。患者初诊是结肠癌伴同时性肝转移,无肝外转移,肝内转移灶两处,一处肿瘤可实施手术切除,一处肿瘤包绕肝中静脉及肝右静脉根部,并侵犯部分门静脉右支及下腔静脉,为不可切除病灶。根据2012年ESMO结直肠癌专家共识推荐[2],患者肝内病灶为潜在可切除组,即肝转移灶初始难以达到R0切除,经过化疗(或联合靶向治疗)可达到R0切除。患者首先给予3周期FOLFOX4全身化疗,肝内病灶稳定,但出现肠穿孔,给予急诊原发灶切除。术后继续2周期FOLFOX4化疗,但患者肝内病灶持续进展,包绕肝中、右静脉并与肝Glisson右支系统关系密切。对于转化治疗失效的患者,再次根据2012年ESMO结直肠癌专家共识,此患者属于多发转移,肿瘤进展迅速,和(或)有肿瘤相关症状组,共识推荐的目标则是尽快缩小瘤体,控制疾病进展,因此建议采用积极的、至少双药联合的治疗,但同时患者也将会失去根治的机会。只有通过根治肝内病灶,才能获得最大生存收益,我们的MDT团队认真评估后,认为此患者不能根治的原因主要是肝内病灶广泛侵犯血管,并非肝内广泛多发转移,建议采用目前最先进的纳米刀消融技术根治侵犯肝内重要血管的肝内病灶,同时切除肝内可切除的病灶。根据目前随访结果,患者根治效果满意。
目前根治性手术切除肝内转移灶仍是结肠癌肝转移患者获得长期生存甚至治愈的最佳方法。对于直径<3 cm的结直肠癌肝转移病灶,射频消融、微波消融及氩氦冷冻消融等传统消融也可以达到接近手术切除的效果。但是对于肿瘤数量过多、直径较大或肿瘤位置临近肝内重要血管及胆管的患者,传统消融是不适宜的。纳米刀,又称不可逆电穿孔技术,利用电脉冲永久损害靶区内细胞膜双磷脂层,导致肿瘤细胞死亡。它是一种可以只选择性的破坏肿瘤组织,而正常组织结构几乎不受影响的肿瘤消融技术[3]。其具有以下优势:消融时间短;保留治疗区域重要血管、神经组织;治疗边界清楚,且不会因消融周边热量散失而导致肿瘤复发;术中可显示未被消融病灶,治疗效果可实时监控;治疗区域可恢复正常功能。纳米刀可以安全地围绕肝门周围的肝组织消融,且不会附带损害胆管、肝动脉和门静脉,也没有发现常规物理消融中“热沉降”导致的不完全消融。在结直肠癌肝转移患者中,对于因侵犯血管而导致的不可手术切除的肝转移病灶,纳米刀治疗的主要优点在于既可以不损伤肿瘤侵犯的血管,同时又能完整消融肝内肿瘤,从而将使更多结直肠癌肝转移患者达到根治目的。
纳米刀作为一种先进、安全且有效的消融方法,弥补了现存传统微创消融技术的不足。在本例报道中,对于包绕血管不适合手术切除的结肠癌肝转移灶,介入治疗局部控制病灶后,及时把握手术时机,联合手术及纳米刀局部治疗,从而根治肝内病灶。
在此患者的诊治中,多学科诊治团队也有以下探讨:(1)此患者在转化治疗中是否能在安全的前提下早期选用有效率较高的方案,比如FOLFOXTRI或靶向药物联合传统化疗方案;(2)患者转化治疗失败后,根据2012年ESMO结直肠癌专家共识,此患者属于多发转移,肿瘤进展迅速,和(或)有肿瘤相关症状组,共识推荐的目标则是尽快缩小瘤体,控制疾病进展,因此建议采用积极的至少是双药联合治疗,是否此时可以选择分子靶向联合传统化疗方案?(3)患者转化治疗后肝转移灶增大,病情进展,包绕肝内重要血管,是否可选择手术切除可切除病灶联合放射疗法治疗不可切除病灶,或者选用同步放化疗治疗?首先,转化治疗应在保证安全的前提下,选择分子靶向药物与传统化疗方案的联合应用方案,联合靶向治疗确实有助于提高转化率[4]。但对于KRAS基因突变型的患者,氟尿嘧啶/奥沙利铂联合贝伐珠单抗与单纯基础化疗相比,反应率并未提高,切除率的增加亦无显著意义[5]。加之靶向治疗在国内未能被广大患者在经济上接受,我们选用的传统化疗方案也未能成功转化,丧失其手术切除的机会。其次,放射治疗对于位置较深,包绕血管的肝转移灶具有良好的适应证,但是放射治疗也有放射敏感度的个体化差异。另外,虽然此病例纳米刀消融肝内病灶近期效果满意,但长期疗效仍需随访及大样本数据支持。纳米刀作为一种新兴、安全、有效的消融技术,具有选择性的优势,在结直肠癌肝转移的局部治疗中,尤其是包绕肝内重要血管的病灶,具有传统消融技术及手术不可替代的优势,此技术丰富了结直肠癌肝转移综合治疗手段,有助于进一步拓展其多学科诊治的思路。
| [1] | Zhu DX, Ren L, Xu JM, et al. Consideration of therapy for colorectal cancer with synchronous unresectable liver metastasis[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2013, 16 (8) : 718–20. [ 朱德祥, 任黎, 许剑民, 等. 伴有同时性不可切除肝转移的结直肠癌患者治疗的思考[J]. 中华胃肠外科杂志, 2013, 16 (8) : 718–20. ] |
| [2] | Adam R, De Gramont A, Figueras J, et al. The oncosurgery approach to managing liver metastases from colorectal cancer: a multidisciplinary international consensus[J]. Oncologist, 2012, 17 (10) : 1225–39. DOI:10.1634/theoncologist.2012-0121 |
| [3] | Rubinsky B, Onik G, Mikus P. Irreversible electroporation: a new ablation modality-clinical implications[J]. Technol Cancer Res Treat, 2007, 6 (1) : 37–48. DOI:10.1177/153303460700600106 |
| [4] | Specialty Committee of Colorectal Cancer,Chinese Association of Anti-cancer. Treatment of the colorectal cancer liver metastasis into targeted drugs reasonable application of the expert guidance[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2013, 16 (10) : 1000–4. [ 中国抗癌协会大肠癌专业委员会专家组. 结直肠癌肝转移转化治疗中靶向药物合理应用的专家指导意见[J]. 中华胃肠外科杂志, 2013, 16 (10) : 1000–4. ] |
| [5] | Douillard JY, Siena S, Cassidy J, et al. Randomized,phase Ⅲ trial of panitumumab with infusional fluorouracil,leucovorin,and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study[J]. J Clin Oncol, 2010, 28 (31) : 4697–705. DOI:10.1200/JCO.2009.27.4860 |
 2016, Vol. 43
2016, Vol. 43
