文章信息
- 结直肠癌组织中DNA结合分化抑制蛋白1和MMP-9的表达及其与LMVD的相关性
- Expression and Correlation Studies of Id-1, MMP-9, and LMVD in Colorectal Adenocarcinoma Tissues
- 肿瘤防治研究, 2016, 43(11): 959-963
- Cancer Research on Prevention and Treatment, 2016, 43(11): 959-963
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.11.008
- 收稿日期: 2016-07-02
- 修回日期: 2016-09-09
2. 075000 张家口,河北北方学院附属第一医院超声医学科;
3. 075000 张家口,河北北方学院附属第一医院病理科
2. Department of Ultrasound,The First Affiliated Hospital of Hebei North University,Zhangjiakou 075000,China;
3. Department of Pathology,The First Affiliated Hospital of Hebei North University,Zhangjiakou 075000,China
淋巴管浸润和淋巴结转移是结直肠癌患者预后较差的重要原因之一,新生淋巴管是肿瘤淋巴道转移的基础和前提[1-2]。DNA结合分化抑制蛋白1(inhibitors of DNA binding-1,Id-1)是近年来研究较热门的致癌基因,能促进细胞增殖,诱导肿瘤血管内皮生成,促进肿瘤的生长及侵袭,其表达的缺失、沉默与肺癌、胃癌、胰腺癌、宫颈癌等多种恶性肿瘤发生、发展及预后密切相关[3-6]。MMP-9能够降解细胞外各型胶原、层粘连蛋白、蛋白聚糖等,诱导肿瘤细胞突破基底膜致其浸润,参与肿瘤脉管形成[7-8]。D-240特异性表达于肿瘤微淋巴管细胞,在血管内皮细胞中几无表达,因而D-240能准确监测癌组织内的微淋巴管密度(lymphatic microvessel density,LMVD),反映肿瘤淋巴管新生状况。本实验通过对结直肠癌组织中Id-1、MMP-9和LMVD行免疫组织化学分析,探讨三者与结直肠癌临床相关病理的联系及其相关性,为探索结直肠癌演进、淋巴结转移的机制及抗淋巴管浸润治疗提供科学依据。
1 资料与方法 1.1 资料来源收集2013年5月1日—2014年5月31日河北北方学院附属第一医院血管腺体外科手术切除的原发性结直肠癌组织50例、癌旁正常组织50例,癌组织取自癌灶中心处,另取标本残端切缘经病理证实的正常结直肠组织,术前均未行新辅助放化疗等针对性治疗。其中男32例、女18例,年龄33~71(51±2.9)岁。
1.2 免疫组织化学染色方法及试剂兔抗人单克隆浓缩型Id-1抗体、鼠抗人浓缩型MMP-9单克隆抗体均购于英国Abcam公司;D-240抗体购于美国Abnova公司。10%甲醛溶液固定部分标本,石蜡包埋,切片厚度为4 µm,苏木精-伊红(hematoxylin-esin,HE)染色,80℃烤箱烤片,乙醇脱水,灭活内源性过氧化物酶,枸橼酸缓冲液高温高压水化修复;PBS冲洗3次,加一抗,4℃过夜;PBS洗3次,加二抗。室温下DAB显色,苏木精轻度对比染色,并用1%的盐酸乙醇分化5 min、流水冲洗5 min、梯度乙醇脱水(80%、85%、90%、95%、100%、100%)及二甲苯透明,干燥,最后树胶封片。阴性对照为PBS代替一抗。
1.3 Id-1、MMP-9阳性判定标准Id-1和MMP-9均以细胞质中出现棕黄色颗粒为阳性表达,根据着色细胞占视野细胞总数的百分比及着色细胞染色强弱评分≤5%为0分,5%~25%为1分,>25%~50%时为2分,>50%~75%时为3分,>75%时为4分;阴性:0分;弱(+):1分;中(++ ):2分;强(+++):3分。两者相乘,0分为(-),1~4分为(+),5~8分为(++),9~12分为( +++),(+)~(+++)均视为阳性。
1.4 微淋巴管密度检测应用D-240抗体标记染色于肿瘤微淋巴管内皮细胞的胞质,以孤立的单个棕黄色内皮细胞或内皮细胞簇作为微淋巴管并计数;先在40倍光学显微镜下选出4个脉管最密集的区域(即富集热点区),后换200倍光学显微镜下将着色的内皮细胞区计为观察区,计数取其平均值即为LMVD值。
1.5 统计学方法运用SPSS17.0统计软件统计并分析数据,用百分率表示计数资料,运用χ2检验表示Id-1和MMP-9的表达与临床病理参数关系,用(x±s)表示计量资料,运用t检验表示LMVD值与临床病理参数的关系,相关性分析采用Spearmen检验,设α=0.05为检验水准。
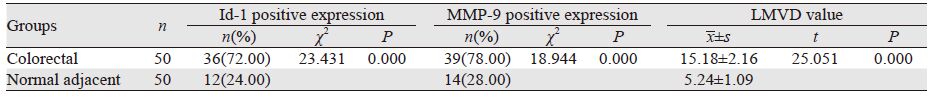
2 结果 2.1 Id-1和MMP-9在结直肠癌中的表达及LMVD值Id-1在结直肠癌组织中的阳性表达72.00%(36/50)明显高于癌旁组织24.00%(12/50),两者比较差异有统计学意义(χ2=23.431,P=0.000); MMP-9在结直肠癌组织中的阳性表达为78%(39/50),明显高于癌旁组织28.00%(14/50),两者比较差异有统计学意义(χ2=18.944,P=0.000);结直肠癌组织中LMVD表达(15.18±2.16)明显高于癌旁组织(5.24±1.09),两者比较差异有统计学意义(t=25.051,P=0.000),见图 1,表 1。
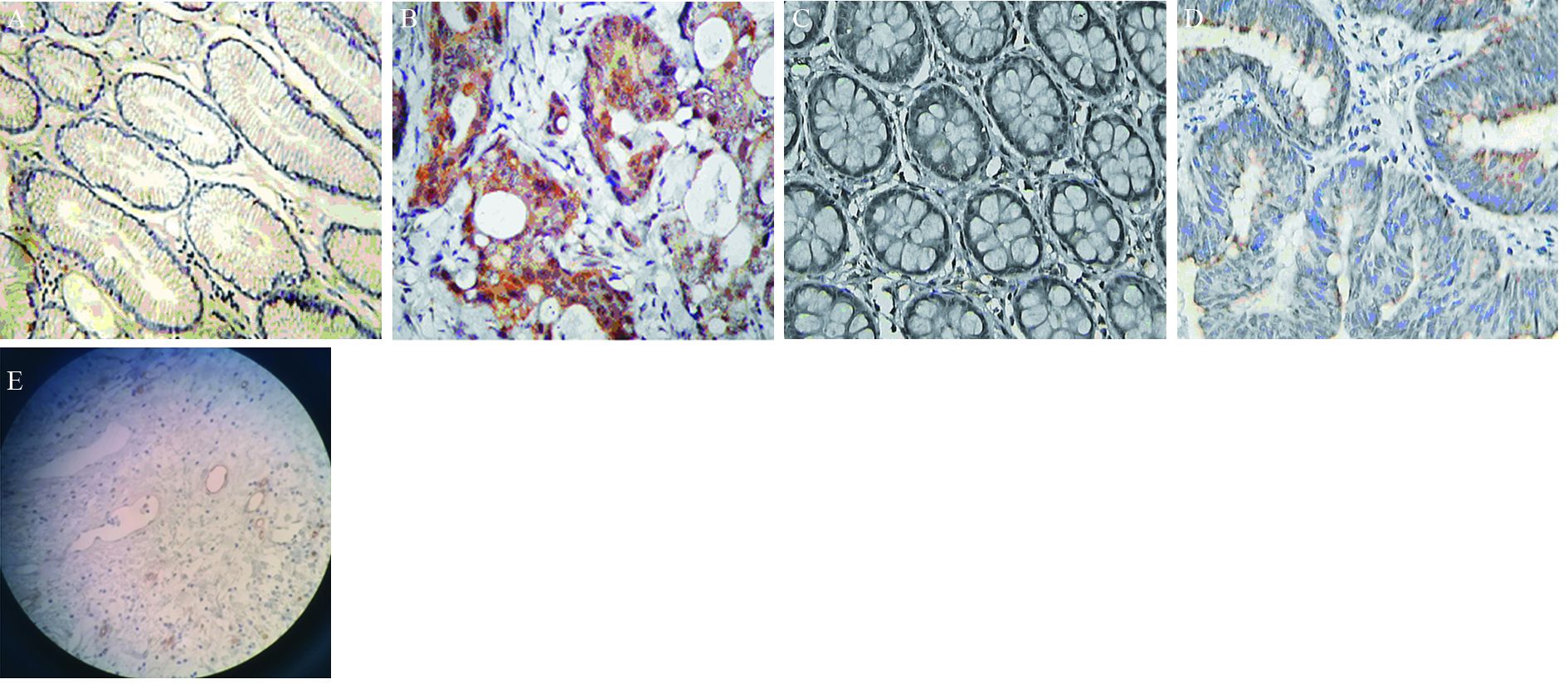
|
| A: positive expression of Id-1 in colorectal normal adjacent tissues; B: positive expression of Id-1 in colorectal carcinoma tissues; C : positive expression of MMP-9 in colorectal normal adjacent tissues; D: positive expression of MMP-9 in colorectal carcinoma tissues; E: positive expression of LMVD markd by D-240 in colorectal carcinoma tissues (IHC ×200) 图 1 免疫组织化学法检测Id-1、MMP-9在结直肠癌癌旁与癌组织中的表达和LMVD Figure 1 Expression of Id-1,MMP-9 and LMVD in colorectal normal adjacent and colorectal tissues detected by IHC method |
|
Id-1、MMP-9表达水平和LMVD均与肿瘤浆膜浸润、TNM分期、淋巴结转移、肝转移、脉管浸润、CEA(+)等相关(均P<0.01),见表 2。

|
结直肠癌中Id-1阳性者36例,其LMVD值(18.26±3.14);Id-1阴性者14例,其LMVD值(10.09±3.03),两者比较差异有统计学意义(t=18.511,P=0.000);结直肠癌中MMP-9阳性者39例,其LMVD值(19.11±3.20);MMP-9阴性者11例,其LMVD值(9.21±3.05),两者比较差异有统计学意义(t=21.770,P=0.000)。
2.4 Id-1和MMP-9在结直肠癌中表达的相关性Id-1和MMP-9在结直肠癌中的表达呈明显的正相关关系(r=0.429,P<0.01),见表 3。
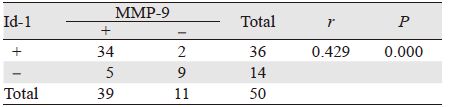
|
Id-1系螺旋-环-螺旋(helix-loop-helix,HLH)转录因子家族重要成员,在正常组织中呈低表达或不表达状态,而在恶性肿瘤及体外培养的肿瘤细胞系中均呈高表达趋势,且与肿瘤的恶性度及患者的预后相关[9]。大多数HLH结构存在一个碱性HLH(bHLH)因子与其紧密相邻,两者相互结合形成异质二聚体,其碱性因子所处区域与目标DNA结合,诱导启动子中的E-盒样结构的靶基因转录并整合成所谓的“E-box”DNA序列,从而调控细胞增殖分化。而Id-1无碱性结构域,与bHLH因子结合生成的二聚体无转录功能,因而无法与目标DNA序列结合,从而抑制细胞分化增殖[10-11]。Cheung等[12]研究报道Id-1表达上调能激活Raf-1及MAPK激酶信号转导途径、抑制细胞凋亡、参与肿瘤发生发展。Lee等[13]研究发现,Id-1还可通过磷酸化抑制Rb途径并阻断p16(INK4a)表达,从而促进G1/S期细胞增殖。
肿瘤的浸润转移是多因素、多步骤参与的复杂过程,其中细胞基质的降解和破坏是肿瘤淋巴道和血行转移的关键步骤。MMP-9作为一种特异性极高血管内皮分裂原,对肿瘤脉管形成及肿瘤恶性生物学行为均有非常重要的影响。Redondo-Munoz等[14]研究显示MMP-9能通过降解细胞外基质使癌细胞呈阿米巴运动方式穿过基质膜缺损处迁移至内皮细胞进入淋巴管腔内,促进淋巴道转移;魏礼清、黄榕权等[15-16]对胰腺癌和浸润性乳腺癌组织研究显示MMP-9能通过裂解细胞外基质,诱导淋巴管内皮细胞迁移从而促进微淋巴管形成,且由于新生淋巴管内皮较薄,基底膜不完整,因而癌细胞易于进入淋巴管道,致淋巴结转移。
本研究显示Id-1和MMP-9在结直肠癌组织中表达明显高于癌旁组织,且与肿瘤的浆膜浸润、TNM分期、淋巴结转移、肝转移及脉管浸润等密切相关,支持Id-1和MMP-9促进肿瘤恶性生物学进展的理论,这与胡斌等[17]研究一致。 LMVD是评价肿瘤微淋巴管生成重要指标,能够准确反映肿瘤微淋巴管生成状况,本实验表明结直肠癌组织中LMVD表达明显高于癌旁组织,同时Id-1和MMP-9在结直肠癌中的表达呈正相关性,且与LMVD亦存在明显的正相关性,进一步说明Id-1和MMP-9在参与结直肠癌变发生发展过程中具有协同作用,Id-1的高异常表达能激活MMP-9,释放促脉管生成的自分泌信号,诱导形成新生的脉管内皮细胞,从而促进肿瘤的淋巴道转移,这与徐健、Georgiadou等[18-19]研究基本一致。且有研究[20]表明 Id-1能通过上调VEGF的表达诱导肿瘤微血管的生成,促进结直肠癌血行转移。Fong等[21]对伴转移的乳腺癌细胞的研究发现抑制Id-1的表达,MT1-MMP表达水平也随之下调,癌细胞的侵袭能力亦明显降低,表明Id-1通过诱导MMP蛋白的表达,诱导微淋巴管形成,发挥促进肿瘤淋巴道转移的作用。
总之,Id-1的异常表达参与结直肠癌的发生演进,并与淋巴结转移等恶性生物学行为密切相关,但本研究仅限于分子蛋白水平,未能从基因水平及其致癌的具体机制进行深入研究,这亦是本课题今后的努力方向。
| [1] | Wang JP. New Focus of Clinical Research on Colorectal Cancer Treatment[J]. Zhonghua Wai Ke Za Zhi, 2014, 52 (11) : 801–2. [ 汪建平. 结直肠癌治疗临床研究新热点[J]. 中华外科杂志, 2014, 52 (11) : 801–2. ] |
| [2] | Yao HW, Liu YH. 2011 Update Interpretation of NCCN Colorectal Cancer Clinical Practice Guidelines[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2011, 14 (4) : 234–7. [ 姚宏伟, 刘荫华. NCCN结直肠癌临床实践指南2011年更新解读[J]. 中华胃肠外科杂志, 2011, 14 (4) : 234–7. ] |
| [3] | Fu JK, Wu QF, Zhang Y. Expression of inhibitor of differentiation protein 1 in tumor spheres of human lung cancer cell line A549[J]. Xian Dai Zhong Liu Xue, 2012, 20 (12) : 2843–5. [ 付军科, 吴齐飞, 张勇. Id1在人肺癌细胞系A549肿瘤细胞球中的表达[J]. 现代肿瘤学, 2012, 20 (12) : 2843–5. ] |
| [4] | Zhu B, Song C, Wang P. Expression and clinical significance of ID1 in gastric cancer[J]. Shanghai Jiao Tong Da Xue Xue Bao (Yi Xue Ban), 2013, 33 (3) : 298–301. [ 朱博, 宋超, 王萍. IDl蛋白在胃癌组织中的表达及临床意义[J]. 上海交通大学学报(医学版), 2013, 33 (3) : 298–301. ] |
| [5] | Li J, Xie L, Gan X, et al. Association of inhibitor of differentiatio 1 expression with human papillomaviruses infections in cervical carcinoma[J]. Int J Gynecol Cancer, 2011, 21 (7) : 1276–81. |
| [6] | Georgiadou D, Sergentanis TN, Sakellariou S, et al. MMP-9 and Id-1 in pancreatic adenocarcinoma: prognostic significance and impact on angiogenesis[J]. Eur J Surg Oncol, 2014, 40 (10) : 1331–7. DOI:10.1016/j.ejso.2014.01.004 |
| [7] | Vandooren J, Van den Steen PE, Opdenakker G. Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9(MMP-9): the next decade[J]. Crit Rev Biochem Mol Biol, 2013, 48 (3) : 222–72. DOI:10.3109/10409238.2013.770819 |
| [8] | Wang Y, Qiu HF, Hu WX, et al. Over-expression of platelet-derived growth factor-d promotes tumor growth and invasion in endometrial cancer[J]. Int J Mot Sci, 2014, 15 (3) : 4780–94. DOI:10.3390/ijms15034780 |
| [9] | Guo Y. Expression of ID-1 and its relations with Ki-67 and VEGF in rectal cancer[J]. Zhongguo Pu Tong Wai Ke Za Zhi, 2012, 21 (1) : 81–4. [ 郭云. ID-1在直肠癌中的表达及其与Ki-67和VEGF的关系[J]. 中国普通外科杂志, 2012, 21 (1) : 81–4. ] |
| [10] | Ma LJ, He JC, Cai ZY. Expression of inhibitor of differentiation -1 in cervical cancer tissues and its correlation with Ki-67[J]. Zhongguo Lin Chuang Yao Li Xue, 2015, 31 (8) : 627–30. [ 马莉娟, 何金彩, 柴泽英. 细胞分化抑制因子-1与细胞增殖核抗原Ki-67在宫颈癌中的表达及相关性研究[J]. 中国临床药理学, 2015, 31 (8) : 627–30. ] |
| [11] | Liu XJ, Wang XL, Feng JG. The relationship between Id-1,VEGF as well as microvessel density and blood loss in spinal metastasis surgery and tumor origin[J]. Zhongguo Ji Zhu Ji Sui Za Zhi, 2012, 22 (8) : 678–81. [ 刘旭剑, 王小玲, 冯建刚. Id-1,VEGF及微血管密度与脊柱转移瘤术中出血量及肿瘤来源间的关系[J]. 中国脊柱脊髓杂志, 2012, 22 (8) : 678–81. ] |
| [12] | Cheung HW, Ling MT, Tsan SW, et al. Id-l-induced Raf/MEK pathway activation is essential for its protective role against taxol-induced apoptosis in nasopharyngeal carcinoma cells[J]. Carcinogenesis, 2004, 25 (6) : 881–7. DOI:10.1093/carcin/bgh087 |
| [13] | Lee TK, Man K, Ling MT, et al. Over-expression of Id-l induces cell proliferation in hepatocellular carcinoma tllmugh inactivation of pl6INK4a/RB pathway[J]. Carcinogenesis, 2003, 24 (11) : 1729–36. DOI:10.1093/carcin/bgg145 |
| [14] | Redondo-Munoz J, Jose Terol M, Garcia-Marco JA, et al. Matrix metalloproteinase-9 is upregulated by CCL2/CCR7 interaction via extracelluar signal-regulated kinase-1/2 signaling and is involved in CCL21-driven B cell chronic lymphocytic leukemia cell invasion and migration[J]. Blood, 2008, 111 (1) : 383–6. DOI:10.1182/blood-2007-08-107300 |
| [15] | Wei LQ, Xiang CX, Liu SY, et al. Expression and significance of epidermal growth factor receptor and matrix metalloproteinase-9 in pancreatic carcinoma tissues[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41 (7) : 799–802. [ 魏礼清, 向春香, 刘水逸, 等. 胰腺癌组织中表皮生长因子受体、基质金属蛋白酶9的表达及其意义[J]. 肿瘤防治研究, 2014, 41 (7) : 799–802. ] |
| [16] | Huang RQ, Xie YQ, Zhang YJ, et al. Expression of MMP-2,MMP-9,and VEGF-D in breast cancer and its relationship with tumor lymphatic[J]. Guangdong Yi Xue, 2014, 35 (13) : 2072–4. [ 黄榕权, 谢燕清, 张雅洁, 等. MMP-2、MMP-9和VEGF-D在乳腺癌中的表达及其与肿瘤淋巴管新生的关系[J]. 广东医学, 2014, 35 (13) : 2072–4. ] |
| [17] | Hu B, Chen ZH, Chen ZK, et al. Expression and correlation of Id-1 and MMP-9 in human colorectal carcinoma[J]. Zhongguo Xian Dai Yi Xue Za Zhi, 2010, 20 (17) : 2630–3. [ 胡斌, 陈子华, 陈志康, 等. Id-1和MMP-9在人大肠癌组织中的表达及相关性研究[J]. 中国现代医学杂志, 2010, 20 (17) : 2630–3. ] |
| [18] | Xu J, Xiang HG, Yi W, et al. Study of correlation between nm23 and MMP-9 expression with lymph node metastasis ratio in colon carcinoma patients[J]. Shandong Yi Xue, 2012, 52 (44) : 29–31. [ 徐健, 项洪刚, 易伟, 等. nm23和MMP-9表达与结肠癌淋巴结转移比率相关性研究[J]. 山东医药, 2012, 52 (44) : 29–31. ] |
| [19] | Georgiadou D, Sergentanis TN, Sakellariou S, et al. VEGF and Id-1 in pancreatic adenocarcinoma: Prognostic significance and impact on angiogenesis[J]. EJSO, 2014, 40 (10) : 1331–7. DOI:10.1016/j.ejso.2014.01.004 |
| [20] | Wu XL, Wang LK, Xue J, et al. Correlation of expressions of DNA binding differentiation inhibitory proteins-1 and vascular endothelial growth factor with its microvascular generation[J]. Zhongguo Lin Chuang Yao Li Xue Za Zhi, 2016, 32 (5) : 430–6. [ 武雪亮, 王立坤, 薛军, 等. DNA结合分化抑制蛋白1和血管内皮生长因子的表达及其与肿瘤微血管生成的相关性研究[J]. 中国临床药理学杂志, 2016, 32 (5) : 430–6. ] |
| [21] | Fong S, ItahanaY, Sumida T, et al. Id-1 as a molecular target in therapy for breast cancer cell invasion and metastasis[J]. Proc Natl Acad Sci U S A, 2003, 100 (23) : 13543–8. DOI:10.1073/pnas.2230238100 |
 2016, Vol. 43
2016, Vol. 43


