文章信息
- 四种肝(癌)细胞系糖代谢的流量解析
- Glucose Metabolic Flux of Four Liver (Hepatoma) Cell Lines
- 肿瘤防治研究, 2016, 43(11): 942-947
- Cancer Research on Prevention and Treatment, 2016, 43(11): 942-947
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.11.005
- 收稿日期: 2016-01-13
- 修回日期: 2016-03-31
原发性肝细胞癌(hepatocellular carcinoma,HCC)是临床上最常见的恶性肿瘤之一,其总发病率及死亡率分别居全球恶性肿瘤疾病的第五位和第三位[1]。HCC发展到一定程度很容易侵犯门静脉,从而形成门静脉癌栓(portal vein tumor thrombus,PVTT),是影响HCC预后的主要因素之一[2]。肿瘤相关的能量调节与能量代谢异常已经作为肿瘤治疗的生化途径和药物靶点,受到越来越多的关注。而癌症也越来越被视为一种代谢相关疾病,尤其是有氧糖酵解异常激活(温伯格效应)、 线粒体氧化磷酸化受到抑制在癌症中的研究已经比较成熟[3]。但是对于HCC细胞,尤其是PVTT细胞如何通过代谢重构促进肿瘤的生长与转移,还有待于进一步研究。因此本文通过稳定同位素的标记实验,利用多种代谢物同位素分布信息比较正常肝细胞、不同转移能力的HCC细胞以及PVTT细胞在糖代谢关键代谢节点的流量比率,进行基于流量比率的代谢流量解析,以期从代谢层面对HCC及PVTT发生发展过程中的可能代谢变化与分子机制进行探索。
1 材料与方法 1.1 细胞系永生化的正常肝细胞系HL-7702(以下简称7702),肝细胞癌细胞系SMMC-7721(以下简称7721)、HCCLM3(以下简称LM3)均来自中国科学院细胞库,肝癌门静脉癌栓细胞系CSQT2来自上海东方肝胆外科医院[4],由本实验室传代保存。
1.2 仪器与试剂气相色谱-质谱联用仪(GC-MS)购自日本岛津公司,型号为SHIMADZU QP2010 Ultra,气相色谱柱型号为Agilent DB-5MS(柱长30 m,内径0.25 mm,液膜厚度0.25 μm)。DMEM培养液、Antibiotic-Antimycotic(×100)(美国Hyclone公司),胎牛血清(美国Gibco公司),TRIzol(美国Invitrogen公司);Transwell小室(美国Corning Costar公司);MTT、小分子代谢物的提取及衍生试剂等均购自美国Sigma公司。
1.3 方法 1.3.1 细胞培养及稳定同位素标记实验标记实验共分为13C同位素标记的葡萄糖(glucose)及13C同位素标记的谷氨酰胺(glutamine)两种。肝细胞系(7702、7721、LM3、CSQT2)以大约1×106个的细胞铺到每个10 cm2皿中。对于13C同位素标记的葡萄糖为培养液的实验,待细胞贴壁后,先用DMEM完全培养液培养约24 h,之后换成含1 g/L (U-13C)葡萄糖(即葡萄糖的6个C原子都是13C)和1 g/L非标记葡萄糖,2 mmol/L L-谷氨酰胺的标记培养液继续培养。12 h后每皿细胞先收集培养液,再用PBS缓冲液清洗,之后胰酶消化并离心收集细胞。对于13C同位素标记的谷氨酰胺为培养液的实验,待细胞贴壁后,先用DMEM完全培养液培养24 h,之后换成含2 mmol/L(U-13C)谷氨酰胺(即谷氨酰胺的5个C原子都是13C)和2 g/L葡萄糖的标记培养液继续培养。6 h后每皿细胞先收集培养液,再用胰酶消化并离心收集细胞。收集好的细胞,用1 ml PBS缓冲液重悬,取出100 μl细胞悬液用于测定蛋白质含量,剩余细胞悬液离心沉淀后用于GC-MS检测分析。
1.3.2 细胞与培养液的代谢物提取与衍生化在细胞中加入600 μl 50%甲醇溶液,涡旋振荡1 min后置于干冰中30 min。之后冰上解冻,12 000 r/min离心10 min(4℃),将上清液转移至新的离心管。在沉淀中加入300 μl氯仿,涡旋振荡1 min,置于冰上,重复5次,离心后合并上清液,冷冻干燥。取100 μl培养液,加入500 μl 50%甲醇溶液,涡旋振荡1 min后加入400 μl氯仿,再涡旋振荡1 min,离心后将上清液冷冻干燥。再将干燥的细胞与培养液提取物进行衍生化以进行GC-MS的检测。用吡啶配20 mg/ml O-isobutylhydroxylamine hydrochloride(TCI,日本)作为保护剂,冷冻干燥后的样品中每管加入60 μl,85℃加热20 min;冷却后每管加入40 μl衍生剂N-tert-Butyldimethylsilyl-N- methyltrifluoroacetamide(Sigma,美国),85℃加热1 h。离心,将上清液转移到GC-MS的进样瓶中。
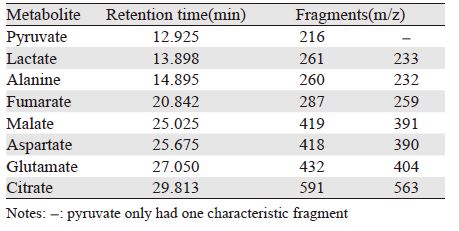
1.3.3 GC-MS对糖代谢小分子的检测及数据处理仪器参数设定及数据处理参照文献[5]的方法并加以改进。GC进样口温度为250℃,流量控制模式为恒线速度模式,压力为193.7 kpa。总运行时间为32 min,柱温箱起始温度为100℃,柱温程序见表 1。离子源温度为230℃,接口温度为300℃,检测器电压为调谐电压,扫描质量范围设置为(50~600)m/z,进样体积1 μl并根据样本浓度采用不分流或1/10分流比例进行分流进样。各代谢物具体参数见表 2。
对GC-MS检测后的结果进行分析,以每个独立分开的峰的峰面积积分,换算为相应的代谢物信号强度。为了分析每个代谢物的标记程度,需要对代谢物的色谱峰进行断裂碎片的提取。每个碎片提取的离子强度可能包含质量数为(M+0)~(M+6)的多个同位素峰(来自于U-13C glucose或U-13C glutamine的代谢),经过Metalab软件基于矩阵的概率方法,对自然同位素(H,N,O,Si,C)丰度的矫正以及质量分布的均一化处理之后(每一个质量数除以所有质量数对应的代谢物离子强度得到百分比),就可以得到每个代谢物的标记结果,即来自前体物质(13C标记的葡萄糖或谷氨酰胺)的代谢流量分布。
1.3.4 葡萄糖消耗与乳酸产生含量的检测细胞培养液中葡萄糖的消耗与乳酸的产生分别由D-Glucose Enzymatic Bioanalysis Kit(R-Biopharm,No. 0716251)与L-lactate Enzymatic Bioanalysis Kit(R-Biopharm,No. 0139084)根据试剂盒说明书进行检测,但是需按比例调整试剂体积以适合微孔板的检测。分别用前后两次340 nm处的吸光度值作差后代入公式,可算出培养液中相应的葡萄糖与乳酸含量。葡萄糖消耗量=初始培养液葡萄糖含量-测得的剩余葡萄糖含量,乳酸的产生量=测得的乳酸含量-初始培养液中乳酸量。
1.3.5 MTT实验检测细胞增殖将四种细胞分别以3 000个每孔的密度接种于96孔板,待细胞贴壁后,分别在培养0、24、48、72、96 h后每孔加入 5 mg/ml MTT 20 μl,继续培养4 h后吸弃培养液,每孔加入150 μl的DMSO。振荡10 min后用酶联免疫检测仪测定490 nm处的吸光度值并分析数据,每种细胞每个时间点5个复孔。
1.3.6 Transwell实验检测细胞迁移将四种细胞分别以10 000个每孔的密度接种于Transwell小室,每种细胞设3个复孔。小室中加入无血清、含0.1% BSA的DMEM培养液,小室置于含10% 胎牛血清的DMEM培养液中,培养24 h后轻轻拭掉Transwell小室内部细胞,用100 ng/ml终浓度的DAPI核染液染色20 min(避光),将小室膜剪下,贴于载玻片,用荧光封片剂封片后,荧光显微镜下观察并对穿过膜的细胞计数。
1.4 统计学方法采用GraphPad 5.0软件进行统计学处理,单因素多样本均数比较采用单因素方差分析(One-way ANOVA),两两比较分析选用Bonferroni法的Post Hoc检验,数据以均数±标准差(x±s)表示,P<0.05为差异有统计学意义。
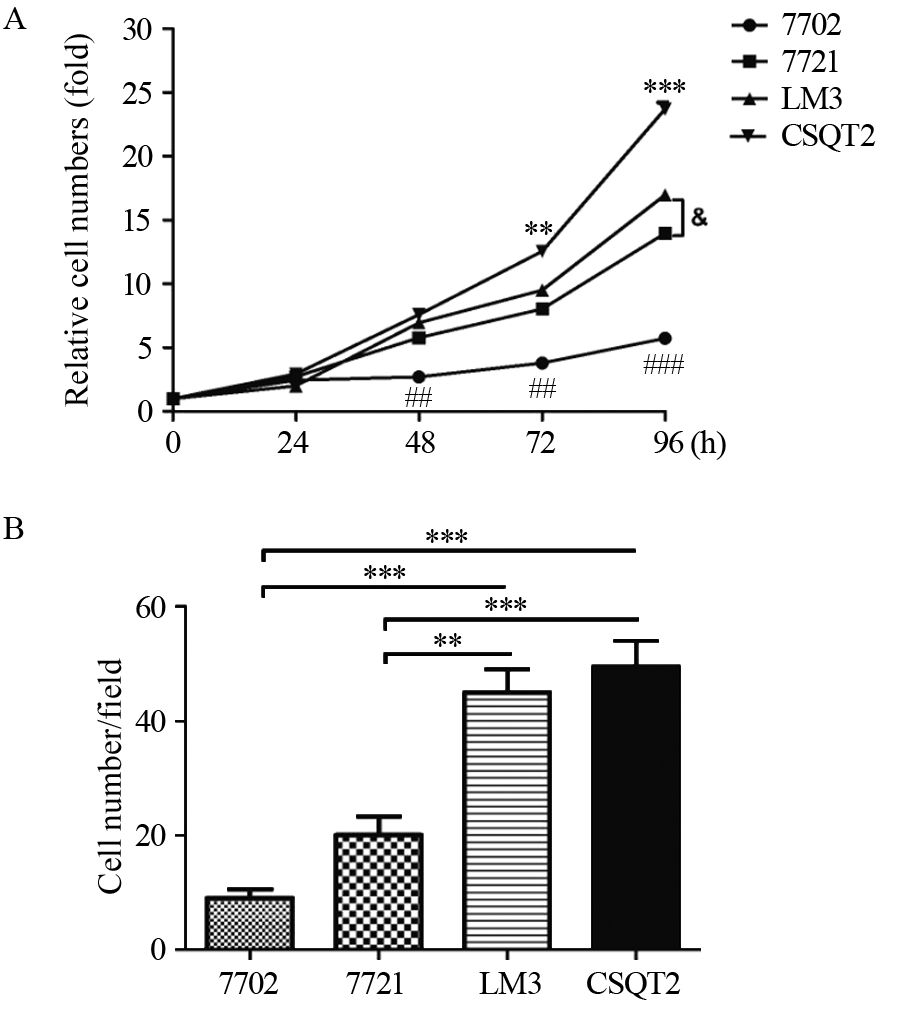
2 结果 2.1 四种肝(癌)细胞系的增殖与迁移能力比较MTT法结果显示,7702、7721、LM3、CSQT2四种细胞的增殖能力随着恶性程度的增加而依次增加。培养48 h开始,人正常肝细胞7702增殖能力已经显著低于HCC细胞系的7721、LM3与PVTT细胞系CSQT2(P<0.01,96 h时P<0.001);72 h开始PVTT细胞系CSQT2的增殖能力显著高于7702细胞及两种不同转移潜能的HCC细胞系(P<0.01,96 h时P<0.001)见图 1A,且随着培养时间的加长差异越来越大。而Transwell法结果也显示,四种细胞的迁移能力随着恶性程度的增加而依次增加,除了7702与7721,LM3与CSQT2之间差异无统计学意义,其余细胞的两两比较中迁移能力差异均有统计学意义(P<0.01或P<0.001),见图 1B。
|
|
7702: HL-7702; 7721: SMMC-7721; LM3: HCCLM3; CSQT2: PVTT CSQT2 ##: P<0.01,###: P<0.001,compared with that of 7702 cells; **: P<0.01,***: P<0.001,compared with that of CSQT2 cells; &: P<0.05,7721 cells vs. LM3 cells 图 1 四种细胞系的增殖(A)与迁移(B)能力 Figure 1 Proliferation(A) and migration(B) abilities of four cell lines |
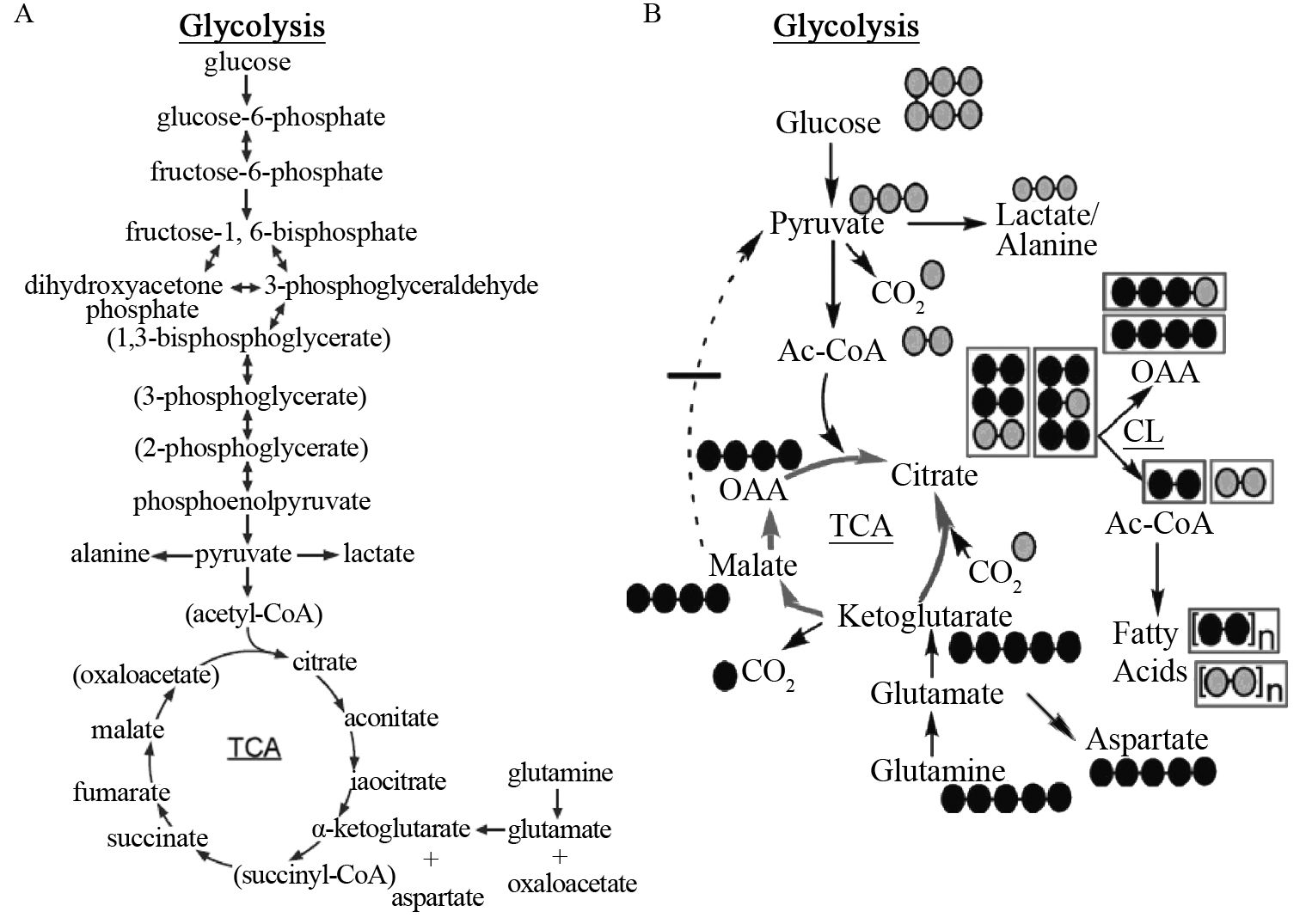
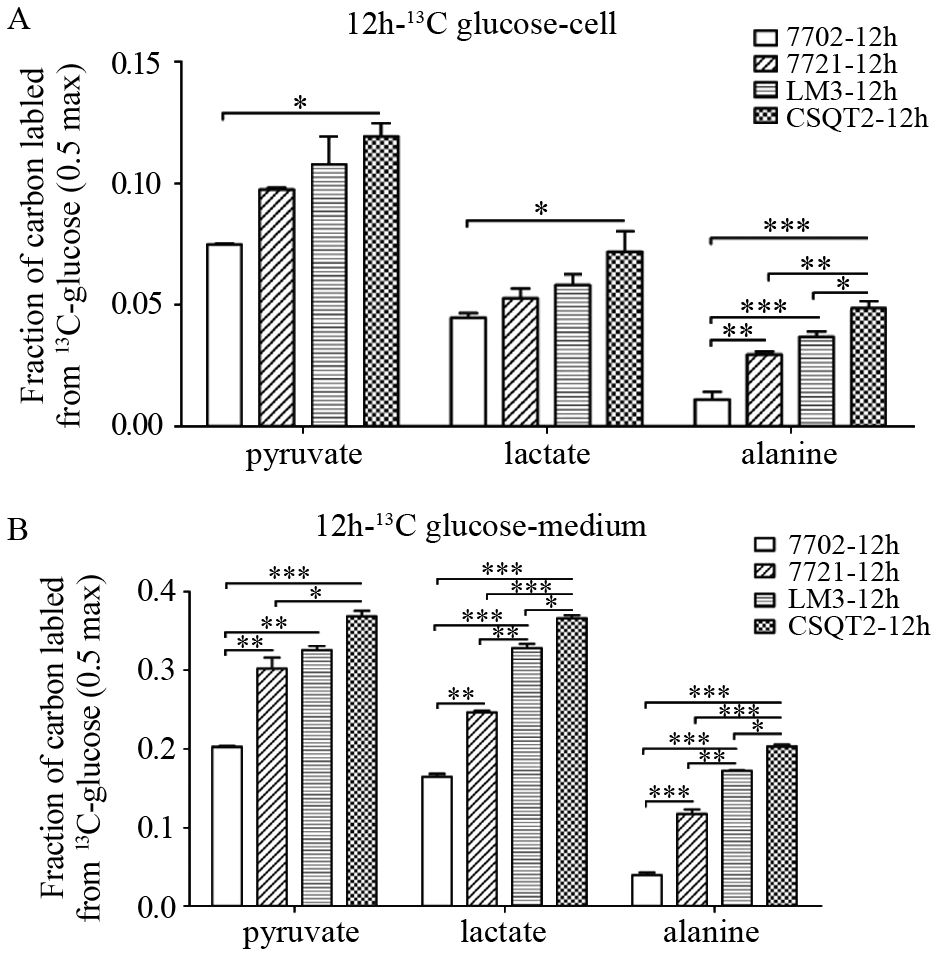
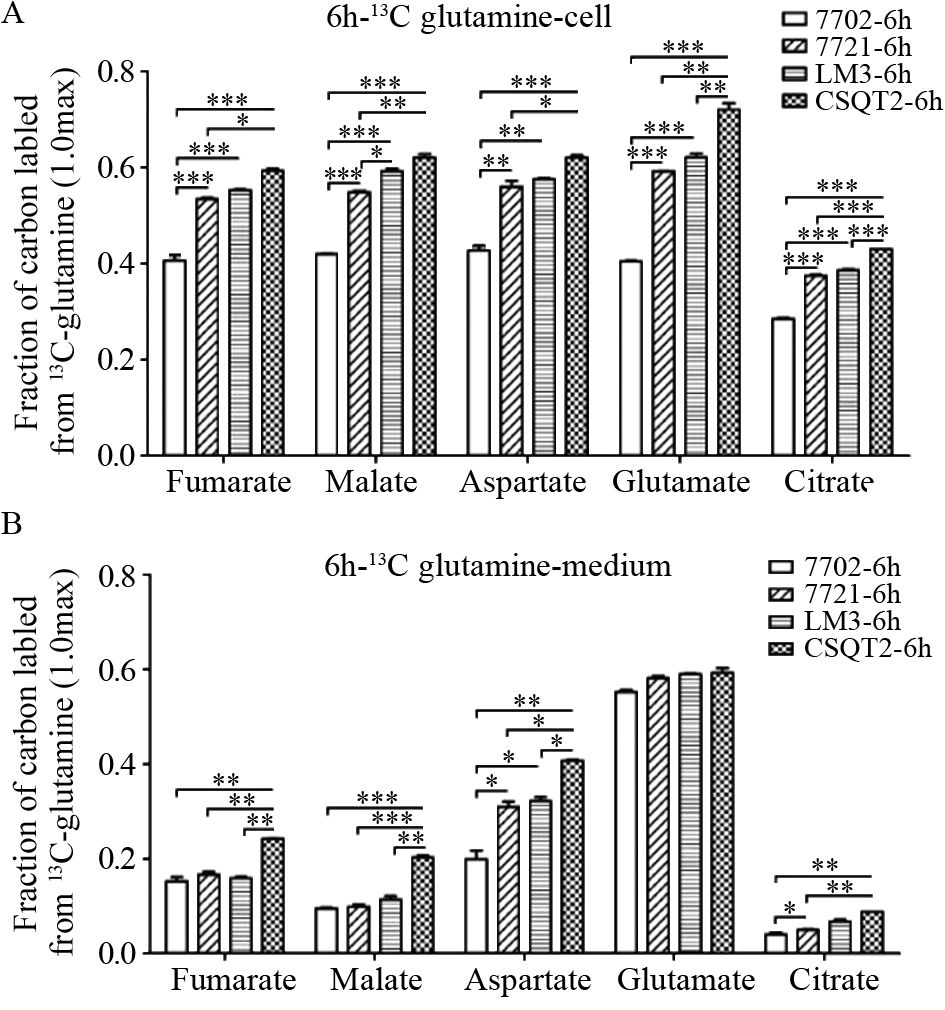
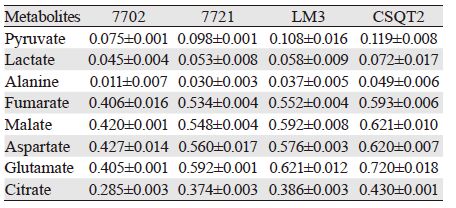
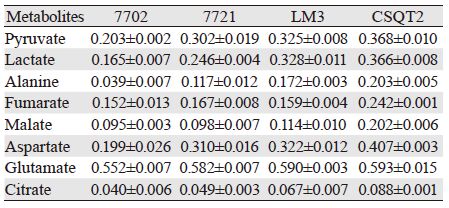
通过稳定同位素的标记实验对不同肝(癌)细胞糖酵解与三羧酸循环(TCA cycle)通路进行代谢流量分析,见图 2。结果显示,无论细胞内还是分泌到细胞外培养液中的糖酵解代谢产物,HCC与PVTT细胞系均产生更多的丙酮酸(pyruvate)、乳酸(lactate)、丙氨酸(alanine),表现为标记实验结果中更大的流量比率,见图 3、表 3~4。其中,细胞内丙氨酸在四种细胞系之间的代谢流量差异最显著,丙酮酸与乳酸只在7702细胞与CSQT2细胞间差异有统计学意义;而培养液中不同细胞间三种代谢物的标记比率差异均有统计学意义。其次,从正常肝细胞到HCC及PVTT形成过程中,延胡索酸(fumarate)、苹果酸(malate)、天门冬氨酸(aspartate)、谷氨酸(glutamate)、柠檬酸(citrate)等主要三羧酸循环代谢产物的流量比率在标记培养后的细胞及培养液中均依次增加,在CSQT2癌栓细胞系中达到最高,见图 4、表 3~4。
|
| The metabolites of grey circles represented those labeled from 13C-glucose,while the metabolites of black circles represented those labeled from 13C-glutamine. Each circle represented one carbon atom. Ac: Acetyl 图 2 糖酵解与三羧酸循环代谢通路图(A) 和标记实验的代谢流量分析示意图(B) Figure 2 Metabolic pathways and metabolites of glycolysis and tricarboxylic acid(TCA) cycle(A) and Sketch map of metabolic flux analysis of label assay(B) |
|
| Cell(A) and medium(B) metabolites were extracted and analyzed separately after 12h of culture; *: P<0.05,**: P<0.01,***: P<0.001 图 3 13C-glucose标记实验检测四种细胞系糖酵解通路的代谢流量 Figure 3 Metabolic flux of glycolysis in four cell lines detected by 13C-glucose label assay |
|
| Cell(A) and medium(B) metabolites were extracted and analyzed separately after 6h of culture; *: P<0.05,**: P<0.01,***: P<0.001 图 4 13C-glutamine标记实验检测四种细胞系三羧酸循环的代谢流量 Figure 4 Metabolic flux of TCA cycle in four cell lines detected by 13C-glutamine label assay |
|
|
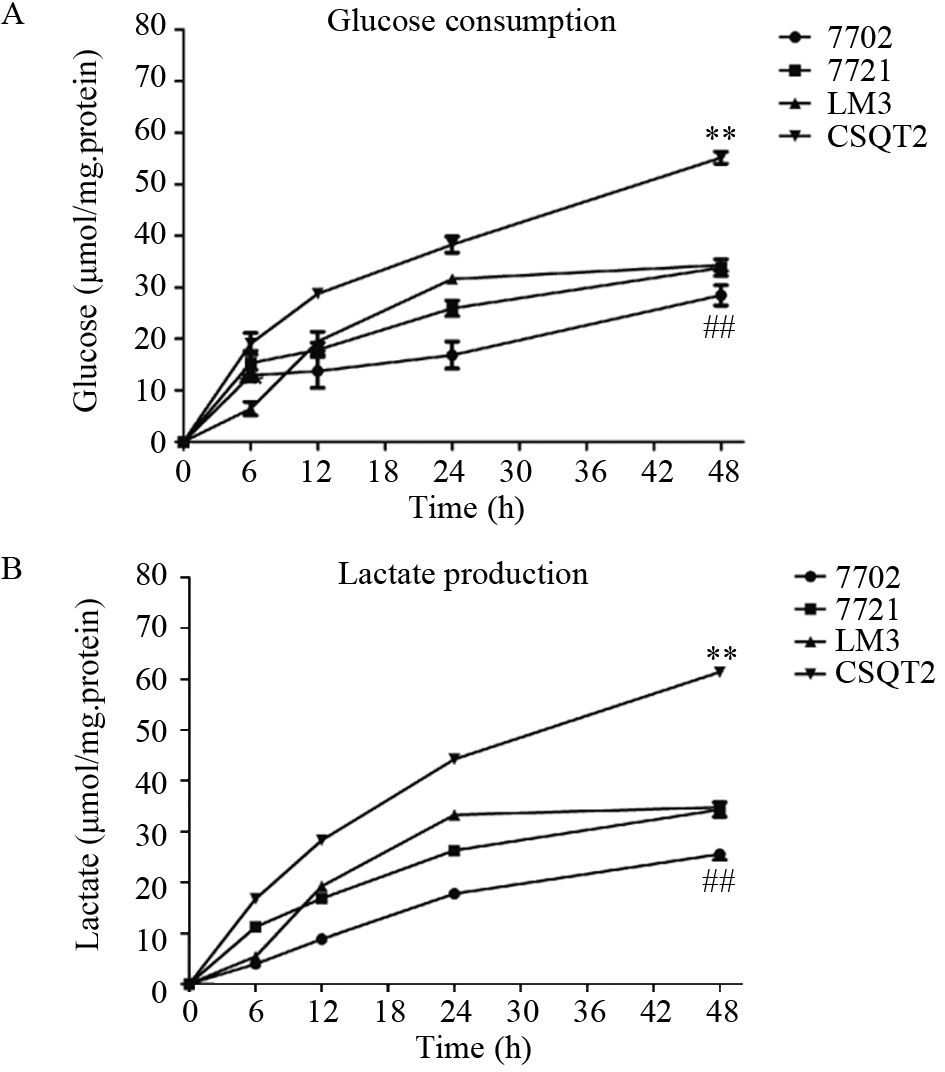
结果显示,6 h开始四种细胞的葡萄糖消耗与乳酸产生量已经显示差异,在48 h差异达到最大。培养48 h后7702细胞葡萄糖消耗量与乳酸产生量均显著低于其他三种细胞(P<0.01);而CSQT2细胞的葡萄糖消耗量与乳酸产生量均显著高于其他三种细胞(P<0.01);但7721与LM3两种细胞间差异无统计学意义,见图 5。酶活实验的结果从另一个角度反映了糖酵解通路在HCC细胞及PVTT细胞中过度激活。
|
| ##: P<0.01,compared with that of 7702 cells; **: P<0.01,compared with that of CSQT2 cells 图 5 四种细胞的葡萄糖消耗曲线(A)与乳酸产生曲线(B) Figure 5 Glucose consumption curve(A) and lactate production curve(B) of four cell lines |
目前,从代谢角度研究揭示癌症产生和发展机制,是全球肿瘤科学发展的热点和新的趋势。肿瘤细胞对两种营养物质依赖性特别强,分别是葡萄糖和谷氨酰胺。即使在营养缺失的环境中,肿瘤细胞也能够重新改变葡萄糖、谷氨酰胺等代谢途径的流量分布,通过代谢重构可以快速满足肿瘤细胞生长所需的ATP与还原力NADPH、NADH,以及合成细胞大分子所需的蛋白质、氨基酸、核酸等。这些变化促使我们探索肿瘤细胞在发生发展过程中,哪些基因、蛋白和信号通路介导了代谢网络的重构,并最终使碳源代谢途径向着肿瘤快速生长、转移的方向发展。
之前虽然已有一些研究对HCC细胞与组织的糖代谢特征进行分析,但大多是针对各代谢物浓度检测的靶标及非靶标代谢组学研究[6],而代谢流量分析很少,并且至今还没有对不同恶性程度及转移潜能的肝(癌)细胞进行糖代谢分析与比较的研究。虽然近年来由于技术的进步与研究的深入,HCC的生存率有所提高,但其总体生存率及预后还是不能令人满意,主要原因之一是PVTT的形成。HCC患者的门静脉癌栓发生率很高,50%~60%的HCC患者首诊时通过影像学检查会发现有PVTT[7]。临床研究通过比较HCC合并PVTT的患者与没有形成PVTT的HCC患者的病理特征,发现前者更易出现肿瘤恶病质症状。因此,探究PVTT的分子细胞特征有利于进一步了解其发生机制与发现早期诊断标志物[8]。本研究首次通过稳定同位素的标记实验对正常肝细胞、不同恶性程度的HCC细胞、PVTT细胞的糖酵解与三羧酸循环通路进行了代谢流量分析,以期未来可能从糖代谢变化及代谢流量差异的角度对HCC的发生、发展与转移进行诊断。
细胞内代谢流量分析对系统地理解细胞代谢特性起着重要的作用。通过跟踪稳定同位素在代谢网络中的转移并进行相应的计算能系统地定量代谢流量。代谢流量分析方法之前主要用于代谢工程与微生物发酵等微生物细胞的代谢特征分析。近年来,在动物细胞及肿瘤相关的细胞生物学领域也越来越多地用于代谢通路活性的分析[9-10]。本研究中代谢流量分析用于比较正常肝细胞及不同转移潜能的HCC细胞及PVTT细胞糖酵解与三羧酸循环的活性,可以看到两个代谢通路中无论是细胞还是培养液中各代谢产物的标记程度都一致性的逐步升高,同时还可以看出,13C标记的葡萄糖分析糖酵解活性时,培养液中的标记程度高于细胞中的;而13C标记的谷氨酰胺分析三羧酸循环通路活性时,却是细胞中标记程度高于培养液中的,因此之后肝细胞的代谢流量实验分析糖酵解与三羧酸循环时可以分别只研究分泌到培养液中与细胞内的流量比率。此外,与糖酵解的代谢流量相比,三羧酸循环中有些代谢流量差异只在正常肝细胞与各HCC、正常肝细胞与PVTT细胞系之间较明显,而在HCC细胞系与PVTT细胞系之间没有明显差异。
虽然之前的研究表明线粒体氧化磷酸化在癌症中受到抑制,但是大多是针对一定含量的葡萄糖的有氧糖酵解异常激活,因而竞争性地减少了其进入三羧酸循环的可能,因此三羧酸循环相关代谢物的含量是减少的,而各代谢通路本身是动态与相互关联的,本研究运用的代谢流量解析方法,是以标记的谷氨酰胺,而非葡萄糖作为碳源进入三羧酸循环,因而得到了其代谢流量增加的结果,表明肝癌细胞的总体代谢处于异常活跃状态。
本研究的结果表明研究肿瘤细胞代谢动态的变化过程是揭示HCC及PVTT发生、发展和转移过程的最有效途径之一,同位素标记的代谢流量分析方法也是研究多种代谢相关疾病的强有力的工具之一。针对HCC与PVTT中糖代谢网络的重构制定相应的治疗方案,对指示HCC的不同阶段、降低HCC发病率和死亡率都可能有重要价值和意义。但是对于HCC细胞中代谢变化的上游调控及其关键基因、蛋白还有待进一步研究,才可能在HCC发展早期进行干预与治疗,进而减少PVTT发生率,提高HCC的预后及总体生存率。
| [1] | El-Serag HB, Rudolph KL. Hepatocellular Carcinoma: epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132 (7) : 2557–76. DOI:10.1053/j.gastro.2007.04.061 |
| [2] | Kaibori M, Ishizaki M, Matsui K, et al. Predictors of microvascular invasion before hepatectomy for hepatocellular carcinoma[J]. J Surg Oncol, 2010, 102 (5) : 462–8. DOI:10.1002/jso.v102:5 |
| [3] | Benjamin DI, Cravatt BF, Nomura DK. Global profiling strategies for mapping dysregulated metabolic pathways in cancer[J]. Cell Metab, 2012, 16 (5) : 565–77. DOI:10.1016/j.cmet.2012.09.013 |
| [4] | Wang T, Hu HS, Feng YX, et al. Characterisation of a novel cell line (CSQT-2) with high metastatic activity derived from portal vein tumour thrombus of hepatocellular carcinoma[J]. Br J Cancer, 2010, 102 (11) : 1618–26. DOI:10.1038/sj.bjc.6605689 |
| [5] | Ma L, Tao Y, Duran A, et al. Control of nutrient stress-induced metabolic reprogramming by PKCzeta in tumorigenesis[J]. Cell, 2013, 152 (3) : 599–611. DOI:10.1016/j.cell.2012.12.028 |
| [6] | Huang Q, Tan Y, Yin P, et al. Metabolic characterization of hepatocellular carcinoma using non-targeted tissue metabolomics[J]. Cancer Res, 2013, 73 (16) : 4992–5002. DOI:10.1158/0008-5472.CAN-13-0308 |
| [7] | Llovet JM, Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008[J]. J Hepatol, 2008, 48 (Suppl 1) : S20–S37. |
| [8] | Qiu JG, Fan J, Liu YK, et al. Comparative proteome analysis of PVTT realated small molecules[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2009, 26 (2) : 181–3. [ 邱继刚, 樊嘉, 刘银坤, 等. 肝癌门静脉癌栓相关小分子的比较蛋白质组学分析[J]. 中华实验外科杂志, 2009, 26 (2) : 181–3. ] |
| [9] | Haschemi A, Kosma P, Gille L, et al. The sedoheptulose kinase CARKL directs macrophage polarization through control of glucose metabolism[J]. Cell Metab, 2012, 15 (6) : 813–26. DOI:10.1016/j.cmet.2012.04.023 |
| [10] | Yu HM,Cheng SQ. Study of adolase B in sorafenib resistance of hepatocellular carcinom[D]. Shanghai: Di Er Jun Yi Da Xue,2015.u HM,Cheng SQ. Study of adolase B in sorafenib resistance of hepatocellular carcinom[D]. Shanghai: Di Er Jun Yi Da Xue,2015. [ 禹鸿鸣,程树群. 醛缩酶B在索拉非尼治疗肝癌的耐药作用研究[D]. 上海:第二军医大学,2015. ] |
 2016, Vol. 43
2016, Vol. 43