文章信息
- 南方红豆杉水提物逆转非小细胞肺癌干细胞耐药作用的实验
- Experimental Investigation on Reversing Drug Resistance of Non-small Cell Lung Cancer Stem Cells by Aqueous Extract of Taxus Chinensis
- 肿瘤防治研究, 2016, 43(11): 933-936
- Cancer Research on Prevention and Treatment, 2016, 43(11): 933-936
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.11.003
- 收稿日期: 2016-01-06
- 修回日期: 2016-05-23
近年来发现少数肿瘤细胞具有自我更新、无限增殖及多向分化的潜能,这些细胞被认为是肿瘤干细胞(cancer stem cells,CSCs)。其较为认可的“标志”细胞是CD133+CD44+的侧群细胞[1]。肿瘤干细胞具有天然的药物和辐射耐受性,肿瘤的多药耐药性(multidrug resistance,MDR)可能是干细胞赋予肿瘤的能力,越来越多的研究结果表明肿瘤干细胞是肿瘤耐药的主要原因。因此一般认为肿瘤干细胞是肿瘤发生、发展、复发与耐药的根源[2-3]。
肿瘤的多药耐药机制有多种,目前认为由内在性ABC转运蛋白家族介导的MDR是最关键的途径,而与耐药有关的ABC转运蛋白主要为P-糖蛋白(P-gp)。国内外研究均发现,钙离子拮抗剂可通过竞争性抑制P-gp外排抗癌药物逆转MDR,但是由于多数逆转剂在体内能引起心血管毒性、肾毒性等严重不良反应,从而限制了它们在临床上的应用。因此,寻求低毒高效的新MDR逆转剂是目前世界各国肿瘤学家研究肿瘤的主要方向。红豆杉是世界上公认的天然珍稀抗癌植物。现代中药药理证实,红豆杉中有紫杉醇、红豆杉多糖、巴卡亭Ⅲ等40多种有效成分。红豆杉提取物可通过诱导肿瘤细胞SMMC-7721和HEp22发生凋亡,抑制肿瘤细胞的生长[4];目前对南方红豆杉水提物(aqueous extract of Taxus chinensis,AETC)的研究尚处于起始阶段,本课题通过对AETC的研究,验证其对人肺癌H460干细胞耐药的逆转作用,进一步阐明AETC逆转非小细胞肺癌耐药的机制,为天然药物南方红豆杉的开发提供理论和实验依据。
1 材料与方法 1.1 主要试剂及仪器H460细胞株由浙江大学医学院免疫研究所保存,流式细胞仪(型号:FC500MCL,厂家:Beckman Coulter)为浙江大学生物化学与分子生物学实验中心所有,红豆杉颗剂(宁波泰康红豆杉生物工程有限公司);DMEM/F12细胞培养液(美国Gibco公司)、重组表皮生长因子(EGF,美国PeproTech公司)、碱性成纤维生长因子(bFGF,美国PeproTech公司)、胰岛素(日本Sigma公司)、B27因子(日本Sigma公司)、牛血清蛋白(BSA,美国Gibco公司)、 CCK-8试剂盒(日本同仁);96孔细胞培养板(美国Corning公司);顺铂(日本Sigma公司);Rh-123染料(日本Sigma公司)。
1.2 药物制备参考文献[5]方法:将80 g南方红豆杉颗粒置于不锈钢锅浸泡过夜,加8倍水煮沸30 min倒出药液,8倍水煮沸20 min,5倍水煮沸20 min,将3次药液经真空抽滤器过滤,置于电磁炉上浓缩至约100 ml,旋转蒸发仪上80℃水浴中浓缩成约40 ml药液,入真空干燥箱中干燥,得浸膏,按100%浓度计算得率。取1 g AETC,其中加入10 ml超纯水,溶解后,经高速冷冻离心机12 000 r/min离心15 min,取上清液,再经0.22 μm微孔滤膜除菌,制成母液浓度100 mg/ml,置-20℃冰箱备用。
1.3 H460干细胞的制备新配制无血清培养液(SFM):即在无血清DMEM/F12培养液中加EGF、bFGF、胰岛素、BSA、B27及葡萄糖等细胞生长所必须的营养要素。将H460细胞胰酶消化、SFM重悬成103/ml单细胞悬液,培养瓶竖直放入培养箱中,每日摇5次。观察微球形成,每2天半量换液一次,每6天传代一次。收集对数生长期微球体,Accutase消化、吹打成单细胞,然后予以Hoechst33342孵育,流式细胞仪检测细胞中侧群细胞,当侧群细胞比例达25%时,收集全部生长细胞球,制成单细胞PBS悬液,加荧光标记的单抗孵育,FACS筛选出CD133+、CD44+细胞作为H460干细胞。
1.4 CCK-8法检测AETC对H460干细胞的毒性收集对数期H460干细胞,调整细胞悬液浓度约5×104/ml,培养至细胞单层铺满孔底;以DMEM/F12培养液稀释AETC至不同浓度,每孔加入100 μl,浓度分别为400、800、1 600、3 200、 6 400 μg/ml,并设空白对照组,每浓度设3个复孔,每孔加入10 μl的CCK-8试剂,孵育2 h。在酶标仪490 nm波长处测量各孔的吸光度值(OD值)按下列公式计算细胞生长抑制率:生长抑制率=(1-OD实验组/OD对照组)×100%。用剂量和效应关系的药物浓度抑制软件(LOGIT法)版本1.0.0计算出的半数抑制率(IC50)。
1.5 CCK-8法检测AETC逆转H460干细胞的耐药性收集对数期H460干细胞,调整细胞悬液浓度约5×104/ml,培养至细胞单层铺满孔底;根据H460干细胞的IC50值,取红豆杉浓度梯度为(350、700、1 400 μg/ml)处理细胞后,再予以顺铂抑制实验,顺铂对H460干细胞的IC50值为40 μmol/ml。取药物浓度分别为(10、20、40 μmol/ml),并设空白对照组,每浓度设3个复孔。培养72 h。根据以上CCK-8实验结果,按照药物合并效应公式 [Q=E(a+b)/(Ea+Eb-Ea*Eb)] 评价AETC是否有逆转耐药作用。公式中分子代表“实测合并效应”,分母是“期望合并效应”。0.85<Q<1.15为单纯相加(+),1.15<Q<2.00为逆转(++),0.55<Q<0.85为拮抗(-)Q<0.55为明显拮抗(--)。
1.6 FCM检测AETC逆转H460干细胞耐药的作用机制Rh-123为P-gp的底物,同时本身又具有荧光,与荧光抗癌药物相比几乎没有细胞毒性,且不影响细胞正常生命活动,是研究P-gp作用的理想替代药物。收集对数生长期的H460干细胞,细胞数为l×106/ml,分为3组:CK组、红豆杉水提物(600 μg/ml)处理组、维拉帕米(20 μmol/L)组,分别与5 μmol/L的Rh-123在37℃孵育,分别于0、30、60、90、120 min取出0.5 ml细胞悬液,冷PBS冲洗,细胞悬液上样,用流式细胞仪测定,每份样品分析10 000个细胞,激发波长488 nm,荧光分析为530 nm。
1.7 统计学方法用SPSS17.0统计软件分析处理,实验数据以均数±标准差(x±s)表示,组间比较采用两独立样本t检验,以P≤0.05为差异有统计学意义。
2 结果 2.1 光学显微镜下观察筛选出的H460干细胞在无血清培养液条件下经FCM筛选出的H460干细胞呈球形立体生长,细胞球呈圆形或者椭圆形,球内细胞结合紧密,球体饱满,折光性强,随着时间延长,细胞球可逐渐增大,形状规则,见图 1。
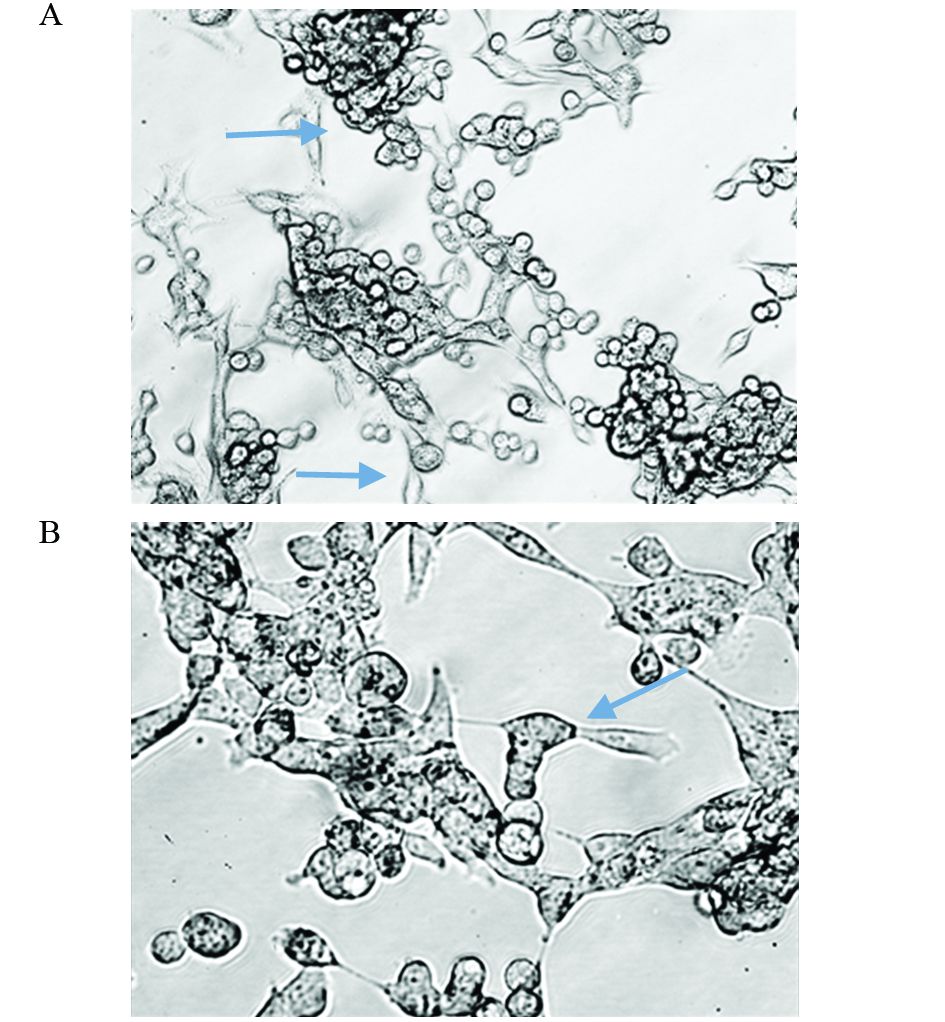
|
| A: H ×200; B: H ×400 图 1 不同倍数光学显微镜下观察H460干细胞形态 Figure 1 Optical microscopic observation of H460 cells under different multiples |
不同浓度AETC处理H460干细胞后72 h,CCK-8法检测发现AETC对H460干细胞增殖有明显抑制作用,且抑制作用与药物浓度成正相关,有明显的剂量—效应关系,药物浓度抑制软件计算H460干细胞IC50值为1 449 μg/ml,见图 2。
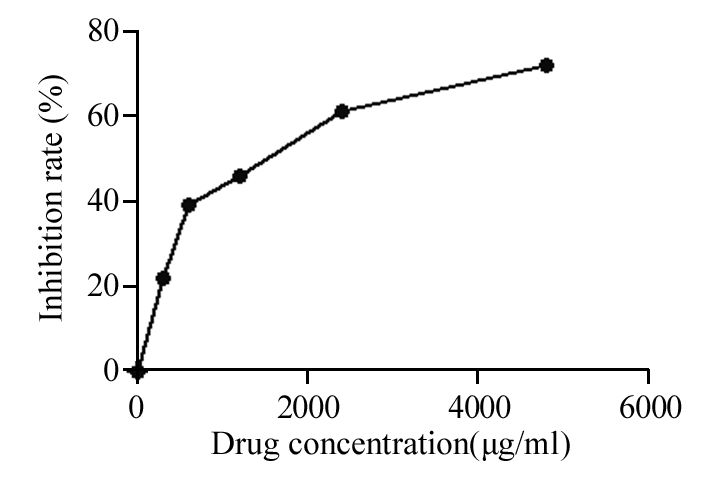
|
| 图 2 红豆杉水提物对H460干细胞的毒性 (x±s) Figure 2 Toxicity of AETC on H460 stem cells (x±s) |
浓度350 μg/ml AETC预先处理H460干细胞24 h后,顺铂对细胞的实测抑制率与两种药物分别对细胞抑制率的单纯相加比较,差异无统计学意义,随着AETC浓度增加至700 μg/ml和1 400 μg/ml时,其有效地逆转了细胞的耐药性,且逆转效应与药物浓度成正相关,使顺铂对H460干细胞的抑制率较两种药物分别对细胞抑制率的单纯相加明显提高,顺铂的IC50值分别下降为22 μmol/ml和13 μmol/ml,差异有统计学意义(P=0.026),见图 3。

|
| AETC: aqueous extract of Taxus chinensis 图 3 红豆杉水提物对H460干细胞耐药性的逆转 (x±s) Figure 3 Drug resistance reversion of AETC to H460 stem cells (x±s) |
结果显示AETC作用于H460干细胞,可使Rh-123的积聚明显增加,最高达到无AETC处理的H460干细胞内蓄积量的2倍。维拉帕米是公认的P-gp抑制剂,被用来作为新型P-gP抑制剂的阳性对照物。无处理的H460干细胞内的荧光强度在30 min时达到最高峰,至120 min期间均无多大变化。Rh-123外排实验发现红豆杉具有抑制Rh-123外排的功能,见图 4。
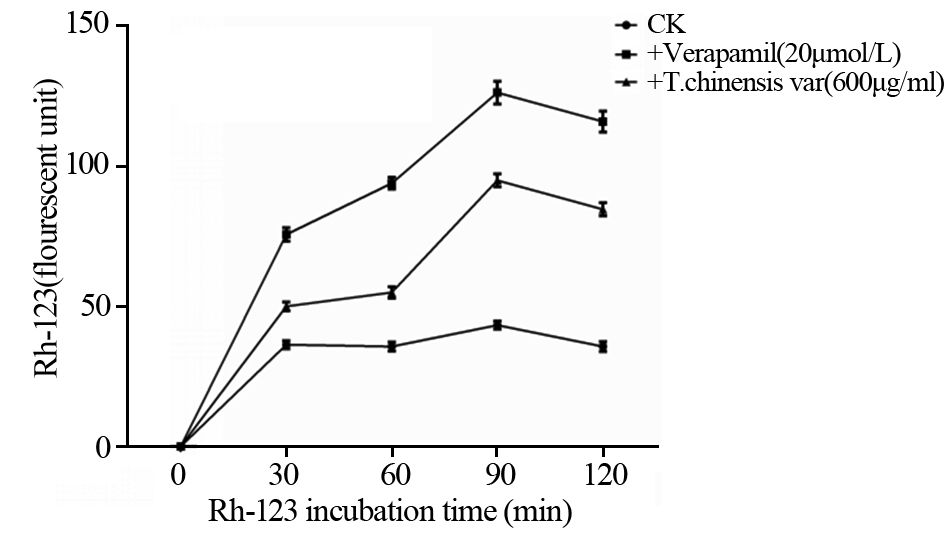
|
| 图 4 AETC对H460干细胞内Rh-123积聚水平的影响 Figure 4 Influence of AETC on accumulation level of Rh-123 in H460 stem cells |
近年来随着干细胞研究的深入,肿瘤干细胞在肿瘤耐药中的作用日益突现。由于肿瘤干细胞与正常干细胞具有许多相似特征,大多处于细胞周期的G0期,表达特异性的ATP结合盒(ATP-binding cassette,ABC),如ABCB1、ABCG2等介导的膜泵耐药分子,而使其对化疗天然耐药[6]。ABC转运蛋白是一类跨膜蛋白,在体内分布广泛,可转运肽类、内源性脂质、核苷酸、代谢性药物、酶素等,目前与耐药有关的ABC转运蛋白主要为P-糖蛋白(P-gp/ABCB1)[7]。
P-gp蛋白最初由Biedler及Ling于1970年在实验中发现的一种糖蛋白(P糖蛋白),P-gp的相对分子质量为170×103 Da,是跨膜糖蛋白,属于ABC(ATP-binding cassette)超家族成员,能通过ATP水解释放能量将药物运至细胞外,使细胞内药物浓度降低,从而产生耐药[8],其主要有两种功能:(1)位于细胞膜发挥药物外排泵的作用。主要通过协同机制转运结合还原型谷胱甘肽的药物[9]。P-gp作为一种ATP能量依赖的谷胱甘肽合成酶—结合物输出泵(glutathione synthetase-pump,GS-X)[10],当抗肿瘤药物在谷胱甘肽转移酶的作用下与谷胱甘肽形成共轭物GS-X时,其会通过泵功能将GS-X迅速泵出细胞外,使细胞内药物浓度迅速下降,产生耐药[11]。(2)位于细胞质内形成囊泡包裹药物,起隔离作用,避免药物损伤细胞核。
目前,国内外研究均发现,钙离子拮抗剂通过竞争性抑制P-gp外排抗癌药物可逆转MDR。异搏定、维拉帕米(verapamil,VPL)、环孢素以及它们的类似物等均具有不同程度的逆转MDR作用,但是由于多数逆转剂在体内能引起心血管毒性、肾毒性等严重不良反应,而不能使逆转剂在体内达到逆转MDR的有效血药浓度,从而限制了它们在临床上的应用。红豆杉性味苦、平,有小毒,归心经。功效消肿散结,主治肿瘤、肾病、风湿等。目前已经从红豆杉中分离出400多种化合物,包括紫杉烷类化合物和少量的非紫杉烷类化合物。红豆杉多糖是红豆杉水煎提取液的主要成分,具有免疫调节、抗肿瘤、抗炎、抗病毒、抗氧化、抗辐射、降血糖、降血脂、保肝等多种功能[12]。红豆杉水煎剂已在临床广泛应用,且安全有效,但目前国内外尚未见应用AETC逆转肿瘤耐药的研究报道。
本实验发现AETC对H460干细胞增殖均有明显抑制作用,且抑制作用与药物浓度成正相关,有明显的剂量—效应关系,其作用于H460干细胞IC50值为1 449 μg/ml。AETC可有效逆转细胞对于化疗药物的耐药性,且逆转效应与药物浓度成正相关。进一步研究还发现,AETC逆转MDR与其抑制P-gp蛋白的外排作用有关。
本实验通过对南方红豆杉颗粒的预处理及提纯,成功制备了新型的红豆杉水提物,并通过其作用于人肺癌干细胞的研究,证明了南方红豆杉水提物既能抑制肺癌干细胞生长又能逆转对其他化疗药物的耐药,为以后的动物实验及临床应用提供理论依据及实验基础。
| [1] | Sui YP, Jian XP, Ma LI, et al. Prognostic value of cancer stem cell marker CD133 expression in esophageal carcinoma: A meta-analysis[J]. Mol Clin Oncol, 2016, 4 (1) : 77–82. |
| [2] | Leon G, Macdonagh L, Finn SP, et al. Cancer stem cells in drug resistant lung cancer: Targeting cell surface markers and signaling pathways[J]. Pharmacol Ther, 2016, 158 : 71–90. DOI:10.1016/j.pharmthera.2015.12.001 |
| [3] | Adorno-Cruz V, Kibria G, Liu X, et al. Cancer stem cells: targeting the roots of cancer,seeds of metastasis,and sources of therapy resistance[J]. Cancer Res, 2015, 75 (6) : 924–9. DOI:10.1158/0008-5472.CAN-14-3225 |
| [4] | Gong W, Mei XG, Lu CT, et al. The extractiong of the Taxus chinensis cells on tumor cell SMMC-7721 and HEp22 action research[J]. Zhongguo Yao Li Xue Tong Bao, 2003, 19 (7) : 801–3. [ 龚伟, 梅兴国, 鲁翠涛, 等. 红豆杉细胞提取物对肿瘤细胞SMMC-7721和HEp22的作用研究[J]. 中国药理学通报, 2003, 19 (7) : 801–3. ] |
| [5] | Shu QJ, Li P, Wang BB. Study on Inhibitory action of proliferation of human lung carcinoma A549 cell with aqueous extract of Taxus chinensis[J]. Zhongguo Zhong Xi Yi Jie He Za Zhi, 2011, 31 (9) : 1243–7. [ 舒琦瑾, 李萍, 王彬彬. 南方红豆杉水提物诱导人肺癌A549细胞凋亡及其分子机制的实验研究[J]. 中国中西医结合杂志, 2011, 31 (9) : 1243–7. ] |
| [6] | Gu HM, Wang F, Alabi A, et al. Identification of an Amino Acid Residue Critical for Plasma Membrane Localization of ATP-Binding Cassette Transporter G1-Brief Report[J]. Arterioscler Thromb Vasc Biol, 2016, 36 (2) : 253–5. DOI:10.1161/ATVBAHA.115.306592 |
| [7] | Breitenstein B, Scheuer S, Brückl TM, et al. Association of ABCB1 gene variants,plasma antidepressant concentration,and treatment response: Results from a randomized clinical study[J]. J Psychiatr Res, 2015, 73 : 86–95. |
| [8] | Pang S, Ran Z, Liu Z, et al. Enantioselective induction of a glutathione-S-transferase,a glutathione transporter and an ABC transporter in maize by Metolachlor and its (S)-isomer[J]. PLoS One, 2012, 7 (10) : e48085. DOI:10.1371/journal.pone.0048085 |
| [9] | Leslie EM. Arsenic-glutathione conjugate transport by the human multidrug resistance proteins (MRPs/ABCCs)[J]. J Inorg Biochem, 2012, 108 : 141–9. DOI:10.1016/j.jinorgbio.2011.11.009 |
| [10] | Doss CG, Debottam S, Debajyoti C. Glutathione-responsive nano-transporter-mediated siRNA delivery: silencing the mRNA expression of Ras[J]. Protoplasma, 2013, 250 (3) : 787–92. DOI:10.1007/s00709-012-0451-1 |
| [11] | Sinha C, Ren A, Arora K, et al. Multi-drug resistance protein 4 (MRP4)-mediated regulation of fibroblast cell migration reflects a dichotomous role of intracellular cyclic nucleotides[J]. J Biol Chem, 2013, 288 (6) : 3786–94. DOI:10.1074/jbc.M112.435925 |
| [12] | Xu GX, Kong FZ. Taxus chinensis -the tree of human health[M]. Beijing: China Morden Economics Publishing House, 2009 : 59 -60. [ 徐关兴, 孔繁智. 红豆杉—人类健康之树[M]. 北京: 中国时代经济出版社, 2009 : 59-60.] ] |
 2016, Vol. 43
2016, Vol. 43


