文章信息
- RORα高表达对人胃癌MGC803细胞增殖与迁移侵袭的影响
- Effect of RORα Overexpression on Proliferation, Migration and Invasion of Human Gastric MGC803 Cells
- 肿瘤防治研究, 2016, 43(11): 926-932
- Cancer Research on Prevention and Treatment, 2016, 43(11): 926-932
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.11.002
- 收稿日期: 2015-12-08
- 修回日期: 2016-03-14
2. 570206 海口,海南省妇幼保健院妇产科;
3. 418000 怀化,怀化市第一人民医院肿瘤科
2. Department of Gynaecology and Obstetrics,Hainan Maternal and Child Health Hospital,Haikou 570206,China;
3. Department of Oncology,Huaihua First People's Hospital,Huaihua 418000,China
胃癌是最常见的恶性肿瘤之一,发生率与死亡率分别为全球第四位与第三位。由于患者就诊时大多已发生侵袭转移,5年生存率低于10%[1-2]。因此,研究胃癌侵袭转移机制,寻找靶点具有重要的临床意义。
维甲酸相关孤核受体α(retinoid acid receptor related Orphan Receptor α,RORα)是核受体超家族成员之一,广泛分布于机体各组织,可调节多种组织细胞的发育和(或)分化、生物代谢、机体稳态维持及高级神经功能等[3-5]。近年来,发现RORα与肿瘤发生密切相关。研究显示,RORα在乳腺癌、结肠癌、肝癌与鳞状细胞癌等肿瘤中表达下调[5-12]。我们发现RORα在胃癌中低表达,与胃癌发生和分化程度有关[13]。本文观察RORα高表达对胃癌细胞增殖与迁移侵袭的作用。
1 材料与方法 1.1 细胞培养人胃癌MGC803细胞株由本实验室保存,置于含10%小牛血清的RPMI 1640培养液中,37℃、5%CO2、饱和湿度的培养箱内传代培养。实验分为MGC803细胞对照组、RORα高表达组与空载体组,取对数生长期的细胞用于实验。
1.2 主要试剂RNA提取试剂盒购自美国OMEGA公司;反转录试剂盒与BCA蛋白定量试剂盒为美国Promega公司产品;Taq Plus PCR Mastermix、酶切产物胶回收试剂盒和质粒抽提纯化试剂盒购自加拿大Fermentas公司;BamHⅠ和HindⅢ限制性内切酶购自大连宝生物公司;T4 DNA连接酶和Marker购自上海生工公司;Lipofectamine 2000脂质体、G418、RPMI 1640购自美国Invitrogen公司;RORα与β-actin抗体购自英国Abcam公司;MMP-9与TIMP3抗体和ECL发光试剂盒购自美国Santa Cruz公司;新生牛血清购自杭州四季青生物工程公司。引物用Primer Premier 5.0软件设计,由上海生工公司合成。
1.3 pcDNA3.1-RORα真核表达载体的构建 1.3.1 扩增RORα基因扩增RORα基因编码区全长cDNA,在PCR引物两端分别加入EcoRⅠ和HindⅢ酶切位点,PCR引物:F:5’-TAGGATCCACCATGGAGTCAGCTCCG-3’;R:5’-TCGGAATTCT TACCCATC AATTTGC-3’,PCR反应体系为25 µl,反应条件:94℃ 5 min,94℃ 40 s,56℃ 45 s,72℃ 80 s,30个循环;72℃ 10 min。
1.3.2 琼脂糖电泳得出产物用5%EB的1%琼脂糖胶,在80 V电泳,紫外灯下切下目的条带,用胶回收试剂盒回收PCR产物。
1.3.3 双酶切鉴定双酶切体系:20 µl(2 µl 10×Buffer,10 µl ddH2O,2 µl BSA,0.5 µl EcoRⅠ,0.5 µl HindⅢ,5 µl RORα PCR产物/pcDNA3.1),37℃酶切4 h;酶切产物再次纯化回收,连接,反应体系:20 µl(11 µl ddH2O,2 µl 10×Ligase Buffer,1 µl pcDNA3.1双酶切质粒,5 µl RORα PCR酶切产物,1 µl T4 DNA ligase),16℃水浴过夜连接、转化、测序鉴定。
1.4 稳定表达RORα基因的MGC803细胞系的构建消化细胞接种在6孔板中,RPMI 1640完全培养液37℃、5%CO2培养。在离心管中加100 μl无血清RPMI 1640培养液和4 μg pcDNA3.1-RORα真核表达载体质粒或pcDNA3.1载体质粒。另一离心管中加入100 μl无血清RPMI 1640培养液和8 μl Lipofectamine 2000脂质体。两管液体充分混合,室温孵育20 min。吸弃6孔板中的培养液,1 ml无血清RPMI 1640培养液洗涤,再加1 ml无血清RPMI 1640。将孵育20 min的载体和脂质体的混合溶液加入6孔板中,37℃、5%CO2培养箱中培养,转染5 h后换成RPMI 1640完全培养液,继续培养24 h,加800 μg/ml的G418筛选培养,每3天更换一次G418筛选的培养液,连续培养3~4周,直至出现单克隆细胞。混合克隆用200 μg/ml G418的RPMI 1640完全培养液培养。
1.5 Real-time PCR检测收集细胞,提取细胞总RNA,Real-time PCR测定各组细胞RORα mRNA的表达情况。反应体系:cDNA、RORα-sense、RORα-antisense各1 µl,2×SYBR Green qPCR Mix 10 µl,dd H2O 7 µl,总体积20 µl。反应条件:95℃ 10 min一个循环,95℃ 15 s,60℃ 1 min,40个循环。以β-actin为内参,与样本的基因表达水平比较。计算公式:相对mRNA表达= 2-ΔΔCt×100%,其中ΔCt=靶基因Ct-GAPDH Ct。
1.6 Western blot检测收集细胞,提取细胞总蛋白,BCA法测定蛋白浓度,每组取等量样本进行SDS-PAGE凝胶电泳,电泳后转膜,封闭1 h,加一抗,4℃过夜,TBST洗膜,加二抗孵育1 h,洗膜,ECL发光,X片曝光、显影、定影。
1.7 MTT检测取对数生长期细胞,接种于96孔平底培养板,每个样本设6个重复孔。细胞贴壁6~8 h后更换为150 μl RPMI 1640完全培养液,再加入20 μl 5 mg/ml MTT溶液,继续培养4 h后,吸弃培养液,加150 μl DMSO溶液,室温振荡10 min,酶联免疫检测仪OD570nm处测量各孔吸光度值。细胞增殖抑制率=(1-实验组OD570/对照组OD570)×100%。
1.8 流式细胞术检测取对数生长期细胞,1 000 r/min离心5 min,预冷PBS液重悬细胞,离心重复一次;将收集的细胞用4℃预冷的75%乙醇固定。上机前将乙醇固定的细胞离心洗涤,去上清液摇匀;加RNA酶50 μl,37℃水浴30 min;加碘化丙啶50 μl,振荡混匀,避光置冰箱30 min;300目尼龙网过滤,上机检测,进行细胞周期分析。
1.9 迁移实验将0.8×105个MGC803细胞接种于12孔细胞培养板中,每组设3个平行样本。RPMI 1640培养液37℃、5%CO2培养,直至形成细胞单层。用20 μl的tip枪头垂直于板面划痕,无血清培养液洗3次,加入新鲜无血清培养液。倒置显微镜下观察、测量划痕区相对距离。
1.10 侵袭实验将基质胶稀释液铺置在Transwell小室中,放置成膜。取100 μl细胞稀释液接种至小室上腔,取500 μl含10%胎牛血清培养液添加至下腔,小室放置在37℃、5%CO2细胞培养箱中培养36 h后取出,擦弃小室上层细胞并用4%多聚甲醛固定10 min,0.1%结晶紫染色,PBS液洗涤,晾干。光学显微镜下观察并随机选取4个高倍视野进行细胞计数,取平均值。
1.11 统计学方法采用SPSS13统计软件进行统计分析,各组实验数据采用均值±标准差表示,结果比较采用t检验,P<0.05为差异有统计学意义。
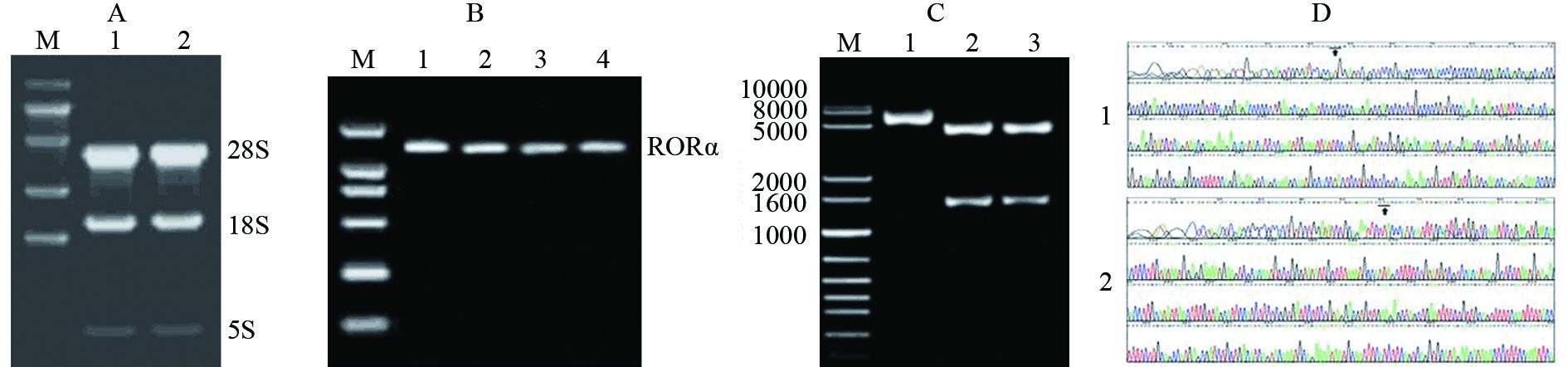
2 结果 2.1 RORα真核表达载体的构建MGC803细胞总RNA的提取显示18S和28S条带清晰,A260/A280比值大于1.93,符合RT-PCR要求,见图 1A。以MGC803细胞总RNA为模板,扩增RORA基因剪切变异a(NM_134261.2,NP_599023.1)的全长cDNA序列。琼脂糖凝胶电泳显示,PCR产物为单一清晰的DNA条带,片段大小约1 640 bp,与预期结果一致,见图 1B。RORα基因全长cDNA序列片段与真核表达载体 pcDNA3.1连接,获得pcDNA3.1-RORα真核表达载体。从转化成功的克隆中随机选取2个克隆,EcoR Ⅰ和HindⅢ双酶切鉴定显示,pcDNA3.1-RORα载体和酶切产物DNA条带清晰,与预期片段大小相符,见图 1C。将经酶切鉴定的阳性克隆双向测序显示,插入序列与RORα全长cDNA的GenBank序列完全一致,见图 1D。表明已成功构建pcDNA3.1/RORα真核表达载体,并通过双酶切鉴定与DNA测序,显示RORα基因在pcDNA3.1载体中连接的位置和方向正确。
|
| A: the electropherogram of total RNA of MGC803 cells,M: DNA marker; 1-2: MGC803 cells; B: PCR amplification of total length cDNA sequence of RORα gene,M: DNA marker; 1-4: PCR amplification strap of total length cDNA sequence of RORα gene; C: double enzyme identification of recombination of eukaryotic expression vector pcDNA3.1-RORα,M: DNA marker; 1: pcDNA3.1-RORα plasmid; 2-3: double enzyme plasmid of pcDNA3.1-RORα; D: the sequencing of recombination of eukaryotic expression vector pcDNA3.1-RORα,1: forward sequencing,the arrow pointed at a transcriptional start site; 2: reverse sequencing,the arrow pointed at a transcription termination 图 1 RORα真核表达载体的构建 Figure 1 Construction of RORα eukaryotic expression vector |
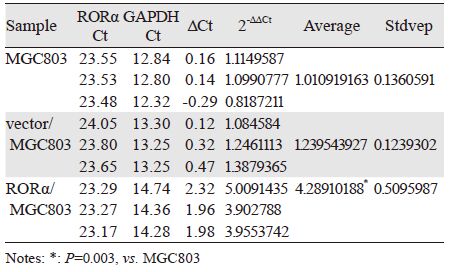
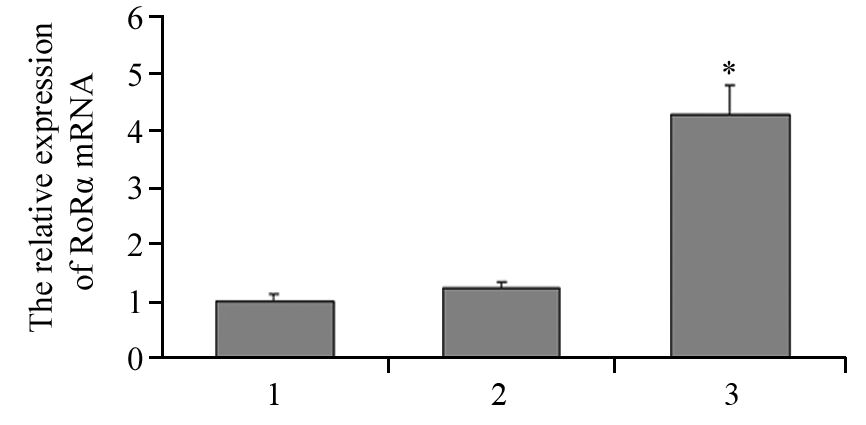
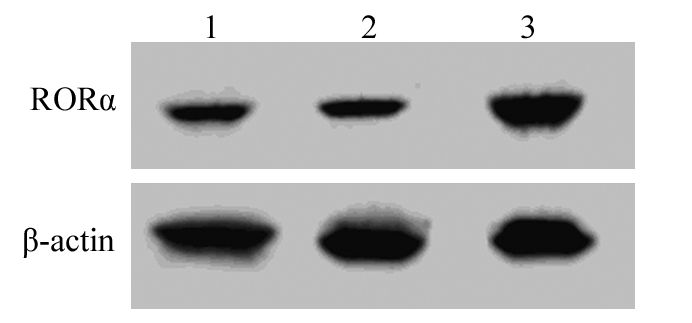
转染空载体的MGC803细胞RORα mRNA和蛋白表达与MGC803细胞差异均无统计学意义(P>0.05)。pcDNA3.1-RORα真核表达载体稳定转染MGC803细胞后,与未转染MGC803细胞比较,RORα mRNA(P=0.003)和蛋白(P=0.002)表达均明显增加,表明构建的RORα/MGC803细胞能稳定高表达RORα基因,见表 1、图 2~3。
|
|
| 1: MGC803 cells; 2: vector/MGC803; 3: RORα/MGC803 cells; *: P=0.005 vs. MGC803 cells 图 2 RORα高表达MGC803细胞中RORα mRNA表达 Figure 2 Expression of RORα mRNA in RORα/MGC803 cells |
|
| 1: MGC803 cells; 2: vector/MGC803; 3: RORα/MGC803 cells vs. MGC803 cells 图 3 RORα高表达MGC803细胞中RORα蛋白的表达 Figure 3 Expression of RORα protein in RORα/MGC803 cells |
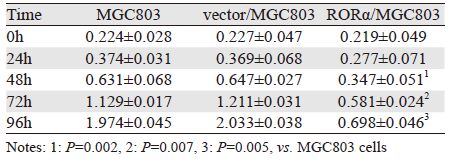
48 h后,RORα高表达MGC803组细胞增殖能力呈时间依赖性明显低于MGC803组和空载体组(P<0.05),表明RORα高表达可抑制MGC803细胞增殖,见表 2。
|
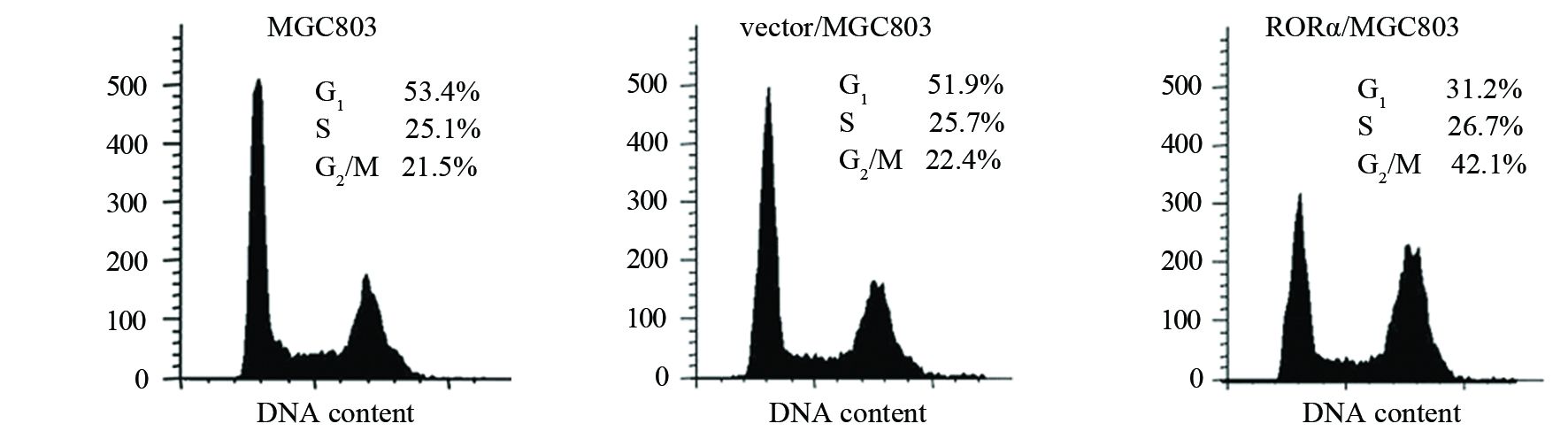
流式细胞术检测显示,RORα高表达MGC803组G2/M期细胞占42.1%,明显高于对照组21.5%(P=0.001)和空载体组22.4%(P=0.002),表明RORα高表达可阻滞MGC803细胞于G2/M期,见图 4。
|
| 图 4 RORα高表达对MGC803细胞的细胞周期影响 Figure 4 Effect of RORα overexpression on MGC803 cells cycle |
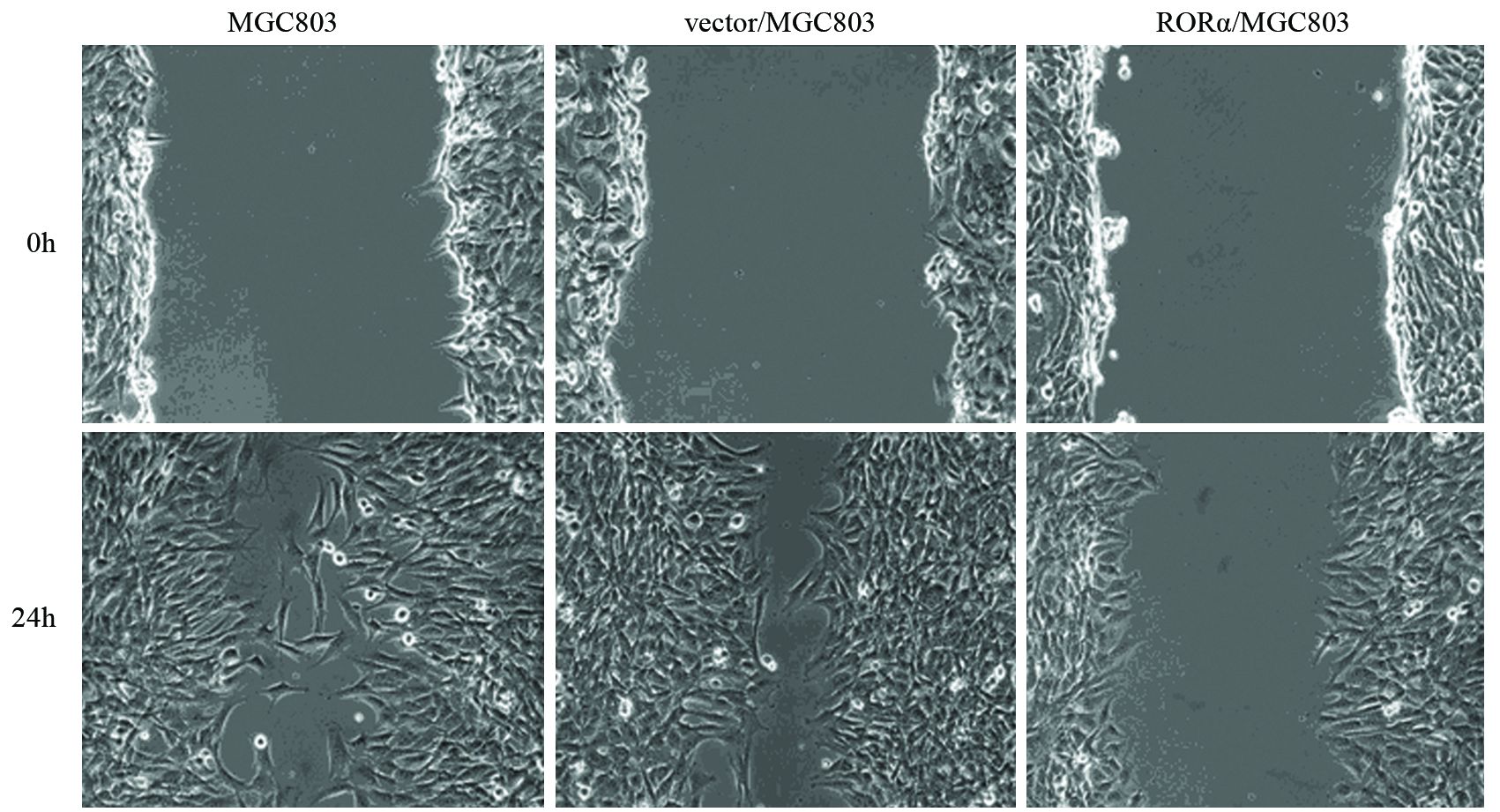
在0 h时,各组细胞的划痕距离大体相同。24 h后,RORα高表达组细胞的迁移距离(53±11)μm,较MGC803组(132±14)μm(P=0.005)与空载体组(137±9)μm减少(P=0.005)。表明RORα高表达可抑制MGC803细胞迁移,见图 5。
|
| 图 5 RORα高表达对MGC803细胞迁移的影响 Figure 5 Effect of RORα overexpression on migration of MGC803 cells |
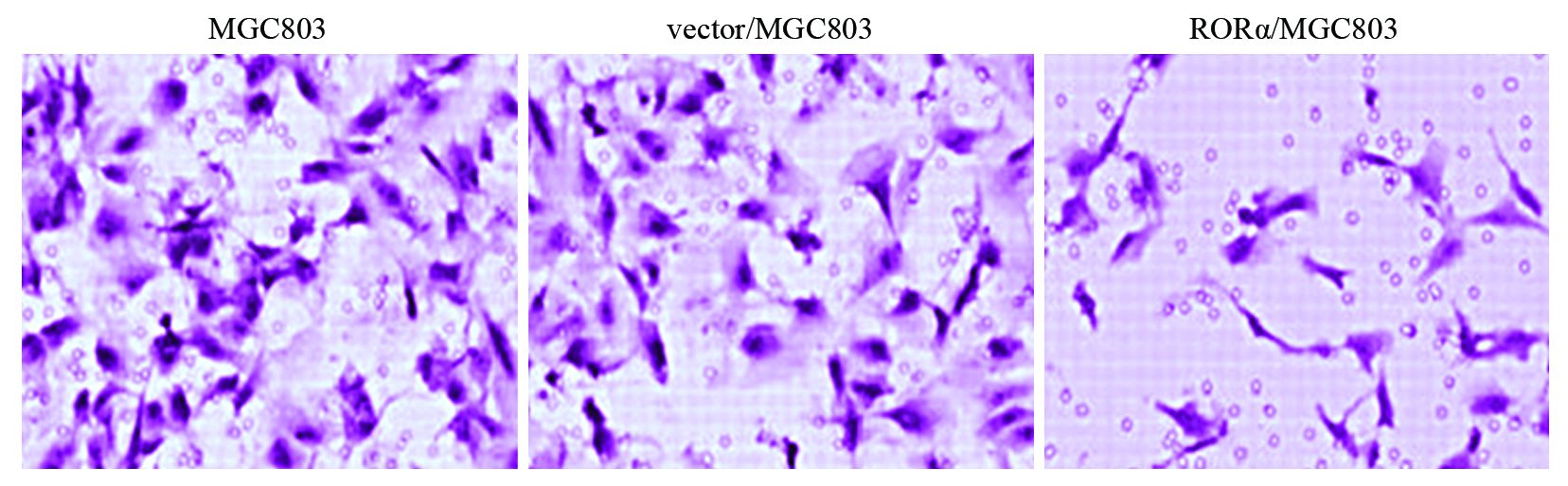
RORα高表达组穿膜细胞数(37±9)个,较MGC803组(147±17)(P=0.001)与空载体组(144±18)(P=0.001)明显减少,表明RORα高表达可抑制MGC803细胞侵袭,见图 6。
|
| 图 6 RORα高表达对胃癌MGC803细胞侵袭的影响 Figure 6 Effect of RORα overexpression on invasion of MGC803 cells |
RT-PCR与Western blot检测显示,RORα高表达可明显下调MMP-9 mRNA(P=0.034)与蛋白(P=0.026)和上调TIMP3 mRNA(P=0.023)与蛋白(P=0.037)。表明RORα高表达抑制MGC803细胞的迁移和侵袭可能与下调MMP-9和上调TIMP3有关,见图 7~10。
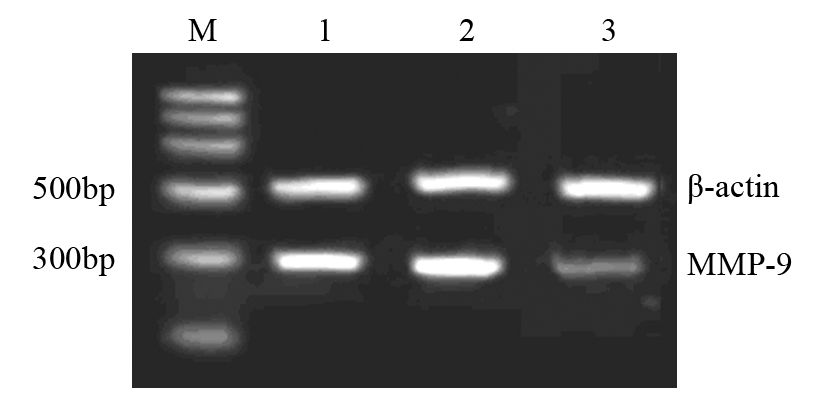
|
| M: marker; 1: MGC803 cells; 2: vector/MGC803; 3: RORα/MGC803 cells 图 7 RORα高表达对MGC803细胞MMP-9 mRNA表达的影响 Figure 7 Effect of RORα overexpression on MMP-9 mRNA expression in MGC803 cells |

|
| 1: MGC803 cells; 2: vector/MGC803; 3: RORα/MGC803 cells 图 8 RORα高表达对MGC803细胞MMP-9蛋白表达的影响 Figure 8 Effect of RORα overexpression on MMP-9 protein expression in MGC803 cells |
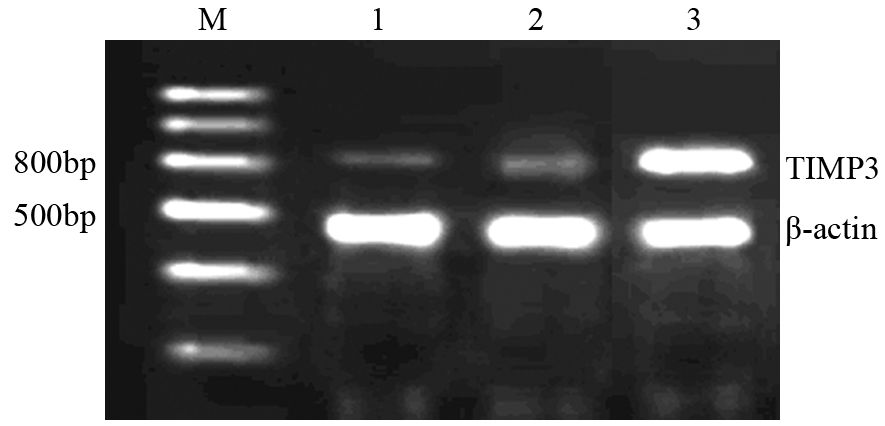
|
| M: marker; 1: MGC803 cells; 2: vector/MGC803; 3: RORα/MGC803 cells; *: P<0.05,vs. MGC803 and vector/MGC803 图 9 RORα高表达对MGC803细胞TIMP3 mRNA表达的影响 Figure 9 Effect of RORα overexpression on TIMP3 mRNA expression in MGC803 cells |
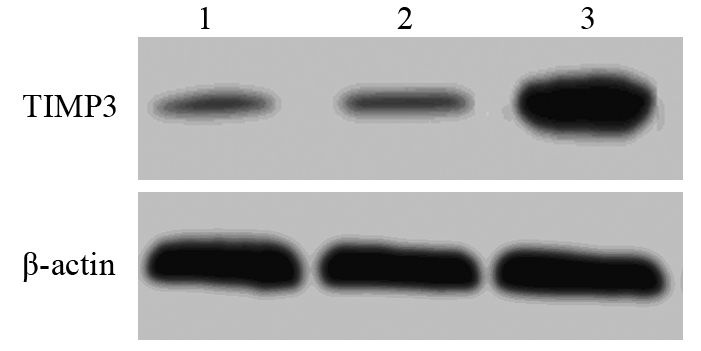
|
| 1: MGC803 cells; 2: vector/MGC803; 3: RORα/MGC803 cells 图 10 RORα高表达对MGC803细胞TIMP3蛋白表达的影响 Figure 10 Effect of RORα overexpression on TIMP3 protein expression in MGC803 cells |
RORα基因定位于染色体15q21~q22,全长大小约730 kb,包含15个外显子,可编码四种基因产物RORα1~4,其中RORα1是最主要的亚型,分布广泛,在多种细胞中均有表达[3-5]。
目前认为,RORα在肿瘤中起着抑癌基因的作用。Du等报告,RORα在乳腺癌较正常乳腺组织表达下调和(或)活性下降,而恢复RORα表达可体内外抑制乳腺癌细胞增殖与侵袭等恶性表型,提示RORα是乳腺癌的抑制基因和治疗靶点[5]。研究显示,RORα及其靶基因在人结肠癌中表达降低,脂肪细胞的条件培养液可促进结肠癌细胞增殖与迁移和血管发生,但RORα及其靶基因表达降低,而RORα活化可抑制结肠癌细胞增殖与迁移以及血管发生,表明RORα低表达是结肠癌发生的危险信号[6]。RORα磷酸化可竞争结合β-catenin,抑制Wnt/β-catenin通路靶基因cyclin D1、c-myc、Axin,从而调控细胞增殖与肿瘤进展。RORα可依赖PGE2/PKCα途径磷酸化减弱结肠癌细胞Wnt靶基因表达,表明RORα是肿瘤细胞增殖的关键调控因子[7-8]。研究发现,RORα在肝癌组织表达较临近非肿瘤组织明显下调,与血清AFP、病理分级、肿瘤复发、血管侵袭和预后密切相关。RORα高表达可减少肝癌细胞需氧糖酵解和下调生物合成途径,上调p21,抑制PDK2表达和磷酸化[9-11]。RORα在鳞癌组织与细胞中明显低表达,RORα表达增加可提高与角化细胞分化相关的蛋白以及类脂屏障形成有关基因[12]。
近年来,研发促进RORα表达的有效药物为治疗肿瘤开拓了新的途径[5]。有人从12 000种植物提取物中发现,neoruscogenin是RORα高亲和力的激动剂,其可体内外活化RORα及影响其靶基因的表达[14]。Wang等首次合成RORα激动剂SR1078,并鉴定SR1078可促进RORα表达和活化内源性RORα靶基因等作用[15]。RORα激动剂SR1078处理肿瘤细胞可稳定p53蛋白表达与诱导凋亡,提示RORα激动剂可有效治疗肿瘤[16]。最近,我们运用蛋白质组学技术发现大蒜的脂溶性有效成分二烯丙基二硫(DADS)处理人胃癌MGC803细胞后,RORα蛋白表达明显上调[17]。为了进一步探讨RORα表达对胃癌细胞增殖与迁移侵袭的影响,本研究通过建立稳定高表达RORα的MGC803细胞,证明RORα高表达可明显抑制MGC803细胞增殖与迁移侵袭,机制与下调MMP-9和上调TIMP3有关。研究表明,RORα可通过Wnt/β-catenin、Wnt5a/PKC、p53-dependent、Hypoxia/Angiogenesis、NF-κB等多种信号途径调控肿瘤细胞增殖、凋亡、侵袭与转移[5]。然而,RORα抑制胃癌细胞增殖与迁移侵袭通过什么信号通路调控的分子机制,DADS是否可上调RORα抑制胃癌细胞增殖与迁移侵袭尚待进一步深入研究。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics,2012[J]. CA Cancer J Clin, 2015, 65 (2) : 87–108. DOI:10.3322/caac.21262 |
| [2] | Orditura M, Galizia G, Sforza V, et al. Treatment of gastric cancer[J]. World J Gastroenterol, 2014, 20 (7) : 1635–49. DOI:10.3748/wjg.v20.i7.1635 |
| [3] | Jetten AM. Retinoid-related orphan receptors (RORs): critical roles in development,immunity,circadian rhythm,and cellular metabolism[J]. Nucl Recept Signal, 2009, 7 : e003. |
| [4] | Zhao XH, Su Q. Retinoid acid receptor related orphan receptor α and Wnt signaling pathway and tumor[J]. Guo Ji Bing Li Ke Xue Yu Lin Chuang Za Zhi, 2011, 31 (3) : 234–7. [ 赵晓红, 苏琦. 维甲酸相关孤核受体α与Wnt信号途径及肿瘤的关系[J]. 国际病理科学与临床杂志, 2011, 31 (3) : 234–7. ] |
| [5] | Du J, Xu R. RORα,a potential tumor suppressor and therapeutic target of breast cancer[J]. Int J Mol Sci, 2012, 13 (12) : 15755–66. DOI:10.3390/ijms131215755 |
| [6] | Xiao L, Wang J, Li J, et al. RORα inhibits adipocyte-conditioned medium-induced colorectal cancer cell proliferation and migration and chick embryo chorioallantoic membrane angiopoiesis[J]. Am J Physiol Cell Physiol, 2015, 308 (5) : C385–96. DOI:10.1152/ajpcell.00091.2014 |
| [7] | Lee JM, Kim IS, Kim H, et al. RORalpha attenuates Wnt/beta-catenin signaling by PKCalpha-dependent phosphorylation in colon cancer[J]. Mol Cell, 2010, 37 (2) : 83–95. |
| [8] | Shin D, Kim IS, Lee JM, et al. The hidden switches underlying RORα-mediated circuits that critically regulate uncontrolled cell proliferation[J]. J Mol Cell Biol, 2014, 6 (4) : 338–48. DOI:10.1093/jmcb/mju023 |
| [9] | Chauvet C, Vanhoutteghem A, Duhem C, et al. Control of gene expression by the retinoic acid-related orphan receptor alpha in HepG2 human hepatoma cells[J]. PLoS One, 2011, 6 (7) : e22545. DOI:10.1371/journal.pone.0022545 |
| [10] | Fu RD, Qiu CH, Chen HA, et al. Retinoic acid receptor-related receptor alpha (RORalpha) is a prognostic marker for hepatocellular carcinoma[J]. Tumour Biol, 2014, 35 (8) : 7603–10. DOI:10.1007/s13277-014-2007-9 |
| [11] | Byun JK, Choi YK, Kang YN, et al. Retinoic acid-related orphan receptor alpha reprograms glucose metabolism in glutamine-deficient hepatoma cells[J]. Hepatology, 2015, 61 (3) : 953–64. DOI:10.1002/hep.v61.3 |
| [12] | Dai J, Brooks Y, Lefort K, et al. The retinoid-related orphan receptor RORα promotes keratinocyte differentiation via FOXN1[J]. PLoS One, 2013, 8 (7) : e70392. DOI:10.1371/journal.pone.0070392 |
| [13] | Shi Y, Huang JJ, Su J, et al. Expression of RORα in gastric carcinoma and clinical pathological significance[J]. Shi Yan Yu Bing Li Xue Za Zhi, 2012, 28 (3) : 270–3. [ 石莺, 黄建军, 苏坚, 等. RORα蛋白在胃癌中的表达及临床病理意义[J]. 实验与病理学杂志, 2012, 28 (3) : 270–3. ] |
| [14] | Helleboid S, Haug C, Lamottke K, et al. The identification of naturally occurring neoruscogenin as a bioavailable,potent,and high-affinity agonist of the nuclear receptor RORα (NR1F1)[J]. J Biomol Screen, 2014, 19 (3) : 399–406. DOI:10.1177/1087057113497095 |
| [15] | Wang Y, Kumar N, Nuhant P, et al. Identification of SR1078,a synthetic agonist for the orphan nuclear receptors RORalpha and RORgamma[J]. ACS Chem Biol, 2010, 5 : 1029–34. DOI:10.1021/cb100223d |
| [16] | Wang Y, Solt LA, Kojetin DJ, et al. Regulation of p53 stability and apoptosis by a ROR agonist[J]. PLoS One, 2012, 7 (4) : e34921. DOI:10.1371/journal.pone.0034921 |
| [17] | Su B, Su J, He H, et al. Identification of potential targets for diallyl disulfide in human gastric cancer MGC-803 cells using proteomics approaches[J]. Oncol Rep, 2015, 33 (5) : 2484–94. |
 2016, Vol. 43
2016, Vol. 43


