文章信息
- 原发性膀胱浆细胞样/印戒细胞尿路上皮癌1例报道
- Primary Plasmacytoid/Signet-ring Cell Urothelial Carcinoma of Bladder: A Case Report
- 肿瘤防治研究, 2016, 43(10): 916-918
- Cancer Research on Prevention and Treatment, 2016, 43(10): 916-918
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.10.018
- 收稿日期: 2016-01-28
- 修回日期: 2016-07-20
根据2016版泌尿及男性生殖系统肿瘤WHO新分类,膀胱印戒细胞癌(不伴有细胞外黏液者),命名为膀胱浆细胞样尿路上皮癌(plasmacytoid urothelial carcinoma),伴有印戒细胞形态。此类浸润性膀胱尿路上皮癌的亚型临床罕见,恶性程度高,病程进展迅速,预后极差。本研究曾诊治此类型膀胱癌患者1例,随访至今,取得较满意效果,现报道如下,希望提高临床对该病的认知和诊疗水平。
1 病例资料患者,男,59岁,因“间断性全程无痛肉眼血尿8月余,加重20多天”入院。患者入院前8月余无明显诱因开始出现全程无痛性肉眼血尿,于当地医院行彩超检查未见异常,未行进一步诊疗。后血尿间断发作,且于入院前20多天加重,同时伴有下腹疼痛,尿频,尿急,排尿困难,消瘦(体重减轻3 Kg),于当地医院彩超,CT等检查提示膀胱占位性病变,膀胱镜活检示膀胱印戒细胞癌,送检大部分为坏死组织。既往史和查体无特殊。实验室检查肾功能:UREA 9 mmol/L,Cr 189 μmol/L;肿瘤标志物:胃蛋白酶原Ⅰ(PGⅠ) > 200 ng/ml,CEA1.8 μg/L,TPSA 2.08 μg/L,CA199 48.64 u/ml↑。彩超示膀胱占位性病变(前上壁,宽基底,大小约5.5 cm×6.7 cm×4.9 cm)。IVP示膀胱顶壁占位,双肾排泄功能正常。盆腔MRI示:膀胱顶壁占位性病变(最大层面大小约7.1 cm×4.0 cm,膀胱周围脂肪间隙模糊),考虑膀胱癌侵出壁外,见图 1。PET-CT示:膀胱顶前壁肿物(范围约7.2 cm×4.8 cm),PET显示异常放射性浓聚,符合膀胱癌,余全身未见明显异常及恶性征象。胃镜示慢性胃炎,咬检示慢性炎性反应。初步病理切片会诊示:膀胱腺癌(印戒细胞型)。后在全麻下行“根治性膀胱全切除术(包括盆腔淋巴结清扫术)+双侧输尿管皮肤造瘘术”,术中见肿瘤位于膀胱顶前壁,稍偏左侧,大小约7 cm×6 cm,部分侵出膀胱外,对应腹膜受累(可能),基底宽,表面有坏死,其余周围组织器官未见明显侵犯。手术顺利。术后初期肾功能肌酐仍略高,2周多后恢复正常,肿瘤标志物正常。术后病理见图 2。(膀胱)低分化印戒细胞癌伴大片坏死,局灶伴高级别尿路上皮癌,侵犯膀胱壁全层及周围脂肪组织,双侧输尿管、输精管、精囊腺、前列腺及尿道断端(-);区域淋巴结(左盆腔0/7,右盆腔0/6)未见癌转移;免疫组织化学:CEA(+),CK20(+),Ki-67(约50%+),P53(约10%+),GATA-3(-),CK7(-),PSA(-),P63(-)。术后行GC方案(吉西他滨+顺铂)化疗4周期,并行盆腔局部放疗,过程顺利。定期随访,目前已9月,暂未发现复发及转移。
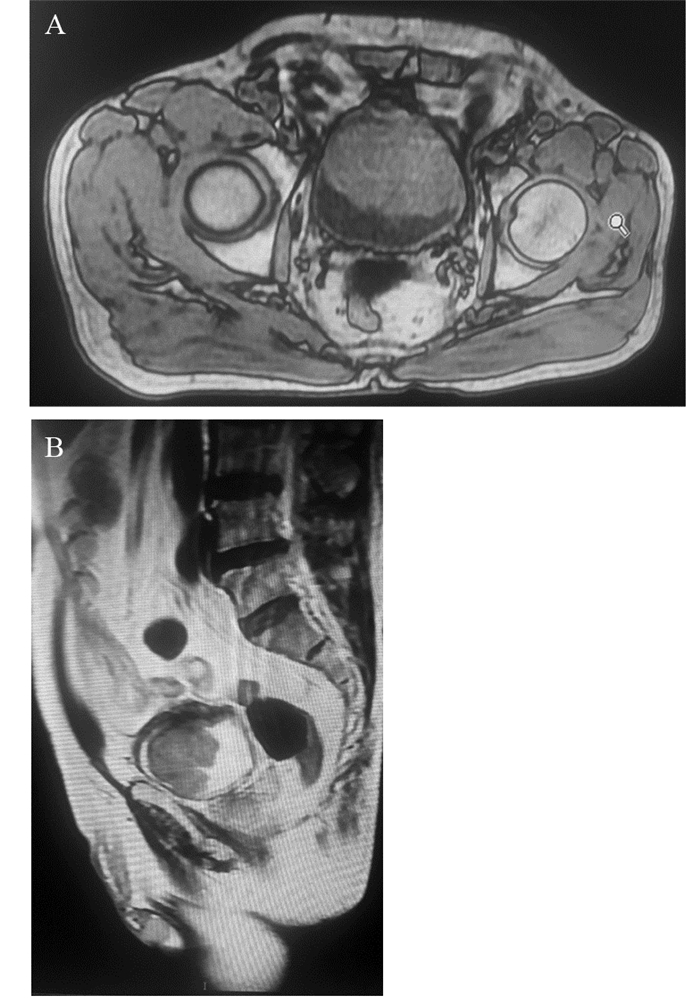
|
| MRI showed a huge tumor on the top wall of bladder, the size was about 7.1cm×4.0cm, bladder tissues around the gap was fuzzy, may be invaded locally; A: axial position; B: sagittal position 图 1 膀胱浆细胞样/印戒细胞尿路上皮癌MRI扫描图 Figure 1 MRI scan of plasmacytoid/signet-ring cell urothelial carcinoma of bladder |
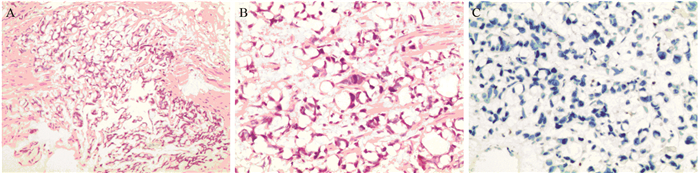
|
| A: HE ×100; B: HE ×200; C: GATA3(-) ×200 图 2 膀胱浆细胞样/印戒细胞尿路上皮癌HE染色和免疫组织化学图 Figure 2 HE staining and immunohistochemical figure of plasmacytoid/signet-ring cell urothelial carcinoma of bladder |
临床上90%的印戒细胞癌(signet-ring cell carcinoma, SRCC)发生在胃肠道[1]、乳腺、卵巢等,原发性膀胱印戒细胞癌罕见,仅占所有膀胱恶性肿瘤的0.24%,以男性多见,男女比例3:1,中老年居多,好发年龄为70~80岁。膀胱腺癌分为肠型、黏液型和混合型,既往认为原发性膀胱印戒细胞癌是膀胱腺癌的一种特殊类型,属于低分化腺癌,而研究表明既往归入此类的膀胱印戒细胞癌属于黏液型或由印戒细胞和大量具有浆细胞样特征的细胞组成的浆细胞样尿路上皮癌,故目前最新观点认为几乎所有文献中报道的膀胱印戒细胞癌(缺乏细胞外黏液)不应归入膀胱腺癌,而应归入具有侵袭性特点的膀胱尿路上皮癌亚型—膀胱浆细胞样尿路上皮癌一类中,正式命名为膀胱浆细胞样/印戒细胞尿路上皮癌[2]。对于膀胱浆细胞样尿路上皮癌数年前早已报道,但是近期研究全面重新定义了其形态学,临床表现和基因学特点[3]。分子水平的特点是存在E-cadherin(CDH1)的基因突变和缺乏钙黏蛋白表达[4],约占肌层浸润性膀胱尿路上皮癌的2.3%~3.1%[5]。膀胱浆细胞样/印戒细胞尿路上皮癌临床表现早期无特异性,血尿和尿路刺激征最常见,亦可能早期出现上尿路积水,或肿瘤压迫侵犯导致的相关症状。以膀胱三角区和后壁多见,也有研究提示好发于膀胱顶壁和前壁,但也只占12.6%[6]。20%的患者早期没有发现膀胱新生物,仅见膀胱黏膜粗糙,膀胱壁增厚、变硬,或呈黏膜下弥漫浸润生长。肿瘤侵袭性强,常常侵及膀胱肌层、周围组织或邻近器官,确诊时绝大部分处于中晚期(T3、T4期),具有局部高分期,预后差的特点。
膀胱浆细胞样/印戒细胞尿路上皮癌可单独存在,亦可和普通高级别浸润性尿路上皮癌及其变异亚型(如微乳头)等共同存在,以混合性多见。确诊主要靠病检,组织学特征为:比例不同的圆形或椭圆形肿瘤细胞存在于疏松或黏液样的基质中,胞浆嗜酸性或透亮,核大、深染偏位,似浆细胞,核位于一端呈印戒细胞样形态,部分区域细胞胞质呈空泡状,有或没有细胞内黏液蛋白,但缺乏细胞外黏液蛋白[3]。弥漫浸润膀胱黏膜固有层和肌层,脉管内可见癌栓,常伴有高级别尿路上皮癌的成分。免疫组织化学染色:AB/PAS阳性;标记:CEA、EMA、CK7、CK20等上皮染色多为阳性,CDX2阴性,酸性磷酸酶和PSA阴性。Terada报道3例原发性纯膀胱浆细胞样/印戒细胞尿路上皮癌免疫标记(CK)AE1/3、CK CAM5.2、CK8、CK18、CK19、CK20、p53、Ki-67(30%、50%、70 %),MUC1阳性,MUC2. CK34BE12、CK5/6、CK14、EMA、p63、vimentin和MUC6阴性,CK7(1/3),CA19-9(1/3)和MUC5AC(2/3)阳性[7]。浆细胞样肿瘤细胞CD138阳性,LCA(白细胞共同抗原)、Vimentin和绝大部分E-cadherin阴性,E-cadherin阴性表达是诊断浆细胞样尿路上皮癌的必备条件[5]。需与具有浆细胞形态的淋巴瘤、神经内分泌癌、无色素性恶性黑色素瘤、胚胎性横纹肌肉瘤等相鉴别,还需排除转移癌或邻近器官(如前列腺)肿瘤侵犯的可能。
治疗上,根治性膀胱全切术可能是唯一有效的手段,单纯的放化疗不敏感。目前普遍采用根治性手术和联合术后化疗,新辅助化疗亦能获益[8]。EI等[9]报道对1例pT3bN1M0期患者采用全膀胱切除术联合术后GC方案(吉西他滨联合顺铂)化疗,存活22月。Hamakawa等则对1例T3bN0M0期患者在术后给予顺铂联合S-1化疗3周期,患者90月无复发及转移[10]。Pugashetti等[11]报道对T4aN2Mx患者采用FOLFOX-6方案化疗8周期,患者一直存活,目前已12月。有研究认为术后放疗能显著提高患者的5年生存率[12]。25%患者在确诊时即有远处转移,60%在诊断后1年内死亡,5年生存率小于11%[13]。肿瘤分期是影响进展的显著因素,此外,印戒细胞所占的比例与总生存率呈负相关。目前对于预后的判断尚无公认的指标,血清CA199和CEA的升高较常见,两者水平的变化对评估肿瘤进展及预后有重要参考意义。
综上,原发性膀胱浆细胞样/印戒细胞尿路上皮癌发病率非常低,其临床及影像学表现缺乏特异性,恶性程度高,进展迅速,预后极差,较易误诊或漏诊,对其临床及病理特征的深入认识和研究对早期诊治意义重大,治疗上及早行根治性膀胱全切术辅以放化疗等综合手段有望改善预后。
| [1] | Okutur K, Eren OO, Demir G. Metastasis of Gastric Signet-Ring Cell Carcinoma to the Urinary Bladder: A Case Report and Review of the Literature[J]. Case Rep Oncol Med, 2015, 2015 : 127516. |
| [2] | Humphrey PA, Moch H, Cubilla AL, et al. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs—Part B: Prostate and Bladder Tumours[J]. Eur Urol, 2016, 70 (1) : 106–19. DOI:10.1016/j.eururo.2016.02.028 |
| [3] | Kaimakliotis HZ, Monn MF, Cheng L, et al. Plasmacytoid bladder cancer: variant histology with aggressive behavior and a new mode of invasion along fascial planes[J]. Urology, 2014, 83 (5) : 1112–6. DOI:10.1016/j.urology.2013.12.035 |
| [4] | Keck B, Ellmann C, Stoehr R, et al. Comparative genomic hybridization shows complex genomic changes of plasmacytoid urothelial carcinoma[J]. Urol Oncol, 2014, 32 (8) : 1234–9. DOI:10.1016/j.urolonc.2014.06.016 |
| [5] | Olsen DL, Anderson SR. Metastatic plasmacytoid urothelial carcinoma:a case report and review of the literature[J]. Acta Cytol, 2014, 58 (1) : 108–12. DOI:10.1159/000356420 |
| [6] | Wang J, Wang FW, Kessinger A. The impact of signet-ring cell carcinoma histology on bladder cancer outcome[J]. World J Urol, 2012, 30 (6) : 777–83. DOI:10.1007/s00345-011-0718-8 |
| [7] | Terada T. Primary pure signet-ring cell adenocarcinoma of the urinary bladder: a report of three cases with an immunohistochemical study[J]. Med Oncol, 2012, 29 (4) : 2866–9. DOI:10.1007/s12032-011-0122-7 |
| [8] | Hayashi T, Tanigawa G, Fujita K, et al. Two cases of plasmacytoid variant of urothelial carcinoma of urinary bladder: systemic chemotherapy might be of benefit[J]. Int J Clin Oncol, 2011, 16 (6) : 759–62. DOI:10.1007/s10147-011-0240-4 |
| [9] | EI Ammari JE, Ahsaini M, Riyach O, et al. Primary signet-ring cell carcinoma of the urinary bladder successfully managed with cisplatin and gemcitabine: a case report[J]. J Med Case Rep, 2013, 7 : 37–40. DOI:10.1186/1752-1947-7-37 |
| [10] | Hamakawa T, Kojima Y, Naiki T, et al. Long-term survival of a patient with invasivesignet-ring cell carcinoma of the urinary bladder managed by combined s-1 and Cisplatin adjuvant chemotherapy[J]. Case Rep Urol, 2013, 2013 : 915874. |
| [11] | Pugashetti N, Yap SA, Lara PN Jr, et al. Metastatic signet-ring cell carcinoma of the urinary bladder: A novel management approach to a rare tumour[J]. Can Urol Assoc J, 2015, 9 (3-4) : 204–7. DOI:10.5489/cuaj.2447 |
| [12] | Zaghloul MS, Nouh A, Nazmy M, et al. Long-term results of primary a denocarcinoma of the urinary bladder: a report on 192 patients[J]. Urol Oncol, 2006, 24 (1) : 13–20. DOI:10.1016/j.urolonc.2005.05.027 |
| [13] | Wang J, Wang FW. Clinical characteristics and outcomes of patients with primary signet-ring cell carcinoma of the urinary bladder[J]. Urol Int, 2011, 86 (4) : 453–60. DOI:10.1159/000324263 |
 2016, Vol. 43
2016, Vol. 43


