文章信息
- 脂代谢通路及脂代谢异常在癌症中的研究现状
- Pathways of Lipid Metabolism and Their Associated Disorders in Cancer
- 肿瘤防治研究, 2016, 43(10): 907-912
- Cancer Research on Prevention and Treatment, 2016, 43(10): 907-912
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.10.016
- 收稿日期: 2016-03-29
- 修回日期: 2016-07-21
脂质是自然界中存在的一大类不溶于水而易溶解于有机溶剂、在化学成分及结构上非均一的化合物,主要包括脂肪酸及其天然发生的衍生物(如酯或胺),以及与其生物合成和功能相关的化合物。研究表明,哺乳动物细胞含有成千上万种脂质,而且随着新技术与新方法的不断发展,各种新的脂质分子还在不断地被发现[1]。脂质结构的多样性赋予了其多种重要的生物功能,脂质参与调节多种生命活动过程,不仅作为细胞及内部多种细胞器膜的重要组成成分,还在能量转换、物质运输、信息识别与信号传递、细胞发育和分化,以及细胞凋亡等方面对细胞的稳态调节起重要作用。越来越多的基础研究、临床及干预研究、流行病学调查等表明,脂代谢异常可能是癌症发生发展的一个重要因素。近年来,细胞膜及细胞内部脂质组成、分布及含量的变化及脂代谢异常也已经作为多种肿瘤的潜在发病机制而受到越来越多的关注与研究[2-4]。同时,脂质的重要生物功能及其与疾病的关系,加上基因组学、蛋白质组学和代谢组学的发展催生了脂质组学这一新的研究领域。并且新技术与新仪器的开发都极大地推动了各种脂类的定性、定量、功能分析及整体脂质组学的研究。本文从脂代谢通路、不同脂类在癌症中的异常代谢及其研究进展这几个方面对脂代谢在癌症发生发展中的作用与研究现状作一综述。
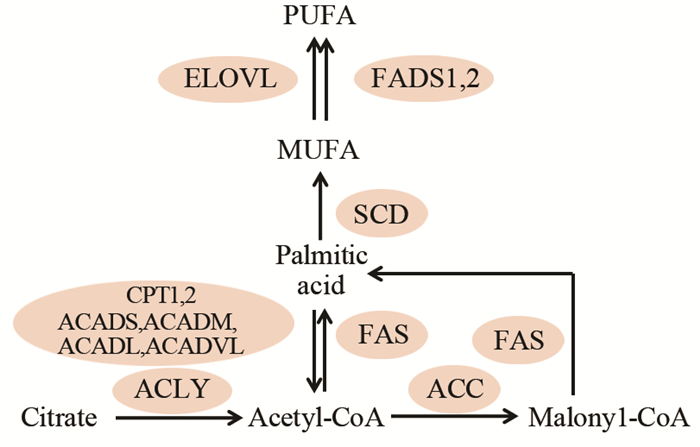
1 脂代谢通路及不同脂类间的相互转化细胞脂质的种类十分丰富。脂肪酸是构成很多复杂脂类的主要成分。脂肪酸代谢主要包括脂肪酸从头合成、脂肪酸氧化、脂肪酸的去饱和及加长而生成不同饱和程度和不同碳链长度的脂肪酸。其中,ATP-柠檬酸裂解酶(ACLY)、乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FAS)、肉碱棕榈酰转移酶(CPT)、不同碳链长度的酰基辅酶A脱氢酶(ACADS、ACADM、ACADL、ACADVL)、去饱和酶SCD、FADS1、FADS2及加长酶ELOVL是脂肪酸代谢过程中的关键酶,在脂代谢稳态中有重要作用[5-6],见图 1。除了从头合成的脂肪酸,另一个脂肪酸的来源是甘油酯、磷脂、鞘脂、固醇脂等脂类通过脂解酶将脂肪酸从这些脂类水解下来。此外,一些必需脂肪酸无法在动物体内合成,因而主要来源于食物[7]。
|
| Ovals represent the enzymes which are responsible for the reactions between different substrates and products 图 1 脂肪酸代谢通路 Figure 1 Metabolic pathways of fatty acids |
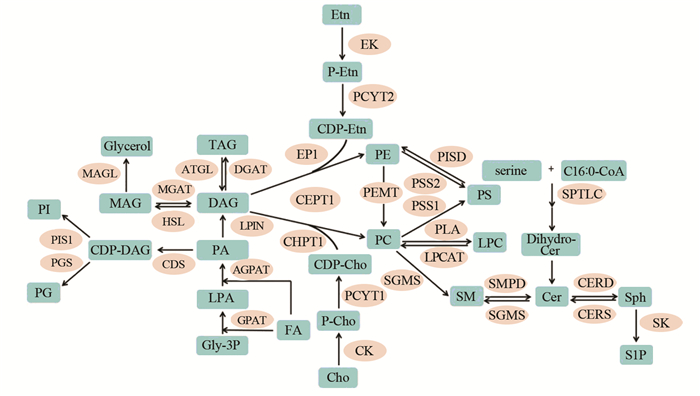
脂肪酸可以合成不同种类的复杂脂质。甘油酯有两种合成途径,其一是酯化途径,通过单酰甘油酰基转移酶(MGAT)、二酰甘油酰基转移酶(DGAT)而进行脂肪酸与甘油酯化反应;另一种途径是甘油三酯的从头合成途径,又名肯尼迪合成途径[8]。以G3P和游离脂肪酸起始,依次在甘油-3-磷酸酰基转移酶(GPAT)、酰基甘油-3-磷酸酰基转移酶(AGPAT或LPAAT)、磷脂酸磷酸水解酶LIPIN及DGAT酶的作用下生成TAG。反过来,通过脂解酶,ATGL,HSL,MAGL可以将合成的TAG逆向依次水解成二酰甘油(DAG),单酰甘油(MAG)和甘油骨架,同时释放游离脂肪酸,见图 2左侧。
|
| The boxes represent the lipids and their precursors, and the ovals represent the enzymes which are responsible for the reactions between different substrates and products 图 2 脂代谢通路及不同脂类的相互转化 Figure 2 Lipid metabolic pathways and interconversion of different lipids |
甘油磷脂是含量最丰富的脂类,也是生物膜的主要成分[9]。甘油磷脂含有至少一个酰基、烷基或烯基相连的脂肪酰侧链,根据不同极性头部分为磷脂酸(PA)、磷脂酰甘油(PG)、磷脂酰肌醇(PI)、磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)等主要类别以及它们水解一个脂肪酸侧链后生成的溶血磷脂(lyso-PL)。不同磷脂的代谢及之间的相互转化构成一个复杂的网络,受多种代谢酶调控,见图 2。PC和PE是丰度最大的磷脂,其合成关键酶主要有PCYT1a、PCYT2、CHPT1或CEPT1、EPT1或CEPT1等基因,而PE又可以通过PEMT通路生成PC,成为PC来源的另一个重要途径。PA作为重要磷脂中间反应物或中间产物,可生成PG、PI等;而PS作为重要的信号通路分子也可以和PC、PE相互转化。
鞘脂包括鞘磷脂(SM)和鞘糖脂(GSP),其共同结构是鞘氨基醇骨架及一个长链脂肪酸侧链,主要在内质网中从头合成。SM和神经酰胺(Ceramide,Cer)可通过鞘磷脂合成酶(SGMS)鞘磷脂水解酶(SMPD)进行相互转化。而Cer除了来源于SM的水解,还可通过丝氨酸和棕榈酰辅酶A从头合成而来,或经神经酰胺合成酶(CERS)合成,见图 2右侧。
2 脂肪酸代谢在癌症中的研究越来越多的研究表明,肿瘤细胞脂肪酸从头合成的增多是癌症发生发展的一个显著特点,并且从头合成的激活与多种类型肿瘤的预后和无病存活期呈负相关,这一表型主要是由于脂生成相关基因在转录、翻译及翻译后修饰、酶活等多水平的上调,以及受这些基因或脂代谢变化而对癌基因的表达产生影响[10-11]。脂生成的增加主要是为了合成更多细胞膜脂以满足癌细胞快速增殖及其对能量需求的飙升。脂生成的关键基因FAS、ACC、ACLY及调节它们表达及活性的关键转录调控因子SREBP1可作为抑制肿瘤新生的靶标,通过相应的基因敲减或化学抑制剂可有效减少肿瘤细胞的增长[12]。与癌症密切相关的另一个脂代谢关键酶是将SFA生成MUFA的去饱和酶SCD1。在肺癌细胞中抑制SCD1可以显著抑制癌细胞在体外的增殖、存活及侵袭能力以及体内的成瘤能力,并且该抑制能力可能是通过MUFA的减少而阻碍细胞通过G1/S期细胞周期并诱发细胞程序性死亡[13],并且在肺癌起始细胞中也被证实扮演重要作用[14]。在前列腺癌及其他类型肿瘤中也证实SCD1表达或活性上调,并且可能通过激活AKT信号通路或抑制AMPK和GSK3进而促进了其下游β-catenin活性及激活相关肿瘤生长信号而促进癌症的发展[15-16]。去饱和酶Delta-5-desaturase(FADS1),Delta-6-desaturase(FADS2)及加长酶(ELOVL1-7)在癌症中的研究相对较少,FADS2在患者乳腺癌组织、黑色素瘤及肺癌小鼠模型中表达增加,活性上调[17-18]。ELOVL7在前列腺癌中高表达,外源过表达EVOLV7通过合成饱和长链脂肪酸促进细胞增殖、存活及体内成瘤,提示前列腺癌中ELOVL7可能成为新的预防、治疗靶点[19]。从脂肪酸种类来看,饱和脂肪酸、反式脂肪酸、Omega-6 PUFA与癌症风险或发生呈正相关,而多不饱和脂肪酸中的Omega-3 PUFA被认为有抑癌效应[20]。Omega-3 PUFA可通过抑制肿瘤细胞增殖及诱导凋亡、促进肿瘤细胞对化疗药物的敏感度而发挥抗癌效应。Gao等对近年来的补充鱼油或n-3 PUFA人群研究进行综合统计分析,结果表明补充鱼油的人群肝癌患病风险可以降低35%,补充n-3 PUFA(EPA或DHA)的人群的风险可降低51%,而单独补充α-亚油酸(ALA)的人群没有降低肝癌的发病率,因此补充n-3 PUFA对降低肝癌风险有明显作用,可独立或协同其他因素作为预防肝癌发生的潜在方案。而Ma等对胰腺癌研究的分析表明,n-3 PUFA也可以通过提高胰腺癌患者的总体生存率而对临床治疗效果起到积极作用而没有其他负面影响。通过Meta分析大规模前瞻性或病例对照研究,结肠直肠癌和乳腺癌的发生率均与体内n-3 PUFA的含量相关,在多种细胞、动物模型中通过补充鱼油可以抑制乳腺癌的发生发展[21-22]。增加n-6 PUFA会加速肿瘤生成,西方饮食中由于n-6 PUFA含量远高于n-3 PUFA而导致n-6/n-3比例升高,因而与心血管疾病,一些自身免疫性疾病以及癌症的发生相关[23-25]。但是至今没有在临床患者研究或流行病学对大规模样本的结果显示饮食或血液、组织中n-6 PUFA/n-3 PUFA与癌症发生发展有明确显著的关系。
3 甘油脂与甘油磷脂代谢在癌症中的研究虽然缺乏明确的实验验证,但是大量流行病学及涉及多病例的临床横断面研究显示,肥胖或超重者中以上癌症的患病风险显著增加,其机制可能是脂肪的累积通过对胰岛素及胰岛素样生长因子的分泌及作用影响而促使肿瘤生长。研究表明,脂肪的累积(主要是甘油三酯)与结肠癌、胰腺癌、肾癌、前列腺癌及乳腺癌等多种癌症的发生率与死亡率有关。目前已知甘油三酯在肿瘤中的作用与其相关水解酶单酰甘油脂解酶(MAGL)有关。在蛋白质组学对多种癌细胞系水解酶的研究中,相比于非恶性细胞,MAGL在黑色素瘤、卵巢癌、乳腺癌的恶性细胞中表达一致上调,外源过表达该基因可促进肿瘤的浸润,抑制其表达又可抑制肿瘤的生长与转移[26]。与此相一致,在肝硬化及肝癌患者血液中,与正常对照相比甘油三酯多个分子及总量都明显降低,有可能与甘油三酯及其下游产物水解酶的表达异常上调有关[27]。而其他甘油酯合成与分解相关酶在肿瘤中还有待研究。
磷脂酰胆碱(PC)的异常代谢是癌细胞的另一标志。在卵巢癌、子宫内膜癌等女性肿瘤中,PC的变化尤其明显,提示PC相关代谢酶有可能通过雌激素及其受体起作用或与之相关联。负责PC从头合成第一步的酶CKα在卵巢癌、子宫内膜癌中都上调,因而导致了PC增加[28-29]。而生成PC的另一条重要途径是从PE经过PEMT酶转变为PC,PEMT在非小细胞肺癌患者中的表达显著上调,并与短的生存期和不良预后呈正相关,因此激活的PC代谢通路可能对于肿瘤的生长和发展是必要的;而在肝癌中PEMT基因表达与活性均显著下调,因此在不同类型的肿瘤中磷脂的代谢变化也可能不同[30-31]。人体另一含量丰富的磷脂PE以及其他磷脂相关代谢酶在癌症中却很少有报道。在基因表达下游的代谢层面,基于质谱检测的代谢组学及脂质组学研究在癌症等疾病的生物标志物筛选和对疾病发展机制、预后及药物疗效等方面扮演着越来越重要的作用。利用影像质谱技术,Ishikawa等发现PC 16:0/18:1和PC 16:0/18:2在甲状腺癌组织中显著高于正常癌旁组织[32]。Patel等在对早发的前列腺癌患者与健康者血清的脂质组学比较后,找到3个关键PC分子ePC 38:5,PC 40:3和PC 42:4可以作为辅助手段判断早期诊断前列腺癌的发生[33]。而在肝癌患者血清中,PC 32:0,PC 32:1和o-PC-34:1在肝癌患者中上调,但是总多不饱和PC是显著下调的[27]。与此一致的是在肝癌组织中,PC、PE及PC/PE的比例都显著下降[34]。
4 鞘脂代谢在癌症中的研究鞘脂在细胞增殖、迁移、炎性反应、对抗癌药物响应等癌细胞相关功能以及预防癌症的发生发展方面都有重要作用[35]。近来,对鞘脂代谢相关酶的鉴定及功能研究取得了很多进展。鞘脂是膜脂质的重要组成并调控着脂双分子层的流动性,并且鞘脂本身是具有生物活性及信号通路调节的作用,其中SM、Cer、Sph、S1P等生物活性脂质是研究最多的。对细胞功能的调控取决于这些关键脂质的动态平衡,它们的浓度与含量的变化会影响细胞命运。
Cer和Sph与细胞凋亡、衰老及生长捕获关系更密切,因此被认为是肿瘤抑制剂,主要通过调节由磷酸酶、组织蛋白酶、端粒酶以及多种激酶等控制的信号通路来介导抑癌功能。支持Cer作为抑癌因子的证据包括临床样本中Cer的减少与星形细胞瘤的恶性程度及不良预后相关,卵巢癌中配对的癌组织与正常组织相比,总的Cer含量减少因而减少肿瘤细胞的凋亡,促进肿瘤发展[36]。相反,SM和S1P对细胞增殖、存活影响更多,S1P含量的增多会激活促增殖、抑凋亡信号,并且可以通过S1P受体(跨膜G蛋白偶联受体)行使促癌作用[37]。此外,鞘脂代谢相关酶,如中性SM水解酶2(nSMase2或SMPD3)通过水解SM增加Cer的水平而抑制增殖、抑制细胞周期。最近两篇研究全基因组的分析表明,在肝细胞癌中SMPD3作为抑癌基因,其过表达会减慢癌细胞的生长,而敲减表达可促进细胞的迁移、浸润[38-39]。而酸性SM水解酶(aSMase)在结肠癌的肝脏转移中却起着抑制癌细胞生长及肿瘤相关巨噬细胞累积的作用,提示不同亚型的SM水解酶可以作为新型抑癌基因而成为潜在抗肿瘤药物靶点。由Sph生成Cer的酶,Cer合成酶(LASS)通过6种不同亚型调控不同碳数长度的Cer合成。在头颈鳞状细胞癌中与正常癌旁组织相比,C18-Cer显著减少,进一步研究表明Lass1的缺失及其导致的C18-Cer的减少与头颈鳞状细胞癌发生和恶化相关,而与正常癌旁组织相比C16-Cer显著增加[40]。这些结果提示不同脂肪酸链的内源Cer发挥着不同的生物功能(如C18-Cer抑增殖促凋亡而C16-Cer促增殖与存活),虽然具体机制还不清楚,但是不同Cer的特定下游靶标及亚细胞定位可能介导了不同细胞不同生物功能效应的调节。与Cer合成酶相反,减少Cer的酶,例如Cer分解酶,在多种癌细胞中促进癌细胞存活,抵抗化疗效应。这些结果都共同表明大部分Cer通过诱导细胞凋亡而作为抑癌因子发挥作用。
鞘磷脂SM是生物体最主要的鞘脂,鞘磷脂合成酶SGMS/SMS与水解酶SMPD共同构成SM循环而调节SM与Cer的含量。尽管Cer在癌症的功能作用研究比较清楚,SM已知的功能却主要是膜结构的重要组分及作为活性脂质的前体。目前在抗肿瘤药物及相关机制方面对SGMS的研究虽然没有像SMPD那样广泛,但是由于SGMS的上调或激活会直接导致抑癌的Cer含量减少,因而SGMS的抑制剂被认为会诱导凋亡而用于抗肿瘤的研究。然而与之相矛盾的一个研究表明,过表达SMS1和SMS2会增加SM和DAG含量进而促进凋亡,相反敲减这两个基因会抑制凋亡[41]。因此SMS在肿瘤中的确切作用与角色还有待进一步研究,或者SMS的生物学功能不仅限于产生SM,可能还存在其他未知功能影响癌症的发生发展。但是至今没有SGMS基因在任何肿瘤中的异常表达以及生物功能效应的报道。综上,不同鞘脂代谢及相互转化形成一个复杂动态网络,在肿瘤增长或抑制中发挥不容忽视的作用,其类似物或拮抗剂可能独立或辅助现有化疗药物作为新型药物靶点,改善抗药性和预后。
5 展望自从Warburg效应等理论提出癌症是一种代谢异常疾病以来,很多学者的研究集中于探索能够使正常细胞向恶性肿瘤细胞转化的特定生化代谢途径,因而可针对该途径或其中的关键代谢物进行干预,以及设计药物靶点以期对肿瘤的发生发展进行控制或逆转。脂代谢是在不同层面多种器官组织中的复杂过程,需要多种基因和代谢酶的共同作用而达到动态平衡。以脂代谢相关基因与酶为潜在抗肿瘤治疗靶点的研究有望为肿瘤的防治开辟新的思路。脂质组学用于癌症生物标志物的相关研究还处于比较初级的阶段,对于脂代谢的相关基因在癌症中的作用及具体机制、涉及到的可能信号通路研究还很缺乏,有待今后在不同类型癌症中确定更多关键脂类、脂质分子,以及相关代谢基因、酶的表达异常与多种癌症发生发展的关系,进而为癌症预防、诊断、治疗及机制研究提供新的思路。
| [1] | Fahy E, Cotter D, Sud M, et al. Lipid classification, structures and tools[J]. Biochim Biophys Acta, 2011, 1811 (11) : 637–47. DOI:10.1016/j.bbalip.2011.06.009 |
| [2] | Huang C, Freter C. Lipid Metabolism, Apoptosis and Cancer Therapy[J]. Int J Mol Sci, 2015, 16 (1) : 924–49. DOI:10.3390/ijms16010924 |
| [3] | Hashmi S, Wang Y, Suman DS, et al. Human cancer: Is it linked to dysfunctional lipid metabolism?[J]. Biochim Biophys Acta, 2015, 1850 (2) : 352–64. DOI:10.1016/j.bbagen.2014.11.004 |
| [4] | Santos CR, Schulze A. Lipid metabolism in cancer[J]. FEBS J, 2012, 279 (15) : 2610–23. DOI:10.1111/ejb.2012.279.issue-15 |
| [5] | Wang Y, Botolin D, Xu J, et al. Regulation of hepatic fatty acid elongase and desaturase expression in diabetes and obesity[J]. J Lipid Res, 2006, 47 (9) : 2028–41. DOI:10.1194/jlr.M600177-JLR200 |
| [6] | Jump DB. Fatty acid regulation of hepatic lipid metabolism[J]. Curr Opin Clin Nutr, 2011, 14 (2) : 115–20. DOI:10.1097/MCO.0b013e328342991c |
| [7] | Kaur N, Chugh V, Gupta AK. Essential fatty acids as functional components of foods-a review[J]. J Food Sci Tech, 2014, 51 (10) : 2289–303. DOI:10.1007/s13197-012-0677-0 |
| [8] | Athenstaedt K, Daum G. The life cycle of neutral lipids: synthesis, storage and degradation[J]. Cell Mol Life Sci, 2006, 63 (12) : 1355–69. DOI:10.1007/s00018-006-6016-8 |
| [9] | Liu Z, Huang X. Lipid metabolism in Drosophila: development and disease[J]. Acta Biochim Biophys Sin(Shanghai), 2013, 45 (1) : 44–50. |
| [10] | Menendez JA, Lupu R. Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis[J]. Nat Rev Cancer, 2007, 7 (10) : 763–77. DOI:10.1038/nrc2222 |
| [11] | Currie E, Schulze A, Zechner R, et al. Cellular fatty acid metabolism and cancer[J]. Cell Metab, 2013, 18 (2) : 153–61. DOI:10.1016/j.cmet.2013.05.017 |
| [12] | Swinnen JV, Brusselmans K, Verhoeven G. Increased lipogenesis in cancer cells: new players, novel targets[J]. Curr Opin Clin Nutr Metab Care, 2006, 9 (4) : 358–65. DOI:10.1097/01.mco.0000232894.28674.30 |
| [13] | Hess D, Chisholm JW, Igal RA. Inhibition of stearoylCoA desaturase activity blocks cell cycle progression and induces programmed cell death in lung cancer cells[J]. PLoS One, 2010, 5 (6) : e11394. DOI:10.1371/journal.pone.0011394 |
| [14] | Noto A, Raffa S, De Vitis C, et al. Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells[J]. Cell Death Dis, 2013, 4 : e947. DOI:10.1038/cddis.2013.444 |
| [15] | Fritz V, Benfodda Z, Rodier G, et al. Abrogation of de novo lipogenesis by stearoyl-CoA desaturase 1 inhibition interferes with oncogenic signaling and blocks prostate cancer progression in mice[J]. Mol Cancer Ther, 2010, 9 (6) : 1740–54. DOI:10.1158/1535-7163.MCT-09-1064 |
| [16] | Angelucci C, Maulucci G, Colabianchi A, et al. Stearoyl-CoA desaturase 1 and paracrine diffusible signals have a major role in the promotion of breast cancer cell migration induced by cancer-associated fibroblasts[J]. Br J Cancer, 2015, 112 (10) : 1675–86. DOI:10.1038/bjc.2015.135 |
| [17] | Pender-Cudlip MC, Krag KJ, Martini D, et al. Delta-6-desaturase activity and arachidonic acid synthesis are increased in human breast cancer tissue[J]. Cancer Sci, 2013, 104 (6) : 760–4. DOI:10.1111/cas.2013.104.issue-6 |
| [18] | He C, Qu X, Wan J, et al. Inhibiting delta-6 desaturase activity suppresses tumor growth in mice[J]. PLoS One, 2012, 7 (10) : e47567. DOI:10.1371/journal.pone.0047567 |
| [19] | Tamura K, Makino A, Hullin-Matsuda F, et al. Novel Lipogenic Enzyme ELOVL7 Is Involved in Prostate Cancer Growth through Saturated Long-Chain Fatty Acid Metabolism[J]. Cancer Res, 2009, 69 (20) : 8133–40. DOI:10.1158/0008-5472.CAN-09-0775 |
| [20] | Saadatian-Elahi M, Norat T, Goudable J, et al. Biomarkers of dietary fatty acid intake and the risk of breast cancer: a meta-analysis[J]. Int J Cancer, 2004, 111 (4) : 584–91. DOI:10.1002/(ISSN)1097-0215 |
| [21] | Gao M, Sun K, Guo M, et al. Fish consumption and n-3 polyunsaturated fatty acids, and risk of hepatocellular carcinoma: systematic review and meta-analysis[J]. Cancer Causes Control, 2015, 26 (3) : 367–76. DOI:10.1007/s10552-014-0512-1 |
| [22] | Ma YJ, Yu J, Xiao J, et al. The consumption of omega-3 polyunsaturated fatty acids improves clinical outcomes and prognosis in pancreatic cancer patients: a systematic evaluation[J]. Nutr Cancer, 2015, 67 (1) : 112–8. DOI:10.1080/01635581.2015.976315 |
| [23] | Jurczyszyn A, Czepiel J, Gdula-Argasinska J, et al. Erythrocyte membrane fatty acids in multiple myeloma patients[J]. Leuk Res, 2014, 38 (10) : 1260–5. DOI:10.1016/j.leukres.2014.08.009 |
| [24] | Liu J, Ma DW. The role of n-3 polyunsaturated fatty acids in the prevention and treatment of breast cancer[J]. Nutrients, 2014, 6 (11) : 5184–223. DOI:10.3390/nu6115184 |
| [25] | Gu Z, Suburu J, Chen H, et al. Mechanisms of omega-3 polyunsaturated fatty acids in prostate cancer prevention[J]. Biomed Res Int, 2013, 2013 : 824563. |
| [26] | Hu WR, Lian YF, Peng LX, et al. Monoacylglycerol lipase promotes metastases in nasopharyngeal carcinoma[J]. Int J Clin Exp Patho, 2014, 7 (7) : 3704–13. |
| [27] | Chen S, Yin P, Zhao X, et al. Serum lipid profiling of patients with chronic hepatitis B, cirrhosis, and hepatocellular carcinoma by ultra fast LC/IT-TOF MS[J]. Electrophoresis, 2013, 34 (19) : 2848–56. |
| [28] | Granata A, Nicoletti R, Tinaglia V, et al. Choline kinase-alpha by regulating cell aggressiveness and drug sensitivity is a potential druggable target for ovarian cancer[J]. Br J Cancer, 2014, 110 (2) : 330–40. DOI:10.1038/bjc.2013.729 |
| [29] | Trousil S, Lee P, Pinato DJ, et al. Alterations of choline phospholipid metabolism in endometrial cancer are caused by choline kinase alpha overexpression and a hyperactivated deacylation pathway[J]. Cancer Res, 2014, 74 (23) : 6867–77. DOI:10.1158/0008-5472.CAN-13-2409 |
| [30] | Zinrajh D, Hörl G, Jurgens G, et al. Increased phosphatidylethanolamine N-methyltransferase gene expression in non-small-cell lung cancer tissue predicts shorter patient survival[J]. Oncol Lett, 2014, 7 (6) : 2175–9. |
| [31] | Tessitore L, Marengo B, Vance DE, et al. Expression of phosphatidylethanolamine N-methyltransferase in human hepatocellular carcinomas[J]. Oncology, 2003, 65 (2) : 152–8. DOI:10.1159/000072341 |
| [32] | Ishikawa S, Tateya I, Hayasaka T, et al. Increased expression of phosphatidylcholine (16:0/18:1) and (16:0/18:2) in thyroid papillary cancer[J]. PLoS One, 2012, 7 (11) : e48873. DOI:10.1371/journal.pone.0048873 |
| [33] | Patel N, Vogel R, Chandra-Kuntal K, et al. A novel three serum phospholipid panel differentiates normal individuals from those with prostate cancer[J]. PLoS One, 2014, 9 (3) : e88841. DOI:10.1371/journal.pone.0088841 |
| [34] | Abel S, De Kock M, van Schalkwyk DJ, et al. Altered lipid profile, oxidative status and hepatitis B virus interactions in human hepatocellular carcinoma[J]. Prostaglandins Leukotr ESSent Fatty Acids, 2009, 81 (5-6) : 391–9. DOI:10.1016/j.plefa.2009.08.003 |
| [35] | Canals D, Perry DM, Jenkins RW, et al. Drug targeting of sphingolipid metabolism: sphingomyelinases and ceramidases[J]. Br J Pharmacol, 2011, 163 (4) : 694–712. DOI:10.1111/j.1476-5381.2011.01279.x |
| [36] | Saddoughi SA, Ogretmen B. Diverse functions of ceramide in cancer cell death and proliferation[J]. Adv Cancer Res, 2013, 117 : 37–58. DOI:10.1016/B978-0-12-394274-6.00002-9 |
| [37] | Delgado A, Fabrias G, Bedia C, et al. Sphingolipid modulation: a strategy for cancer therapy[J]. Anticancer Agents Med Chem, 2012, 12 (4) : 285–302. DOI:10.2174/187152012800228643 |
| [38] | Revill K, Wang T, Lachenmayer A, et al. Genome-wide methylation analysis and epigenetic unmasking identify tumor suppressor genes in hepatocellular carcinoma[J]. Gastroenterology, 2013, 145 (6) : 1424–35. DOI:10.1053/j.gastro.2013.08.055 |
| [39] | Shamseddine AA, Airola MV, Hannun YA. Roles and regulation of neutral sphingomyelinase-2 in cellular and pathological processes[J]. Adv Biol Regul, 2015, 57 : 24–41. DOI:10.1016/j.jbior.2014.10.002 |
| [40] | Koybasi S, Senkal CE, Sundararaj K, et al. Defects in cell growth regulation by C18:0-ceramide and longevity assurance gene 1 in human head and neck squamous cell carcinomas[J]. J Biol Chem, 2004, 279 (43) : 44311–9. DOI:10.1074/jbc.M406920200 |
| [41] | Ding T, Li Z, Hailemariam T, et al. SMS overexpression and knockdown: impact on cellular sphingomyelin and diacylglycerol metabolism, and cell apoptosis[J]. J Lipid Res, 2008, 49 (2) : 376–85. |
 2016, Vol. 43
2016, Vol. 43
