文章信息
- 部分切除术与根治术治疗pT1bN0M0期肾癌的临床疗效对比
- Clinical Outcomes of pT1bN0M0 Renal Cell Carcinoma: Partial Versus Radical Nephrectomy
- 肿瘤防治研究, 2016, 43(10): 883-886
- Cancer Research on Prevention and Treatment, 2016, 43(10): 883-886
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.10.011
- 收稿日期: 2016-04-10
- 修回日期: 2016-05-12
过去二十年以来,肾癌根治术(radical nephrectomy, RN)作为肾癌治疗的标准方案而得到广泛认同[1-2]。但是,RN术后患者肾功能的下降和失代偿一直是临床医师关注的热点[3]。随着影像学等检测手段的进步,偶发性肾癌和小肾癌得以早期发现,因而新的手术方式相继出现,如可保留肾单位的肾部分切除术(partial nephrectomy, PN)[4]。
PN术能够为患者带来许多益处,如降低远期肾功能下降的风险和提高生存质量[5]。因此,目前各大指南均把PN列为治疗小于4 cm肾癌的首选方案[1-2, 4]。而随着手术技巧的进步和人们对生活质量要求的提高,对于4~7 cm的T1b期的肾癌是否也适用于PN术目前还存在争议[6]。因此,本研究回顾性分析了湖北省肿瘤医院pT1b期肾癌接受PN或RN术后的临床疗效和预后评价。
1 资料与方法 1.1 病例收集收集了湖北省肿瘤医院从2004年1月至2010年12月术后病理诊断为pT1bN0M0期的68例肾癌患者的临床和随访资料,其中16例(23.5%)患者接受PN手术,52例(76.5%)患者接受RN手术,手术方式均为开放式。
1.2 围手术期评价指标收集患者的年龄、性别、既往史、随访时间、体重指数BMI、术前症状及病理结果(肿瘤大小、部位、细胞学类型和Fuhrman分级)等信息进行分析。对患者的5年总生存率(overall survival, OS)、5年无复发生存率(recurrence-free survival, RFS)和5年癌症特异性生存率(cancer-specific survival, CSS)进行组间比较。同时分析患者术前和术后第一年的肾功能和肾小球滤过率(estmated glomerular filtration rate, eGFR)指标。
1.3 随访方法及评价指标所有患者在术后一年内每3~6月进行一次随访,此后每年进行一次随访。随访的内容主要包括出现的症状、实验室检查结果及影像学检查结果(彩超或CT)。
1.4 统计学方法5年OS、RFS和CSS使用Kaplan-Meier方法进行比较。患者术后肾功能和eGFR改变使用Mann-Whitney U检验。P < 0.05表示差异有统计学意义,所有检验均为双侧。统计软件使用SigmaPlot 12.5版本。
2 结果 2.1 患者临床资料统计PN组患者的平均年龄为(48.6±10.2)岁,RN组为(55.4±12.3)岁。PN组中位随访时间为(72.4±38.2)月,RN组为(67.6±44.5)月。患者的其他临床数据见表 1。
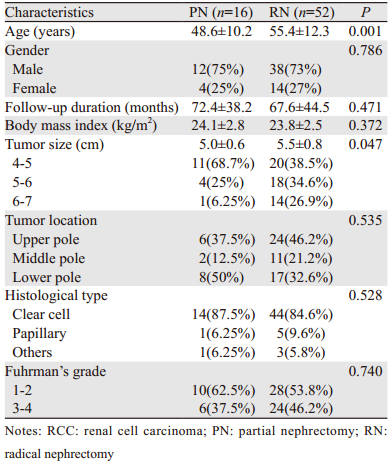
|
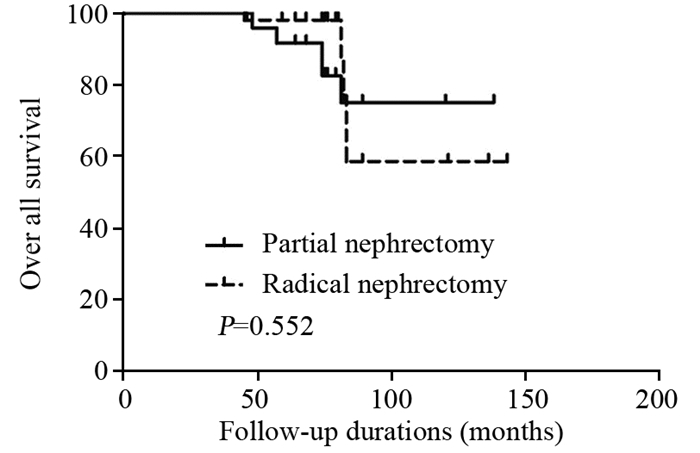
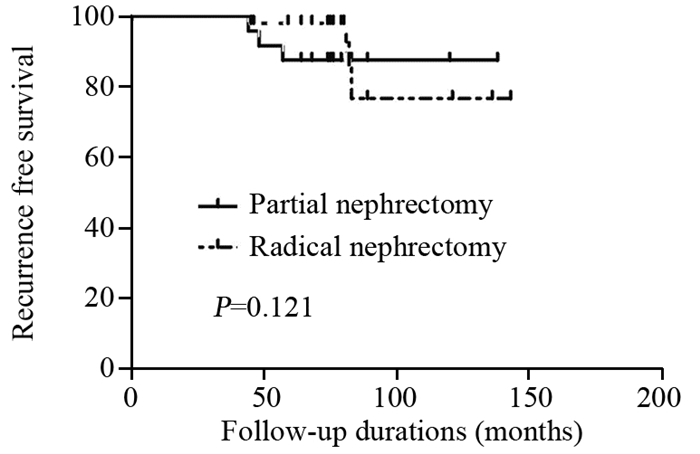
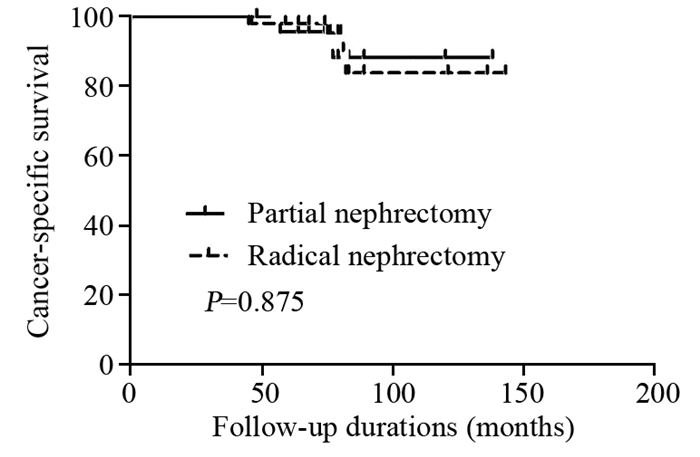
患者接受PN或RN术后的5年OS(90.3% vs. 88.6%, P=0.552)、RFS(90.3% vs. 75.4%, P=0.121)、CSS(90.3% vs. 92.8%, P=0.875),差异均无统计学意义,见图 1~3。
|
| 图 1 肾癌患者接受PN或RN术后5年OS生存曲线图 Figure 1 Postoperative 5-year OS curves of RCC patients who underwent PN or RN |
|
| 图 2 肾癌患者接受PN或RN术后5年RFS生存曲线图 Figure 2 Postoperative 5-year RFS curves of RCC patients who underwent PN or RN |
|
| 图 3 肾癌患者接受PN或RN术后5年CSS生存曲线图 Figure 3 Postoperative 5-year CSS curves of RCC patients who underwent PN or RN |
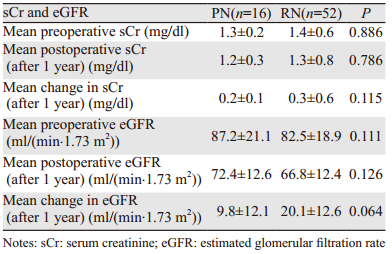
患者术后肾功能下降所占人数RN组显著高于PN组(12.6% vs. 0, P < 0.01)。而术后肾功能和eGFR的改变PN组优于RN组[(0.2±0.1)mg/dl vs.(0.3±0.6)mg/dl, P=0.115, (9.8±12.1)ml/(min.1.73 m2)vs.(20.1±12.6)ml/(min.1.73 m2), P=0.064)],但差异均无统计学意义,见表 2。
|
过去数十年以来,RN都是治疗局限性肾癌的标准治疗方案[1-2, 4]。得益于影像学技术的进步,许多肾脏小肿块得以早期发现,由此使得早期肾癌的发现率明显提高[1]。RN会导致术后肾脏功能下降[7]。同时,许多研究证实了RN是慢性肾病进展的独立风险因素[8-11]。随着外科技术的进步和新的手术方式的出现,PN在过去十年里逐渐得到认可,同时其治疗的安全性和有效性也得到公认[8, 12-13]。因此,PN术目前已经成为治疗小于4 cm T1a期肾癌的金标准[1-2, 14]。
目前关于4~7 cm T1b期肾肿瘤的治疗方式的选择还存在争议[15-17]。有研究表明,对于较大的肾肿瘤( < 7 cm),PN手术同样可行[3, 15]。Badalato等报道了T1b期肾癌患者接受PN和RN术后的5年CSS分别为95%和98%[15]。这些数据表现了较大肾肿瘤采用PN手术的安全性和有效性。
除此之外,PN可以保留部分肾实质,因此可以最大限度地保存肾功能并且提高生存质量[3, 9, 18]。研究表明,与RN相比,PN可以显著降低远期并发症的发生[9, 13, 17]。Becker报道了RN术后的慢性肾功能下降使得心源性死亡和因透析导致死亡的概率分别增加了25%和17%[16]。Huang报道了PN降低了慢性肾功能衰竭和并发症的发生率[9]。Dash比较了PN和RN治疗肾癌的临床疗效,结论认为PN术后肾功能优于RN,而且两组之间临床效果没有显著差别[19]。
在本研究中,PN和RN显示出了相似的疗效,如5年OS、RFS和CSS方面差异均无统计学意义。此外,两组术后肾功能下降所占人数比,PN组显著优于RN组,而两组术后血肌酐和eGFR改变差异无统计学意义。因此,我们的数据表明PN手术治疗pT1b期肾癌安全而且有效。
但本研究为回顾性研究、样本量相对较少、单中心、随访时间较短。此外,由于回顾性研究的本质决定了患者没有被随机分组,由此导致了手术方式选择上的偏倚,例如患者的年龄和肿瘤大小差异在两组间存在统计学意义。因此,在随后的研究中,我们将增加样本数量,延长随访时间,以填补本研究中存在的缺陷。
虽然对于4~7 cm肾癌的治疗目前仍存争议,但我们证明了PN术后患者的生存质量和远期并发症等评价指标要优于RN。因此,PN作为pT1b期肾癌的治疗方式是可行的,而且该术式由于保留了肾单位而可能提高患者远期生存质量[3, 15]。PN是一种安全可行的治疗pT1b期肾癌的手术方案。
| [1] | Ljungberg B, Bensalah K, Canfield S, et al. EAU guidelines on renal cell carcinoma: 2014 update[J]. Eur Urol, 2015, 67 (5) : 913–24. DOI:10.1016/j.eururo.2015.01.005 |
| [2] | Motzer RJ, Jonasch E, Agarwal N, et al. Kidney cancer, version 3.2015[J]. J Natl Compr Canc Netw, 2015, 13 (2) : 151–9. |
| [3] | Bazzi WM, Sjoberg DD, Feuerstein MA, et al. Long-term survival rates after resection for locally advanced kidney cancer: Memorial Sloan Kettering Cancer Center 1989 to 2012 experience[J]. J Urol, 2015, 193 (6) : 1911–6. DOI:10.1016/j.juro.2014.12.022 |
| [4] | Breau RH, Crispen PL, Jenkins SM, et al. Treatment of patients with small renal masses: a survey of the American Urological Association[J]. J Urol, 2011, 185 (2) : 407–13. DOI:10.1016/j.juro.2010.09.092 |
| [5] | Fardoun T, Chaste D, Oger E, et al. Predictive factors of hemorrhagic complications after partial nephrectomy[J]. Eur J Surg Oncol, 2014, 40 (1) : 85–9. DOI:10.1016/j.ejso.2013.11.006 |
| [6] | Sea JC, Bahler CD, Lucas SM, et al. Comparison of Measured Renal Tumor Size Versus R.E.N.A.L. Nephrometry Score in Prediciting Patient Outcomes Following Robot Assisted Laparoscopic Partial Nephrectomy[J]. J Endourol, 2013, 27 (12) : 1471–6. DOI:10.1089/end.2013.0202 |
| [7] | Breda A, Finelli A, Janetschek G, et al. Complications of laparoscopic surgery for renal masses: prevention, management, and comparison with the open experience[J]. Eur Urol, 2009, 55 (4) : 836–50. DOI:10.1016/j.eururo.2009.01.018 |
| [8] | Bagrodia A, Mehrazin R, Bazzi WM, et al. Comparison of rates and risk factors for development of osteoporosis and fractures after radical or partial nephrectomy[J]. Urology, 2011, 78 (3) : 614–9. DOI:10.1016/j.urology.2011.02.071 |
| [9] | Huang WC, Levey AS, Serio AM, et al. Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study[J]. Lancet Oncol, 2006, 7 (9) : 735–40. DOI:10.1016/S1470-2045(06)70803-8 |
| [10] | Parker PA, Swartz R, Fellman B, et al. Comprehensive assessment of quality of life and psychosocial adjustment in patients with renal tumors undergoing open, laparoscopic and nephron sparing surgery[J]. J Urol, 2012, 187 (3) : 822–6. DOI:10.1016/j.juro.2011.10.151 |
| [11] | Broughton GJ, Clark PE, Barocas DA, et al. Tumour size, tumour complexity, and surgical approach are associated with nephrectomy type in small renal cortical tumours treated electively[J]. BJU Int, 2012, 109 (11) : 1607–13. DOI:10.1111/bju.2012.109.issue-11 |
| [12] | Lowrance WT, Yee DS, Maschino AC, et al. Developments in the surgical management of sporadic synchronous bilateral renal tumours[J]. BJU Int, 2010, 105 (8) : 1093–7. DOI:10.1111/bju.2010.105.issue-8 |
| [13] | Deklaj T, Lifshitz DA, Shikanov SA, et al. Laparoscopic radical versus laparoscopic partial nephrectomy for clinical T1bN0M0 renal tumors: comparison of perioperative, pathological, and functional outcomes[J]. J Endourol, 2010, 24 (10) : 1603–7. DOI:10.1089/end.2009.0312 |
| [14] | Takagi T, Kondo T, Iizuka J, et al. Comparison of survival rates in stage 1 renal cell carcinoma between partial nephrectomy and radical nephrectomy patients according to age distribution: a propensity score matching study[J]. BJU Int, 2016, 117 (6B) : E52–9. DOI:10.1111/bju.2016.117.issue-6B |
| [15] | Badalato GM, Kates M, Wisnivesky JP, et al. Survival after partial and radical nephrectomy for the treatment of stage T1bN0M0 renal cell carcinoma (RCC) in the USA: a propensity scoring approach[J]. BJU Int, 2012, 109 (10) : 1457–62. DOI:10.1111/bju.2012.109.issue-10 |
| [16] | Becker A, Ravi P, Roghmann F, et al. Laparoscopic radical nephrectomy vs laparoscopic or open partial nephrectomy for T1 renal cell carcinoma: comparison of complication rates in elderly patients during the initial phase of adoption[J]. Urology, 2014, 83 (6) : 1285–91. DOI:10.1016/j.urology.2014.01.050 |
| [17] | Kim JM, Song PH, Kim HT, et al. Comparison of Partial and Radical Nephrectomy for pT1b Renal Cell Carcinoma[J]. Korean J Urol, 2010, 51 (9) : 596–600. DOI:10.4111/kju.2010.51.9.596 |
| [18] | Thompson RH, Boorjian SA, Lohse CM, et al. Radical nephrectomy for pT1a renal masses may be associated with decreased overall survival compared with partial nephrectomy[J]. J Urol, 2008, 179 (2) : 468–71. DOI:10.1016/j.juro.2007.09.077 |
| [19] | Dash A, Vickers AJ, Schachter LR, et al. Comparison of outcomes in elective partial vs radical nephrectomy for clear cell renal cell carcinoma of 4-7 cm[J]. BJU Int, 2006, 97 (5) : 939–45. DOI:10.1111/bju.2006.97.issue-5 |
 2016, Vol. 43
2016, Vol. 43


