文章信息
- 液相芯片技术检测胃癌血清细胞因子的临床意义
- Clinical Significance of Detection of Multiple Serum Cytokines in Gastric Cancer by Liquid Chip Technology
- 肿瘤防治研究, 2016, 43(10): 870-875
- Cancer Research on Prevention and Treatment, 2016, 43(10): 870-875
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.10.009
- 收稿日期: 2015-12-28
- 修回日期: 2016-01-30
2. 030013 太原,山西省肿瘤医院免疫室;
3. 030013 太原,山西省肿瘤医院体检中心
2. Department of Immunology, Shanxi Cancer Hospital, Taiyuan 030013, China;
3. Department of Health Examination Center, Shanxi Cancer Hospital, Taiyuan 030013, China
胃癌是消化道最常见的恶性肿瘤,在我国其发病率和死亡率均居恶性肿瘤的第三位[1]。虽然胃癌的确切病因至今未明,但近几年的研究证明,炎性反应与一些肿瘤的发病有着密切的关系,并且在肿瘤发生、发展、转移等各个环节中均发挥重要作用。而炎性细胞分泌的一些炎性相关细胞因子,是炎性反应微环境的重要组成部分,炎性因子的变化是机体免疫系统发挥生理或病理作用的直接外在体现,而肿瘤患者血清中炎性相关细胞因子表达水平的改变亦是免疫系统与肿瘤细胞相互作用结果的体现。为探讨炎性反应相关细胞因子在胃癌发病中的作用,本文现采用高通量液相芯片技术检测胃癌患者血清中IL-1β、IL-2、IL-4、IL-5、IL-6、IL-7、IL-8、IL-10、IL-12、IL-13、IL-17A、IL-21、IL-23、TNF-α、IFN-γ、GM-CSF的表达水平。
1 资料与方法 1.1 资料收集胃癌组资料来自于2015年5月—8月就诊于山西省肿瘤医院,经病理组织学明确诊断为胃腺癌,之前未经放疗、化疗或生物免疫治疗的46例患者,其中男38例,女8例,有淋巴结转移者28例,无淋巴结转移者15例;年龄38~74岁,平均年龄(56.5±10.0)岁;健康对照组均为我院健康体检中心经体检合格的健康者30例(对照组),其中男22例,女8例,年龄30~79岁,平均年龄(53.4±14.3)岁。血清标本收集:抽取研究对象清晨空腹外周静脉血4 ml,离心(2 500 r/min, 7 min)留取上层血清,然后分装冻存于-80℃低温冰箱中待检。
1.2 方法采用高通量液相芯片技术同时测定血清IL-1β、IL-2、IL-4、IL-5、IL-6、IL-7、IL-8、IL-10、IL-12、IL-13、IL-17A、IL-21、IL-23、TNF-α、IFN-γ、GM-CSF的表达水平。检测仪器为标准化高通量检测技术平台Luminex200多功能液相芯片分析仪。试剂盒为Milliplex MAP Human High Sensitivity T Cell Kit,由美国Millipore公司提供。实验流程:(1)取出96孔板,每孔加入200 μl洗涤缓冲液,室温振荡10 min,润洗,然后倒掉擦干;(2)分别加50 μl标准品及质控品至相应孔,同时样品孔中加入25 μl实验缓冲液和25 μl样本血清,再向96孔板中每孔均加入25 μl混合磁珠,4℃避光过夜振荡孵育(16~18 h);(3)用手持式磁分离板洗涤3遍,每孔加入50 μl二抗,室温避光振荡1 h;(4)每孔加50 μl SAPE,室温避光振荡30 min;(5)用手持式磁分离板洗涤3遍,最后每孔加入150 μl鞘液,室温振荡器上振荡10 min,上机检测。
1.3 统计学方法运用SPSS17.0统计学软件对实验数据进行处理,采用Shapiro-Wilk检验法对各组数据进行正态性检验,经检验各个细胞因子表达水平不符合正态性分布,用中位数(四分位数间距)(M(QR))描述,组间比较采用Mann-Whitney U检验,相关性分析采用Spearman相关分析,相关系数以r表示。检验水准α=0.05,P < 0.05为差异有统计学意义。
2 结果 2.1 胃癌患者与健康者血清中细胞因子的表达水平与健康对照组比较,胃癌组血清IL-7、IL-8、IL-17A、TNF-α表达水平显著升高,差异具有统计学意义(P < 0.05),其中IL-7、IL-8、TNF-α(P < 0.01)。IL-1β、IL-2、IL-4、IL-5、IL-6、IL-10、IL-12、IL-13、IL-21、IL-23、TNF-α、IFN-γ胃癌组较对照组升高,但差异无统计学意义;GM-CSF胃癌组较对照组降低,差异无统计学意义。两组年龄、性别间差异无统计学意义,见表 1。
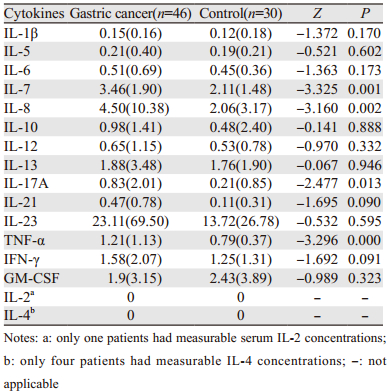
|
各细胞因子在胃癌组中有淋巴结转移组与无淋巴结转移组比较差异无统计学意义(P > 0.05),见表 2。
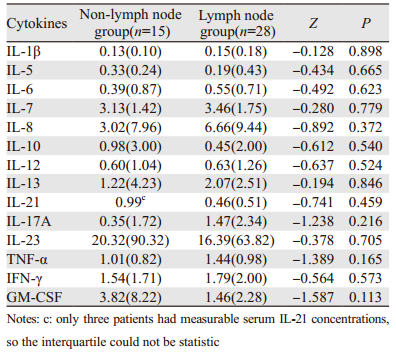
|
胃癌患者血清表达水平IL-1β与IL-6、IL-8、IL-17A、TNF-α成正相关,相关系数r分别为0.407、0.356、0.386、0.333(P < 0.05);IL-6与TNF-α成正相关,r=0.306(P < 0.05);IL-8与IL-17A、TNF-α成正相关,相关系数r分别为0.411, 0.552(P < 0.05);IL-12与IL-1β、IL-6、IL-23成正相关,相关系数r分别为0.668、0.341、0.445(P < 0.05),见表 3。

|
自19世纪Rudolf Virchow观察到肿瘤组织中存在炎性细胞,并首次提出炎性反应和肿瘤之间存在关联的假设后,两者之间的关系即成为学者们研究的焦点。
近年来,通过大量的流行病学、遗传学和分子生物学研究,已获得了有力的证据证实炎性反应与肿瘤之间存在病原/病因学关系[2]。炎性反应对肿瘤发生的影响主要与炎性反应局部细胞释放细胞因子和氧化游离基过多有关,细胞因子对炎性反应的影响既可为促炎作用,也可为抗炎作用, 具有促炎作用的细胞因子如IL-1、IL-6、IL-8、TNF-α等,表现为抗炎作用的细胞因子如IL-10、IL-13等。一些研究表明几种促炎和抗炎细胞因子主要通过以下途径促进肿瘤发展:直接激活NF-κB途径、促进血管再生、上调黏附因子。
3.1 促进细胞因子炎性反应演变细胞因子在慢性炎性反应演变为致癌环境的过程中发挥重要作用,而IL-1β和IL-6可能是最核心的炎性反应介质。
IL-1β是最重要的炎性细胞因子,主要由巨噬细胞产生,其抑酸作用明显,易导致胃炎的发生,进而导致胃萎缩及胃癌的发生[3]。IL-1β通过调节Fas抗原的表达打破细胞增殖与凋亡之间存在的平衡,进而促进胃癌的发生;IL-1β也可通过诱导活化的P38并上调AP-1/c-fos、MMP2和MMP9的表达而促进胃腺癌细胞的转移,P38抑制剂或P38反义RNA(siRNA)可减弱上述效应[4]。在多种肿瘤中均发现IL-1β的表达,并且肿瘤细胞产生的IL-1β是预后不良的指标[5-6]。IL-1β对胃癌的发生、发展的促进作用可能与肿瘤细胞的自分泌有关,亦可能为肿瘤患者体内单核-巨噬细胞和中性粒细胞杀伤作用增强所致。
IL-6是炎性反应与肿瘤联系的另一个重要炎性因子,能够刺激活化B细胞增殖分泌抗体、T细胞增殖、分化及CTL活化和肝细胞合成急性期蛋白,参与炎性反应,在维持Treg细胞和Th17细胞平衡中发挥重要作用。学者们研究发现胃癌组织IL-6 mRNA表达水平较正常组织升高,并且进一步分析发现IL-6与NF-κB蛋白和mRNA表达成正相关,表明抑制IL-6和NF-κB的表达可以作为临床治疗胃癌的潜在靶标[7-8]。高表达IL-6是促进胃癌进展的因素之一[9],与患者的生存时间呈负相关,可作为胃癌预后不良的独立预测指标[10],因此抑制IL-6表达可能有利于肿瘤预后。
IL-8主要由单核-巨噬细胞产生的促炎细胞因子,属于CXC趋化因子家族,能吸引和激活中性粒细胞,释放血管生长因子,促进血管形成,促进中性粒细胞的溶酶体活性和吞噬作用,IL-8可通过活化NF-κB和Akt信号通路诱导黏附分子表达,如ICAM-1、CD44等。现有研究表明IL-8是促进胃癌生长转移和血管新生的关键因子之一。研究发现胃癌患者血清中IL-8表达水平较健康对照组明显升高[11],IL-8通过促进淋巴管内皮细胞的增生、透明质酸受体-1蛋白和mRNA的表达[12],诱导内皮细胞增殖、迁移和上皮间质变,增加胃癌细胞存活率,活化巨噬细胞在肿瘤部位的免疫应答,因此IL-8高表达可促进胃癌的进展和转移,是预后不良的指标[13],IL-8可作为胃癌治疗的重要靶点之一。
本实验中胃癌血清中IL-1β、IL-6表达水平无明显差异,IL-8表达水平较对照组明显升高,提示其可促进胃癌的进展和转移,作为胃癌预后的指标之一,而有无淋巴结转移比较差异无统计学意义,可能与选取病例数量有限有关。
IL-17A主要由CD4+ Th17、CD8+ Tc17细胞产生的促炎细胞因子,可刺激成纤维细胞、内皮细胞、巨噬细胞等产生炎性因子(如TNF-α、IL-6、IL-1β),诱导炎性反应。IL-23是由活化的树突状细胞、单核细胞和巨噬细胞等产生的细胞因子,是IL-12家族成员之一,促进CD4+T细胞向Th17细胞分化,在Th17细胞分泌IL-17中发挥重要作用,并通过产生MMP-9、增加血管形成和减少CD8+T细胞的浸润调节机体的炎性反应免疫。研究表明胃癌患者无论是血清中IL-17A、IL-23还是组织中的IL-17A、IL-23 mRNA表达水平均较健康对照组明显升高,并且还发现IL-23可诱导IL-17A的分泌,两者呈正相关,而IL-17A可活化IL-17A/IL-17RA/NF-κB信号通路促进胃癌进展[14-15]。本研究结果显示胃癌患者血清IL-17A水平较对照组升高,差异具有统计学意义,与上述结果相一致,提示IL-17A可能通过促进血管生成和肿瘤细胞的迁移促进肿瘤的生长[16];而胃癌患者血清IL-23表达水平无差异,IL-17A表达水平与有无淋巴结转移无关,可能与选取的病例数有限及IL-17A在血清中表达水平普遍不高有关,难以发现差异,有待于扩大样本进一步研究。
TNF-α是主要由激活的巨噬细胞产生的抑制胃酸的促炎细胞因子,具有杀伤靶细胞和促进细胞凋亡,参与局部炎性反应和内皮细胞活化的作用,通过激活caspase蛋白酶、JNK和NF-κB三条途径发挥作用,是重要的免疫调节因子,又因其具有细胞毒作用故可抑制肿瘤细胞的生长[17]。本实验中胃癌组TNF-α表达水平较健康对照组升高,差异具有统计学意义,而与有无淋巴结转移无相关性,与Macrì等[18]的结果相一致。对于TNF-α在肿瘤发生发展中所起的作用,学者们的观点也是不一致的,有研究者发现TNF-α可促进胃癌细胞的凋亡,抑制胃癌细胞的侵袭[19],而也有研究者认为肿瘤微环境中TNF-α/TNFR1信号通过诱发Noxo1和Gna14来促进胃癌的发展[20],血清中高水平的TNF-α与患者的生存质量及营养状况呈负相关[21]。因此TNF-α在胃癌患者血清中高表达的临床意义仍然存在争议,可能与其在血清中的表达水平有关,适量的TNF-α有助于维持代谢和对外部压力的保护性反应,而过量的TNF-α会导致炎性反应、多器官损伤和感染性休克而促进肿瘤进展[22],具体机制有待更精确的实验加以探讨。
3.2 抑制细胞因子炎性反应演变IL-7由胸腺细胞、骨髓基质细胞、小肠上皮细胞等产生的细胞因子,是IL-2家族的重要成员之一,具有与IL-2相似的生物学活性,在B细胞、T细胞发育和维持其稳定方面发挥重要作用,在肿瘤中可能通过诱导CD8+T细胞活化,使其产生抗肿瘤效应[23]。研究表明IL-7基因整合至肿瘤细胞后,肿瘤细胞免疫原性增强, 其机制可能与肿瘤细胞表面MHC抗原、ICAM黏附分子以及肿瘤相关蛋白等表达增强有关;IL-7基因修饰瘤苗能诱导机体的抗肿瘤细胞免疫,并使瘤细胞成瘤性下降,显示其与IL-2一样具有抗肿瘤作用。在对肺癌组织中IL-7表达的研究发现,肿瘤患者IL-7及IL-7R高表达,并与临床分期和淋巴结转移均密切相关[24]。本研究结果中胃癌患者血清中IL-7表达水平较对照组升高,差异具有统计学意义,而与有无淋巴结转移无明显相关性,分析可能原因:一是由于血清中的水平无法反应组织中的真实水平,组织中的局部免疫状态无法迅速体现在血清中;二是不同的器官免疫状态及组织特异性不同。故IL-7在胃癌中的作用及作为标志物的可行性有待于更进一步的研究。
IFN-γ是由活化的T细胞及NK细胞产生的细胞因子,IFN-γ能增强NK细胞及杀伤细胞的活性而发挥免疫调节作用,并且可抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、抑制肿瘤血管生成及抑制肿瘤端粒酶活性而具有抗肿瘤效应,Lin等研究发现IFNs通过刺激肿瘤坏死因子超家族成员TRAIL的产生发挥抗肿瘤效应[25]。Li等[26]实验结果显示胃癌患者外周血单个核细胞中Runx3、T-bet和IFN-γ表达水平较健康对照组降低,并且三者表达呈正相关,而Runx3是抑癌基因,其减少可能促进胃癌的进展。而本实验结果中胃癌患者血清中IFN-γ水平较对照组升高,与上述报道不相符,可能与肿瘤的分期或肿瘤微环境中炎性反应有关,早期肿瘤患者免疫功能尚在,能发挥一定的抗肿瘤作用,而晚期免疫功能受到抑制导致细胞因子分泌减少。
GM-CSF主要由活化的T细胞、B细胞、巨噬细胞及内皮细胞等分泌的细胞因子,具有促进粒系祖细胞向粒、巨噬细胞增殖分化及成熟的作用。GM-CSF对肿瘤作用表现为双重性:一方面,体内外实验均表明GM-CSF可以诱导造血干细胞向具有抑制功能的MSC方向分化,并下调抗原特异性CD8+T细胞的效应;GM-CSF还与小鼠多种肿瘤的转移密切相关[27]。另一方面研究显示GM-CSF转染的腺病毒修饰的树突状细胞可产生高水平成熟的GM-CSF,刺激T淋巴细胞增殖的能力更强,并且可以在体外刺激特异性的细胞毒性T细胞到胃癌组织中[28]。本实验中胃癌组GM-CSF表达水平较对照组降低,但差异无统计学意义,其降低趋势可能与肿瘤微环境抑制机体造血细胞的增殖有关。
3.3 细胞因子间相互关系炎性反应相关细胞因子间也存在一个相互作用的网络关系,IL-1β和IL-6可诱导IL-8在肿瘤组织的表达[29];IL-23可诱导Th17细胞分泌IL-17,并且其在胃癌组织中的表达成正相关,提示其在肿瘤发展过程中发挥相似的作用[15];IL-12可刺激效应细胞产生IFN-γ、TNF-α、GM-CSF[30]。但其具体的相互作用机制还有待研究。
肿瘤的形成是一个多因素共同作用的过程,肿瘤的发生和转移与肿瘤所处的内外环境有着密切的关系,而肿瘤微环境中的细胞和细胞因子则通过多种途径参与肿瘤的进展。虽然近几年炎性相关因子与肿瘤关系的研究取得了一定的进展,但其联系通路和具体机制还不是很明朗。因此,深入研究与胃癌关系密切的细胞因子如IL-1β、IL-6、IL-8和TNF-α等,进而明确其中发挥重要作用的关键因子,对于胃癌患者的临床诊断、病情监测以及预后判断将大有助益,并可能为胃癌的治疗提供新的方向。
| [1] | Chen WQ, Zhang SW, Zeng HM, et al. Cancer incidence and mortality in China, 2010[J]. Zhongguo Zhong Liu, 2014, 23 (1) : 1–10. [ 陈万青, 张思维, 曾红梅, 等. 中国2010年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014, 23 (1) : 1–10. ] |
| [2] | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition[J]. J Clin Invest, 2009, 119 (6) : 1420–8. DOI:10.1172/JCI39104 |
| [3] | Xing PX, Kan SF, Wang HC, et al. Serum lever and genotype of interleukin-1β or interleukin-1 receptor antagonist in patients with gastric cancer[J]. Zhonghua Wei Sheng Wu Xue He Mian Yi Xue Za Zhi, 2008, 28 (5) : 435–9. [ 邢培祥, 阚士锋, 王洪春, 等. IL-l血清水平及IL-lB和lL-l受体拮抗剂基因多态性与胃癌关系探讨[J]. 中华微生物学和免疫学杂志, 2008, 28 (5) : 435–9. ] |
| [4] | Huang Q, Lan F, Wang X, et al. IL-1β-induced activation of p38 promotes metastasis in gastric adenocarcinoma via upregulation of AP-1/c-fos, MMP2 and MMP9[J]. Mol Cancer, 2014, 13 : 18. DOI:10.1186/1476-4598-13-18 |
| [5] | Snoussi K, Strosberg AD, Bouaouina N, et al. Genetic variation in pro-inflammatory cytokines (interleukin-1beta, interleukin-1alpha and interleukin-6) associated with the aggressive forms, survival, and relapse prediction of breast carcinoma[J]. Eur Cytokine Netw, 2005, 16 (4) : 253–60. |
| [6] | Liu X, Wang Z, Yu J, et al. Three polymorphisms in interleukin-1beta gene and risk for breast cancer: a meta-analysis[J]. Breast Cancer Res Treat, 2010, 124 (3) : 821–5. DOI:10.1007/s10549-010-0910-3 |
| [7] | Liang J, Li Y, Liu X, et al. Relationship between cytokine levels and clinical classification of gastric cancer[J]. Asian Pacific J Cancer Pre, 2011, 12 (7) : 1803–6. |
| [8] | Yin Y, Si X, Gao Y, et al. The nuclear factor-κB correlates with increased expression of interleukin-6 and promotes progression of gastric carcinoma[J]. Oncol Rep, 2013, 29 (1) : 34–8. |
| [9] | Wang Z, Si X, Xu A, et al. Activation of STAT3 in human gastric cancer cells via interleukin (IL)-6-type cytokine signaling correlates with clinical implications[J]. PLoS One, 2013, 8 (10) : e75788. DOI:10.1371/journal.pone.0075788 |
| [10] | Necula LG, Chivu-Economescu M, Stanciulescu EL, et al. IL-6 and IL-11 as markers for tumor aggressiveness and prognosis in gastric adenocarcinoma patients without mutations in Gp130 subunits[J]. J Gastrointestin Liver Dis, 2012, 21 (1) : 23–9. |
| [11] | Epplein M, Xiang YB, Cai Q, et al. Circulating cytokines and gastric cancer risk[J]. Cancer Causes Control, 2013, 24 (12) : 2245–50. DOI:10.1007/s10552-013-0284-z |
| [12] | Shi J, Li YJ, Yan B, et al. Interleukin-8: A potent promoter of human lymphatic endothelial cell growth in gastric cancer[J]. Oncol Rep, 2015, 33 (6) : 2703–10. |
| [13] | Waugh DJ, Wilson C. The interleukin-8 pathway in cancer[J]. Clin Cancer Res, 2008, 14 (21) : 6735–41. DOI:10.1158/1078-0432.CCR-07-4843 |
| [14] | Zhong F, Cui D, Tao H, et al. IL-17A-producing T cells and association cytokines are involved in the progresssion of gastric cancer[J]. Oncol Rep, 2015, 34 (5) : 2365–74. |
| [15] | Liu C, Zhang Y, Zhan J, et al. Interleukin-23A is associated with tumor growth in Helicobacter-pylori-related human gastric cancer[J]. Cancer Cell Int, 2014, 14 (1) : 104. DOI:10.1186/s12935-014-0104-x |
| [16] | Ji Y, Zhang W. Th17 cells: positive or negative role in tumor?[J]. Cancer Immunol Immunother, 2010, 59 (7) : 979–87. DOI:10.1007/s00262-010-0849-6 |
| [17] | Saito A, Suzuki HI, Horie M, et al. An integrated expression profiling reveals target genes of TGF-beta and TNF-alpha possibly mediated by microRNAs in lung cancer cells[J]. PLoS One, 2013, 8 (2) : e56587. DOI:10.1371/journal.pone.0056587 |
| [18] | Macrì A, Versaci A, Loddo S, et al. Serum levels of interleukin 1beta, interleukin 8 and tumour necrosis factor alpha as markers of gastric cancer[J]. Biomarkers, 2006, 11 (2) : 184–93. DOI:10.1080/13547500600565677 |
| [19] | Hu SJ, Jiang RX, Xie HH, et al. Purification of a Pd20–TNFα fusion protein that prevents liver metastasis of gastric cancer[J]. Tumour Biol, 2014, 35 (8) : 7523–9. DOI:10.1007/s13277-014-1957-2 |
| [20] | Oshima H, Ishikawa T, Yoshida GJ, et al. TNF-α/TNFR1 signaling promotes gastric tumorigenesis through induction of Noxo1 and Gna14 in tumor cells[J]. Oncogene, 2014, 33 (29) : 3820–9. DOI:10.1038/onc.2013.356 |
| [21] | Correia M, Cravo M, Marques-Vidal P, et al. Serum concentrations of TNF-alpha as a surrogate marker for malnutrition and worse quality of life in patients with gastric cancer[J]. Clin Nutr, 2007, 26 (6) : 728–35. DOI:10.1016/j.clnu.2007.08.014 |
| [22] | Song XY, Zhou SJ, Xiao N, et al. Research on the relationship between serum levels of inflammatory cytokines and non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2013, 14 (8) : 4765–8. DOI:10.7314/APJCP.2013.14.8.4765 |
| [23] | Yuan CH, Yang XQ, Zhu CL, et al. Interleukin-7 Enhances the in Vivo Anti-tumor Activity of Tumor-reactive CD8+ T cells with Induction of IFN-gamma in a Murine Breast Cancer Model[J]. Asian Pac J Cancer Prev, 2014, 15 (1) : 265–71. DOI:10.7314/APJCP.2014.15.1.265 |
| [24] | Ming J, Zhang QF, Jiang YD, et al. The Expressions of IL-7 and IL-7R and the Relationship between them with Lymph Node Metastasis and Prognosis in Non-small Cell Lung Cancer[J]. Zhongguo Fei Ai Za Zhi, 2010, 13 (12) : 1101–6. [ 明健, 张清富, 姜彦多, 等. IL-7/IL-7R在非小细胞肺癌中的表达及淋巴转移和预后的关系[J]. 中国肺癌杂志, 2010, 13 (12) : 1101–6. ] |
| [25] | Lin WW, Karin M. A cytokine-mediated link between innate immunity, inflammation, and cancer[J]. J Clin Invest, 2007, 117 (5) : 1175–83. DOI:10.1172/JCI31537 |
| [26] | Li Y, Ji X, Su Z, et al. Downregulation of Runx3 is closely related to the decreased Th1-associated factors in patients with gastric carcinoma[J]. Tumour Biol, 2014, 35 (12) : 12235–44. DOI:10.1007/s13277-014-2532-6 |
| [27] | Cao XT. Growth and metastasis of tumors: Forum on immunological perspective[J]. Zhongguo Zhong Liu Sheng Wu Zhi Liao Za Zhi, 2007, 14 (1) : 2–6. [ 曹雪涛. 肿瘤生长与转移中的免疫学问题[J]. 中国肿瘤生物治疗杂志, 2007, 14 (1) : 2–6. ] |
| [28] | He SB, Wang L, Sun K, et al. Enhanced anti-tumor immunity ex vivo induced by GM-CSF gene transductedd endritic cell vaccine[J]. Zhong De Lin Chuang Zhong Liu Xue Za Zhi(Ying Wen Ban), 2011, 10 (3) : 178–82. |
| [29] | Liu X, Ye F, Xiong H, et al. IL-1beta upregulates IL-8 production in human Muller cells through activation of the p38 MAPK and ERK1/2 signaling pathways[J]. Inflammation, 2014, 37 (5) : 1486–195. DOI:10.1007/s10753-014-9874-5 |
| [30] | Floros T, Tarhini AA. Anticancer cytokines: biology and clinical effects of Interferon-α2, Interleukin (IL)-2, IL-15, IL-21, and IL-12[J]. Semin Oncol, 2015, 42 (4) : 539–48. DOI:10.1053/j.seminoncol.2015.05.015 |
 2016, Vol. 43
2016, Vol. 43


