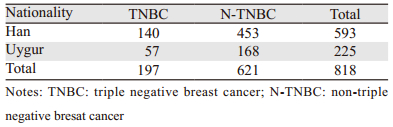文章信息
- 汉族和维吾尔族三阴性乳腺癌患者组织中E-cad及VEGF的表达差异
- Analysis E-cad and VEGF Expression in Triple-negative Breast Cancer of Han and Uygur
- 肿瘤防治研究, 2016, 43(10): 858-862
- Cancer Research on Prevention and Treatment, 2016, 43(10): 858-862
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.10.007
- 收稿日期: 2016-02-05
- 修回日期: 2016-05-23
三阴性乳腺癌(triple negative breast cancer, TNBC)是近年来乳腺癌研究关注的焦点,其缺乏雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)表达,和非三阴性乳腺癌(N-TNBC)相比,生存期短,临床预后差,老年患者和年轻患者有着相似的生存率[1-2]。
E-cad由位于染色体16q22.1的CDH1基因合成,是一种细胞黏附分子,介导细胞分子识别和结合,与肿瘤浸润和转移有关[3]。而VEGF是一种重要的血管生成调控因子,过度表达会导致细胞增殖和迁移;促进肿瘤新生血管的形成,与肿瘤生长关系密切[4]。
中国是幅原辽阔的多民族国家,中国人的遗传背景在大致相似的基础上又各有地方特色,有研究显示不同民族TNBC分子生物学特征也不尽相同,与汉族比较,维吾尔族TNBC乳腺癌患者肿块较大、分期偏晚[5-6],本研究通过检测中国新疆地区汉、维吾尔族女性TNBC患者组织中E-cad及VEGF的阳性表达情况,分析其是否存在差异,并探讨其与预后间的关系,为不同民族TNBC患者的异种亚型分析提供数据[7],同时也为进一步了解影响TNBC患者的预后因素提供一定的依据。
1 资料与方法 1.1 一般资料收集2008年3月至2010年3月于新疆医科大学附属肿瘤医院住院的乳腺癌患者818例,选择其中ER、PR以及HER2经我院免疫组织化学确认均为阴性的患者197例。其中汉族患者140例,维吾尔族患者57例,见表 1。纳入标准:(1)我院首次治疗的可手术的汉、维吾尔族女性乳腺癌患者;(2)临床病理资料完整;(3)ER、PR及HER2表达均阴性的患者。
采用PV-9000法测定E-cad、VEGF的表达,试剂盒及兔抗人E-cad单抗、鼠抗人VEGF单抗均购自北京中杉金桥生物技术有限公司,一抗稀释度均为1:100,实验严格按照质量控制内容进行操作。组织经10%甲醛固定,石蜡包埋,4 μm连续切片,二甲苯脱蜡,梯度乙醇水化,3%过氧化氢封闭内源性过氧化氢酶,滴加一抗、二抗,DAB染色,苏木精对比染色。用已知阳性表达的癌组织作阳性对照,PBS代替一抗作阴性对照,结果采取两人双盲法观察切片。
1.3 结果判读标准E-cad及VEGF结果判读:两者按阳性细胞所占比例:阴性表达为细胞质内棕褐色染色 < 25%,分值为0分;低度阳性(+)表达为25%~ < 50%细胞质内呈棕褐色染色,分值为1分;中等强度(++)表达为细胞质内染色50%~75%,2分;强阳性(+++)表达为细胞质内染色 > 75%,细胞质内弥漫棕褐色染色,分值为3分。按染色程度:无阳性染色为0分,细胞轻度着色为1分,中度着色为2分,重度着色3分。最后分别将E-cad和VEGF的分值相加,总分值≤2分为阴性, > 3分为阳性。
1.4 随访采用入院定期复查和电话追踪等随访方式,将患者手术开始时间定为起始时间,复发转移为终止事件,随访时间以月为单位,总时间为5年,随访截至2015年3月30日。
1.5 统计学方法采用SPSS18.0统计软件进行数据处理,两组比较采用χ2检验;E-cad和VEGF与淋巴结转移数、TNM分期及组织学分级比较采用Spearman秩相关分析,Kaplan-Meier法计算5年无瘤生存情况,两组曲线比较用Log rank检验,α=0.05为检验水准。
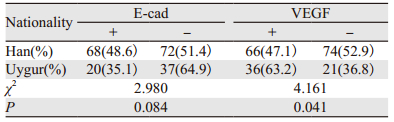
2 结果 2.1 E-cad和VEGF在不同民族TNBC患者组织中的表达情况PV9000免疫组织化学染色结果显示E-cad和VEGF阳性表达均位于肿瘤细胞的细胞膜和细胞质中,呈棕黄色或棕褐色,见图 1。140例汉族患者E-cad阳性表达68例,阳性率为48.6%,57例维吾尔族患者E-cad为20例,阳性率35.1%,汉族VEGF阳性表达66例,阳性率为47.1%,维吾尔族VEGF为36例,阳性率为63.2%,汉族女性TNBC患者VEGF阳性率表达低于维吾尔族女性患者,差异有统计学意义(P < 0.05),但E-cad的表达,两组无明显差异,见表 2。

|
| A: positive expression of E-cad; B: negative expression of E-cad; C: positive expression of VEGF; D: negative expression of VEGF ` 图 1 E-cad和VEGF免疫组织化学结果(PV-9000, DAB×200) Figure 1 E-cad and VEGF immunohistochemical expression results (PV-9000, DAB×200) |
|
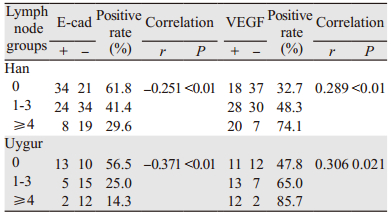
通过比较汉族与维吾尔族女性TNBC患者E-cad及VEGF在不同淋巴结分组的表达情况显示,随着淋巴结转移个数的增加,E-cad的阳性表达逐渐降低,未发生淋巴结转移情况下汉族E-cad表达为61.8%,维吾尔族为56.5%,而在发生淋巴结转移的情况,特别是≥4个时,汉族E-cad阳性表达只有29.6%,维吾尔族为14.3%。两者呈负相关关系(-1≤r < 1, P < 0.05)。VEGF的阳性表达则逐渐增高,VEGF阳性表达≥4个淋巴结组汉族为74.1%,维吾尔族为85.7 %;两者呈正相关关系(0 < r < 1, P < 0.05),见表 3。
|
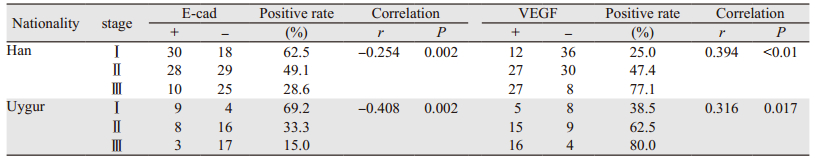
两组患者E-cad的阳性表达Ⅰ期均高于Ⅱ、Ⅲ期,而VEGF的阳性率Ⅲ期均高于Ⅰ、Ⅱ期,相关性分析结果提示:随着TNM临床分期的增高,两组患者E-cad的表达缺失情况逐渐升高,差异有统计学意义(-1≤r < 1, P < 0.05);VEGF的阳性率则随TNM增高而逐渐增高,差异有统计学意义(0 < r < 1, P < 0.05),见表 4。
|
E-cad在汉族与维吾尔族女性TNBC组织学分级越高,其表达缺失更明显,两者呈负相关关系,差异有统计学意义(-1≤r < 1, P < 0.05);而VEGF表达与组织学分级无明显相关,差异无统计学意义(P > 0.05),见表 5。
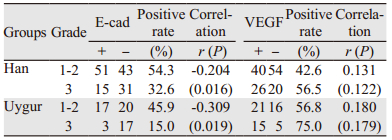
|
所有病例均完成定期随访复查,截至2015年3月,汉族TNBC患者复发转移37例(37/140, 26.4%),维吾尔族患者复发转移19例(19/57, 33.3%),Log rank=1.163, P=0.281,5年无瘤生存情况两组差异无统计学意义,见图 2。
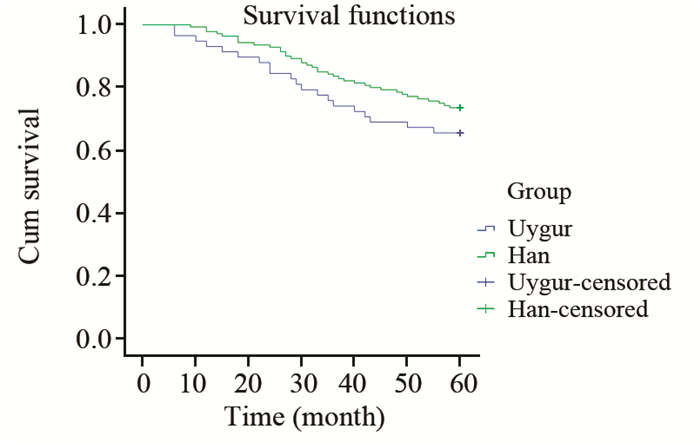
|
| 图 2 两组三阴性乳腺癌患者5年无瘤生存情况 Figure 2 5 year Disease free survival rate of TNBC |
TNBC分子生物学特征复杂,与N-TNBC相比,有着不同的临床病理特征及预后。E-cad与VEGF对肿瘤的发生发展都起到重要作用,本文就TNBC在汉、维族间的E-cad、VEGF表达差异做一分析研究,进一步了解影响TNBC的发生发展因素。
E-cad是一种细胞黏附分子,其跨膜糖蛋白结构分布三个不同的区域:分别为胞质内,跨膜区和细胞外。其中胞质部分起到信号转导的作用[8]。E-cad在细胞运动和肿瘤发生侵袭期间上皮-间质转化进程以及外渗和迁移过程中起关键作用[9],E-cad表达的缺失是上皮肿瘤侵袭和转移能力的关键[10]。研究表明,E-cad的低表达是肿瘤预后差的标志,与DFS显著相关[11-12]。
VEGF可与血管内皮细胞发生特异性结合,刺激血管内皮细胞增殖,促进肿瘤新生血管形成,为肿瘤细胞的转移提供基础,与肿瘤生长关系密切[13]。研究显示,VEGF在TNBC中的高表达与其5年生存率差有明显关系,VEGF高表达提示预后较差[14-15]。其有可能成为TNBC治疗的新靶点[16]。研究显示,贝伐单抗(抗VEGF抗体)联合表阿霉素+环磷酰胺+多西他赛方案使TNBC患者的病理缓解率从27.9%增加至39.3%[17]。
本研究结果显示汉、维吾尔族女性TNBC中E-cad的表达差异无统计学意义;而VEGF阳性表达两组差异有统计学意义,汉族组明显低于维吾尔族组,产生此种差异的原因,可能与维吾尔族TNBC患者就诊时病期较晚有关,需进一步研究证实。
研究认为,肿瘤细胞的侵蚀能力与E-cad表达水平呈负相关[18],通过技术干扰过表达E-cad可有效抑制肿瘤细胞的侵蚀能力[19],E-cad在TNBC的发生发展过程中,起到重要作用,可以作为TNBC的预后指标[11, 20],本研究中,无论是在汉族组,还是维吾尔族组,观察到E-cad的表达与淋巴结转移状态、TNM分期及组织学分级呈负相关关系,随着淋巴结转移数目的增多、临床分期越晚、组织学分级越高,E-cad的表达缺失越明显,而E-cad的表达缺失,影响着TNBC患者的预后,国内一项研究显示:E-cad阴性患者的5年总生存率和无病生存率均低于E-cad阳性患者[21]。
VEGF在TNBC中过表达,与淋巴结转移、肿瘤分期有一定相关性,且易致TNBC早期复发、转移,通常预后较差[22]。有项对复发TNBC的研究认为[23],在TNBC的不同阶段,VEGF基因表达分布也显著不同,本研究显示,VEGF阳性表达率与汉族、维吾尔族TNBC患者的淋巴结转移数目及TNM分期呈现正相关关系,VEGF阳性表达随着淋巴结转移数目及TNM分期的增高而逐渐升高,说明VEGF在TNBC的进展过程中起到了一定作用,但与组织学分级没有明显相关,与国外报道研究一致[24]。
通过随访发现汉族与维吾尔族TNBC患者5年无瘤生存率无差别,但VEGF阳性率表达差异有统计学意义;表明VEGF可作为判断TNBC预后的独立因素,当其在乳腺癌患者中高表达时,往往提示预后较差[25]。本研究发现VEGF在维吾尔族TNBC患者的阳性表达率高于汉族患者,但两者的5年无病生存率无明显差别,同时两组E-cad的表达差异也没有统计学意义,而有文献报道,在非三阴性乳腺癌的预后当中,维吾尔族Lumina A型乳腺癌患者6年无瘤生存率低于汉族患者[5],因此推测,维吾尔族TNBC患者的预后,可能存在与汉族女性患者不同的影响因素,由于本研究样本量较少,建议增加样本量进一步研究证实。
| [1] | Millikan RC, Newman B, Tse CK, et al. Epidemiology of basal-like breast cancer[J]. Breast Cancer Res Treat, 2008, 109 (1) : 123–39. DOI:10.1007/s10549-007-9632-6 |
| [2] | Bulut N, Altundag K. Excellent clinical outcome of triple-negative breast cancer in younger and older women[J]. J BUON, 2015, 20 (5) : 1276–81. |
| [3] | Martin-Belmonte F, Perez-Moreno M. Epithelial cell polarity, stem cells and cancer[J]. Nat Rev Cancer, 2012, 12 (1) : 23–38. |
| [4] | Kim MS, Park TI, Lee YM, et al. Expression of id-1 and VEGF in non-small cell lung cancer[J]. Int J Clin Exp Pathol, 2013, 6 (10) : 2102–11. |
| [5] | Qiu XJ, Cheng F, Liu Y. Clinicopathological characteristics and prognosis of 1006 Uygur and Han patients with different molecular subtypes of breast cancer[J]. Zhong Liu, 2015, 35 (3) : 292–300. [ 邱秀娟, 成芳, 刘莹. 新疆1006例维吾尔族与汉族不同分子分型乳腺癌患者的临床病理特征及生存分析[J]. 肿瘤, 2015, 35 (3) : 292–300. ] |
| [6] | Jiang WH, Ou JH, Zhang GQ, et al. Triple negative breast cancer of Han and Uygur: clinical features and Prognosis[J]. Zhongguo Zhong Liu Lin Chuang, 2011, 38 (24) : 1579–83. [ 蒋威华, 欧江华, 张国庆, 等. 汉族与维吾尔族三阴性乳腺癌临床特征及预后差异分析[J]. 中国肿瘤临床, 2011, 38 (24) : 1579–83. ] |
| [7] | Karn T, Rody A, Müller V, et al. Control of dataset bias in combined Affymetrix cohorts of triple negative breast cancer[J]. Genom Data, 2014, 2 : 354–6. DOI:10.1016/j.gdata.2014.09.014 |
| [8] | Nelson WJ. Regulation of cell-cell adhesion by the cadherin-catenin complex[J]. Biochem Soc Trans, 2008, 36 (Pt 2) : 149–55. |
| [9] | Chao YL, Shepard CR, Wells A. Breast carcinoma cells re-express E-cadherin during mesenchymal to epithelial reverting transition[J]. Mol Cancer, 2010, 9 : 179. DOI:10.1186/1476-4598-9-179 |
| [10] | Kashiwagi S, Yashiro M, Takashima T, et al. Significance of E-cadherin expression in triple-negative breast cancer[J]. Br J Cancer, 2010, 103 (2) : 249–55. DOI:10.1038/sj.bjc.6605735 |
| [11] | Tang D, Xu S, Zhang Q, et al. The expression and clinical significance of the androgen receptor and E-cadherin in triple-negative breast cancer[J]. Med Oncol, 2012, 29 (2) : 526–33. DOI:10.1007/s12032-011-9948-2 |
| [12] | Kashiwagi S, Yashiro M, Takashima T, et al. Advantages of adjuvant chemotherapy for patients with triple-negative breast cancer at StageⅡ: usefulness of prognostic markers E-cadherin and Ki67[J]. Breast Cancer, 2011, 13 (6) : R122. DOI:10.1186/bcr3068 |
| [13] | Kim MS, Park TI, Lee YM, et al. Expression of id-1 and VEGF in non-small cell lung cancer[J]. Int J Clin expe Pathol, 2013, 6 (10) : 2102–11. |
| [14] | Greenberg S, Rugo HS. Triple-negative breast cancer:role of antiangiogenic agents[J]. Cancer J (Sdbury Mass), 2010, 16 (1) : 33–8. DOI:10.1097/PPO.0b013e3181d38514 |
| [15] | Linderholm BK, Hellborg H, Johansson U, et al. Significantly higher levels of vascula r endothelial growth factor(VEGF) and shorter survival times for patients with primary operable triple-negative breast cancer[J]. Ann Oncol, 2009, 20 (10) : 1639–46. DOI:10.1093/annonc/mdp062 |
| [16] | Bahhnassy A, Mohanad M, Shaarawy S, et al. Transforming growth factor-β, insulin-like growth factorⅠ/insulin-like growth factorⅠreceptor and vascular endothelial growth factor-A: prognostic and predictive markers in triple-negative and non-triple-negative breast cancer[J]. Mol Med Rep, 2015, 12 (1) : 851–64. |
| [17] | Minkwitz G, Eidtmann H, Rezai M, et al. Neoadjuvant chemotherapy and bevacizumab for HER2-negative breast cancer[J]. N Engl J Med, 2012, 366 (4) : 299–309. DOI:10.1056/NEJMoa1111065 |
| [18] | Canel M, Serrels A, Frame MC, et al. E-cadherin-integrin crosstalk in cancer invasion and metastasis[J]. J Cell Sci, 2013, 126 (Pt 2) : 393–401. |
| [19] | Techasen A, Loilome W, Namwat N, et al. Loss of E-cadherin promotes migration and invasion of cholangiocarcinoma cells and serves as a potential marker of metastasis[J]. Tumour Biol, 2014, 35 (9) : 8645–52. DOI:10.1007/s13277-014-2087-6 |
| [20] | Pang H, Lu H, Song H, et al. Prognostic values of osteopontin-c, E-cadherin and β-catenin in breast cancer[J]. Cancer Epidemiol, 2013, 37 (6) : 985–92. DOI:10.1016/j.canep.2013.08.005 |
| [21] | Sun T, Yao YF, Gong JP, et al. Expression of E-cadherin in the Triple Negative Breast Cancer[J]. Zhong Liu Ji Chu Yu Lin Chuang, 2014, 27 (1) : 8–10. [ 孙弢, 姚宇锋, 龚建平, 等. E-钙黏蛋白在三阴性乳腺癌组织中的表达[J]. 肿瘤基础与临床, 2014, 27 (1) : 8–10. ] |
| [22] | Rakha EA, EI-sayed ME, Green AR, et al. prognostic markers in triple-negative breast cancer[J]. Cancer, 2007, 109 (1) : 25–32. DOI:10.1002/(ISSN)1097-0142 |
| [23] | Tsai CH, Chiu JH, Yang CW, et al. Molecular characteristics of recurrent triple-negative breast cancer[J]. Mol Med Rep, 2015, 12 (5) : 7326–34. |
| [24] | Jobim FC, SchwartsmannG, Xavier NL, et al. Expression of MMP-9 and VEGF in breast cancer :correlation with other prognostic indicators[J]. Rev Bras Ginecol Obstct, 2008, 30 (6) : 287–93. DOI:10.1590/S0100-72032008000600004 |
| [25] | Sorlie T, Tibshirani R, Parker J, et al. Repeated observation of breast tumor subtypes in independent gene expression data sets[J]. Proc Natl Acad Sci U S A, 2003, 100 (14) : 8418–23. DOI:10.1073/pnas.0932692100 |
 2016, Vol. 43
2016, Vol. 43