文章信息
- 免疫检查点阻断剂在肝癌治疗中的研究进展
- Advance of Immune Checkpoint Inhibitors in Therapy of Liver Cancer
- 肿瘤防治研究, 2016, 43(9): 811-813
- Cancer Research on Prevention and Treatment, 2016, 43(9): 811-813
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.09.017
- 收稿日期: 2015-11-27
- 修回日期: 2016-05-06
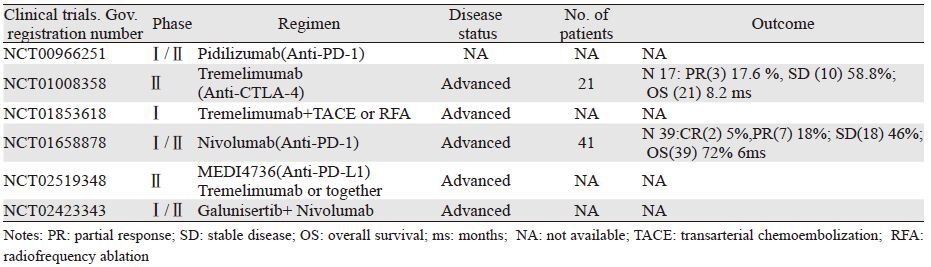
肝癌是病死率最高的恶性肿瘤之一,据最新肿瘤流行病学调查显示,全球每年肝癌死亡病例有近69.6万[1],其中男性发病率及死亡率均明显高于女性[1-2]。目前手术和射频消融是肝癌治疗的首要方法,而全身化疗及介入治疗,如:经动脉化疗栓塞(transarterial chemoembolization,TACE)和选择性动脉放疗(selective intra-arterial radiotherapy,SIRT)则主要用于晚期肝癌患者的姑息性治疗[3]。在免疫治疗方面,多激酶阻断剂Sorafenib是目前美国FDA批准用于治疗肝癌的唯一靶向药物,但也只有2%的患者出现客观肿瘤缓解(病灶缩小超过30%),中位总生存期10.7月,仅比对照组多2.8月左右[4]。因此,探索新的免疫靶向治疗肝癌的药物迫在眉睫。目前免疫检查点阻断剂在恶性黑色素瘤、非小细胞肺癌、膀胱癌、前列腺癌、肾细胞癌以及淋巴瘤等临床试验中均取得了不错的疗效[5-7],但是针对肝癌的临床试验研究相对较少,见表 1。本文就目前肝癌中免疫检查点阻断剂相关研究进展作一综述。
|
PD-1为免疫阻断性受体,主要表达于T细胞、B细胞、活化的单核细胞、树突状细胞及自然杀伤性细胞等[8],其配体包括PD-L1(又称为B7-H1)和PD-L2(又称为B7-DC),PD-1与PD-L结合可阻断T细胞活化、增殖及细胞因子(如IFN-γ等)的产生,发挥着负性免疫调节作用[9]。同时,研究[10]发现肝癌患者外周血中PD-1+CD8+T细胞数目明显高于健康组和肝硬化组;进一步发现,肿瘤浸润部位PD-1+CD8+T细胞同样有明显增多的现象。应用PD-1阻断剂可恢复T细胞的活性及功能,减轻患者免疫抑制状态,从而达到抗肿瘤的目的[11]。目前用于临床研究的PD-1阻断剂主要有Nivolumab(MDX-1106/BMS-936558/ONO-4538)、CT-011、Lambrolizumab(MK-3475)和AMP-224[11],其中以Nivolumab在肝癌的临床研究中较多。
PD-1阻断剂Nivolumab是人源化IgG4单克隆抗体,可以有效阻断PD-1/PD-L通路,恢复T细胞的抗肿瘤能力。2015年ASCO会议报道了Nivolumab治疗晚期肝癌安全性和抗肿瘤效力的Ⅰ/Ⅱ期临床研究(CA209-040)的前期结果[12],该研究纳入了41例Child-Pugh评分为5(n=35)和6(n=6)、ECOG评分为0(n=26)和1(n=15)的患者。患者以剂量递增形式接受Nivolumab 0.1~10 mg/kg静脉注射,主要终点是安全性。治疗过程中有21例患者因疾病进展(PD;n=17)、药物相关不良事件(AEs;n=2)和非药物相关AEs(n=2)停止治疗;另有2例患者出现完全缓解(CR)也停止了用药,剩余18例患者仍在研究中。不同级别药物相关AEs主要发生在29例患者中(71%;17%的为3/4级),主要为谷草转氨酶(AST)升高(17%)、皮疹(17%)、丙氨酸氨基转移酶(ALT)升高(12%)和脂肪酶升高(12%)。其中超过5%的3/4级AEs表现为AST、ALT和脂肪酶升高。39例患者中的缓解评估情况:2例CR(5%),7例PR(18%),18例SD(46%)。其中CR、PR的缓解持续时间分别为14~17月和1~8月,SD的时间约1.5~17月;6月的总存活率(OS)为72%。
以上结果表明,Nivolumab治疗晚期肝癌是安全有效的,具有可管控的不良反应,且能带来持续的缓解效应。虽然这些结果局限在小部分患者中,但是相信更多的Nivolumab临床研究将为晚期肝癌患者的治疗提供强有力的证据。另外一项抗PD-1单克隆抗体Pidilizumab(CT-011)的Ⅰ期临床试验(NCT00966251)由于进行过程中未观察到明显临床获益而提前终止。此外,为进一步评估二者治疗肝癌的安全、耐受性和药物疗效,正在进行TGF-β受体激酶阻断剂Galunisertib (LY2157299)联合Nivolumab治疗晚期肝癌的Ⅰ/Ⅱ期临床试验(NCT02423343)。
2 PD-L1阻断剂PD-1的配体PD-L1(也称B7-H1),广泛表达于活化的T细胞、B细胞、巨噬细胞、树突状细胞和上皮细胞等[8, 10]。高强等[13]研究发现,肿瘤内PD-L1的表达可作为肝癌患者无病生存期的独立预后因素;肿瘤内PD-L1高表达往往提示患者预后不良。不仅如此,其他恶性肿瘤包括实体瘤和非实体瘤都有PD-L1表达升高的研究结果,而且均与不良预后密切相关[14]。利用PD-L1阻断剂阻断PD-1/PD-L1通路,进而恢复T细胞的抗肿瘤作用,成为肝癌免疫治疗新的研究热点。基于上述考虑,目前正在进行PD-L1阻断剂(MEDI4736)单独或联合Tremelimumab治疗肝癌的早期临床试验(NCT02519348),结果值得期待。
3 CTLA-4阻断剂CTLA-4(又称CD152)是CD28家族成员,主要表达于活化的T细胞表面,其胞内段包含一个免疫受体酪氨酸阻断基序(immunoreceptor tyrosine-based inhibitory motif,ITIM),当其与配体B7-1/B7-2结合后可使T细胞活性受到抑制[15],进而导致肿瘤细胞发生免疫逃逸。而CTLA-4阻断剂可以抑制CTLA-4与B7-1/B7-2结合,促进B7与刺激性受体CD28结合,恢复T细胞的活性,进而提高机体的抗肿瘤能力。目前CTLA-4阻断剂主要有Ipilimumab和Tremelimumab两种。2011年3月美国FDA批准Ipilimumab用于治疗黑色素瘤,而针对CTLA-4分子靶向治疗,目前仅有Tremelimumab进行了肝癌相关的临床试验。
Tremelimumab是人源化IgG2单克隆抗体,能有效阻滞CTLA-4。Sangro等[16]进行了Tremelimumab(CP-675,206)治疗肝癌的非对照、多中心的Ⅱ期临床试验(NCT01008358)。试验入组了21例合并有丙型肝炎的晚期肝癌患者,这些患者都已不能承受手术或局部治疗方式;其中Child-Pugh分级为A、B的分别有12例和9例。患者每90天接受一次剂量为15 mg/kg的Tremelimumab单药治疗。结果显示部分缓解率为17.6%,疾病控制率为76.4%,中位总生存时间8.2月。尽管治疗期间有45%的患者出现了3级以上转氨酶升高的不良反应,但这一现象仅发生在初次接受Tremelimumab治疗的患者。值得一提的是,在接受Tremelimumab治疗后,试验组中大多数患者的病毒负载量明显降低,其中3例患者甚至降至接近正常水平。
这一试验结果提示Tremelimumab具有抗肿瘤和抗病毒的双重效应,因此认为该药或许对合并有病毒性肝炎(乙肝或丙肝)的肝癌患者更能受益。另外一项Tremelimumab联合局部治疗(经动脉化疗栓塞或射频消融)治疗肝癌的Ⅰ期临床试验[17]正在进行,其目的主要是评估Tremelimumab联合动脉化疗栓塞或射频消融治疗晚期肝癌患者的安全性和有效性。
4 其他免疫检查点阻断剂目前研究较多的免疫检查点还包括T细胞免疫球蛋白-3(T-cell immunoglobulin and mucin-domain-containing molecule 3,Tim-3)和淋巴细胞活化基因-3分子(lymphocyte activation gene-3,LAG-3)。Tim-3是Tim家族的主要成员之一,主要表达于CD8+T、Th1、Th17和巨噬细胞等[18]。Tim-3通过与其配体凝集素-9(galectin-9)结合对T细胞的凋亡和免疫耐受进行调节[19]。另外,LAG-3为免疫球蛋白超家族成员,主要分布于活化的T淋巴细胞、B细胞、NK细胞和树突状细胞等[20]。与Tim-3类似,LAG-3也是一种免疫负调节分子,能够负性调控T细胞的活化与增殖[9]。通过Tim-3阻断剂或LAG-3阻断剂恢复T细胞的活性和增殖能力,进而阻断肿瘤细胞生长,为肿瘤免疫提供可能的治疗途径,这一方向已经成为最近的研究热点。虽然在亚临床分析中已经表明Tim-3和LAG-3阻断剂具有抗肿瘤活性[21-22],但是目前二者与肝癌相关的临床试验均没有报道。相信随着研究的深入,Tim-3阻断剂和LAG-3阻断剂会逐步走向肝癌临床试验。
5 结语肿瘤免疫治疗因其卓越的疗效和创新性,在2013年被《科学》杂志评为年度科学突破之首。如今免疫治疗已成为继手术、化疗、放疗之后被公认的具有抗肿瘤作用的一种新治疗方法。然而,肝脏作为人体特殊的代谢器官,因其在生理和病理情况下均存在着复杂的免疫耐受机制[23],当前免疫治疗多作为肝癌的辅助治疗或姑息性治疗。相信随着免疫检查点阻断剂单独或联合化疗、放疗、肝癌疫苗、细胞因子以及过继性免疫细胞等多种治疗方法研究的不断深入,检查点阻断剂有望成为肝癌免疫治疗的重要突破,这也必将会让更多肝癌患者受益。
| [1] | Ferlay J, Shin H, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127 (12) : 2893–917. DOI:10.1002/ijc.v127:12 |
| [2] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64 (1) : 9–29. DOI:10.3322/caac.21208 |
| [3] | Ulahannan SV, Duffy AG, Mcneel TS, et al. Earlier presentation and application of curative treatments in hepatocellular carcinoma[J]. Hepatology, 2014, 60 (5) : 1637–44. DOI:10.1002/hep.v60.5 |
| [4] | Palmer DH. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359 (23) : 2498–9. |
| [5] | Sharma P, Allison JP. The future of immune checkpoint therapy[J]. Science, 2015, 348 (6230) : 56–61. DOI:10.1126/science.aaa8172 |
| [6] | Kline J, Bishop MR. Update on checkpoint blockade therapy for lymphoma[J]. J Immunother Cancer, 2015, 3 : 33. DOI:10.1186/s40425-015-0079-8 |
| [7] | Ai B. The Treatment of Malignant Tumor by Immune Checkpoint Inhibitors[J]. Yi Xue Yu Zhe Xue, 2015, 36 (4) : 18–21. [ 艾斌. 免疫检查点抑制剂在肿瘤治疗中的应用[J]. 医学与哲学, 2015, 36 (4) : 18–21. ] |
| [8] | Yang WT, Yu YH. The application of PD-1 and its ligand in solid tumors[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2015, 7 : 791–3. [ 杨文婷, 余英豪. PD-1及其配体在实体肿瘤中的应用[J]. 临床与实验病理学杂志, 2015, 7 : 791–3. ] |
| [9] | Marcq E, Pauwels P, van Meerbeeck JP, et al. Targeting immune checkpoints: New opportunity for mesothelioma treatment?[J]. Cancer Treat Rev, 2015, 41 (10) : 914–24. DOI:10.1016/j.ctrv.2015.09.006 |
| [10] | Shi F, Shi M, Zeng Z, et al. PD-1 and PD-L1 upregulation promotes CD8(+) T-cell apoptosis and postoperative recurrence in hepatocellular carcinoma patients[J]. Int J Cancer, 2011, 128 (4) : 887–96. DOI:10.1002/ijc.25397 |
| [11] | Topalian SL, Drake CG, Pardoll DM. Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity[J]. Curr Opin Immunol, 2012, 24 (2) : 207–12. DOI:10.1016/j.coi.2011.12.009 |
| [12] | El-Khoueiry AB, Melero I, Crocenzi TS, et al. PhaseⅠ/Ⅱ safety and antitumor activity of nivolumab in patients with advanced hepatocellular carcinoma (HCC): CA209-040[J]. J Clin Oncol, 2015, 33S (15). |
| [13] | Gao Q, Wang XY, Qiu SJ, et al. Overexpression of PD-L1 Significantly Associates with Tumor Aggressiveness and Postoperative Recurrence in Human Hepatocellular Carcinoma[J]. Clin Cancer Res, 2009, 15 (3) : 971–9. DOI:10.1158/1078-0432.CCR-08-1608 |
| [14] | Afreen S, Dermime S. The immunoinhibitory B7-H1 molecule as a potential target in cancer: Killing many birds with one stone[J]. Hematol Oncol Stem Cell Ther, 2014, 7 (1) : 1–17. DOI:10.1016/j.hemonc.2013.09.005 |
| [15] | Vogel IT. CD28/CTLA-4/B7 and CD40/CD40L costimulation and activation of regulatory T cells[J]. World J Immunology, 2014, 4 (2) : 63. DOI:10.5411/wji.v4.i2.63 |
| [16] | Sangro B, Gomez-Martin C, de la Mata M, et al. A clinical trial of CTLA-4 blockade with tremelimumab in patients with hepatocellular carcinoma and chronic hepatitis C[J]. J Hepatol, 2013, 59 (1) : 81–8. DOI:10.1016/j.jhep.2013.02.022 |
| [17] | Duffy AG, Makarova-Rusher OV, Kerkar SP, et al. A pilot study of tremelimumab-amonoclonal antibody against CTLA-4-in combination with either trans-arterial catheter chemoembolization (TACE) or radiofrequency ablation (RFA) in subjects with hepatocellular carcinoma (HCC)[J]. J Clin Oncol, 2014 (Suppl; abstr e15133). |
| [18] | Ngiow SF, Teng MW, Smyth MJ. Prospects for TIM3-Targeted Antitumor Immunotherapy[J]. Cancer Res, 2011, 71 (21) : 6567–71. DOI:10.1158/0008-5472.CAN-11-1487 |
| [19] | Rodriguez-Manzanet R, Dekruyff R, Kuchroo VK, et al. The costimulatory role of TIM molecules[J]. Immunol Rev, 2009, 229 (1) : 259–70. DOI:10.1111/imr.2009.229.issue-1 |
| [20] | Topalian SL, Drake CG, Pardoll DM. Immune Checkpoint Blockade: A Common Denominator Approach to Cancer Therapy[J]. Cancer Cell, 2015, 27 (4) : 450–61. DOI:10.1016/j.ccell.2015.03.001 |
| [21] | Li F, Zhang Y, Jin GX, et al. Expression of LAG-3 is coincident with the impaired effector function of HBV-specific CD8+ T cell in HCC patients[J]. Immunol Lett, 2013, 150 (1-2) : 116–22. DOI:10.1016/j.imlet.2012.12.004 |
| [22] | Li H, Wu K, Tao K, et al. Tim-3/galectin-9 signaling pathway mediates T-cell dysfunction and predicts poor prognosis in patients with hepatitis B virus-associated hepatocellular carcinoma[J]. Hepatology, 2012, 56 (4) : 1342–51. DOI:10.1002/hep.v56.4 |
| [23] | Makarova-Rusher OV, Medina-Echeverz J, Duffy AG, et al. The yin and yang of evasion and immune activation in HCC[J]. J Hepatol, 2015, 62 (6) : 1420–9. DOI:10.1016/j.jhep.2015.02.038 |
 2016, Vol. 43
2016, Vol. 43


