文章信息
- 乳腺癌干细胞的调控及作用
- Regulations and Roles of Breast Cancer Stem Cells
- 肿瘤防治研究, 2016, 43(9): 801-805
- Cancer Research on Prevention and Treatment, 2016, 43(9): 801-805
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.09.015
- 收稿日期: 2015-12-02
- 修回日期: 2016-03-30
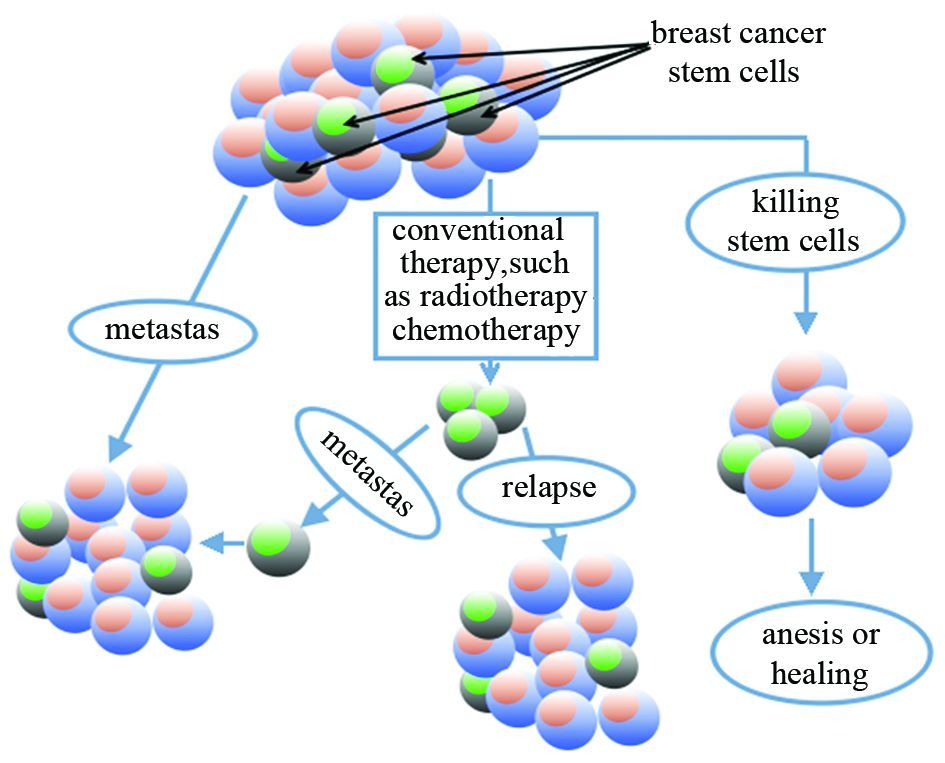
癌症是由于人体内一些细胞发生突变,使体内免疫系统的监控失效,致使自身不受控制地生长,同时能够破坏正常组织与器官的疾病。乳腺癌(breast cancer,BC)是发生在乳腺上皮组织的恶性肿瘤,是女性最常见的恶性肿瘤之一,也是威胁女性健康和生命的主要疾病之一。乳腺癌细胞中含有一群具有自我更新和多向分化能力的细胞亚群——乳腺癌干细胞,它与肿瘤的形成、转移和复发等过程有着密切的联系,被认为是肿瘤复发的来源,同时它还能够抵抗放射疗法而且对化学疗法的过程不敏感,见图 1,因此,对乳腺癌干细胞进行有效调控对寻找有效的乳腺癌治疗方法有着重要意义。
|
| 图 1 乳腺癌干细胞的靶向治疗 Figure 1 Targeted therapy of breast cancer stem cells |
肿瘤干细胞假说认为,肿瘤干细胞是一种可以发展成恶性子细胞并作为诱发癌症的细胞群体,起源于未发生癌变的肿瘤细胞。目前,乳腺癌干细胞的起源主要存在两种不同的理论。一种理论认为乳腺癌干细胞来源于正常干细胞的自我更新和分化,证据来自于乳腺癌干细胞和正常干细胞是高度相似的,都具有高度敏感度易导致肿瘤的突变和转移。Al-Hajj实验证明了该理论[1]。上皮间充质转化(epithelial-mesenchymal transition,EMT)是指在特定的生理、病理条件下,具有极性的上皮细胞丧失极性、黏附性,并向在细胞基质间自由移动的间质细胞转化的现象。由于癌细胞常表现出上皮标志物的下调和细胞间连接的缺失,从而导致细胞极性缺失、细胞间黏附降低、运动能力增强,而经EMT过程的细胞更容易转移,且许多特征和行为与肿瘤干细胞相似[2],所以另一种理论认为乳腺癌干细胞来源于体细胞上皮-间质转化。研究发现,从人乳腺组织分离出的具有CD44+/CD24−/low表型的细胞与经EMT过程的细胞所表达的基因具有相关性,经EMT过程的细胞形成乳腺微球的能力明显增强[3]。此外,调控EMT的转录因子Snail、Twistor诱发EMT过程可使上皮细胞转变为间质细胞状态,同时细胞表型变为干细胞CD44+/CD24−表型。这些研究结果均表明乳腺癌干细胞可能是在EMT过程中,由已分化的正常乳腺上皮细胞产生。
肿瘤干细胞表面标志物是寻找和鉴定特异性肿瘤干细胞的基础,并在肿瘤组织中识别肿瘤干细胞,进行相关信号机制调控的过程中发挥重要作用。近年来,随着对乳腺癌干细胞研究的不断深入,其表面标志物最初公认是CD44+/CD24−表型;此外,乙醛脱氢酶(aldehyde dehydrogenase,ALDH)也可能是乳腺癌干细胞的标志之一,与CD44+/CD24−细胞类似,500个ALDH+的乳腺癌干细胞就能在NOD/SCID小鼠体内形成肿瘤;利用干细胞能够排除荧光染料的特性产生的名为“侧群细胞(side population cell,SP)”也是一种特殊的干细胞表型,经分选出来的细胞在悬浮培养的条件下可以形成微球体,表现出干细胞的特性。目前,利用分子表面标志物的差异分离乳腺癌干细胞大大推进了对乳腺癌的研究进展,但是,乳腺癌干细胞表面标志物的研究中仍存在一些问题,如:已知的标志物之外是否存在其他更为特异性的标志,这些干细胞表型在乳腺癌发生发展过程中能否丢失或获得等,这一系列问题值得我们进一步探究。
2 乳腺癌干细胞的调控 2.1 micro-RNA对乳腺癌干细胞的调控micro-RNA(miRNA)是一组非编码蛋白质的短序列RNA。研究发现,人乳腺癌细胞染色体脆弱位点的miRNA表达可发生改变,表明miRNA与乳腺癌发生有着密切联系[4]。miRNA能够调控相关蛋白表达和信号通路,从而影响乳腺癌的侵袭转移过程。过去几年的研宄中鉴定出了许多可以调控乳腺癌转移的miRNA,例如miR-10b、miR-335、miR-373、miR-520和miR-31。最近研究的主要有miR-33b、miR-34a、miR let-7等。
miR-33家族是一个从果绳到人都非常保守的miRNA家族。人miR-33家族包括miR-33a和miR-33b。miR-33b位于17号染色体上SREBP-1基因的第17个内含子中;miR-33a位于22号染色体上SREBP-2基因的第16个内含子中。miR-33b在乳腺癌患者的肿瘤组织中表达水平很低。研究发现,在乳腺癌细胞系中,miR-33b的表达水平与乳腺癌细胞旳侵袭转移能力呈负相关。miR-33b主要通过直接调节下游3个IE基因HMGA2、SALL4和Twist1的3’UTR来调节乳腺癌的干性与侵袭转移,miR-33b可以抑制乳腺癌肿瘤干细胞的乳腺微球形成能力与干性[5]。
miR-34家族包括miR-34a、miR-34b和miR-34c。miR-34a的编码基因位于1p36.2,在多种肿瘤组织中低表达。过表达 miR-34a可使细胞凋亡、细胞周期停滞并衰老。研究发现过表达miR-34a可抑制肿瘤干细胞的增殖、侵袭转移[6]。采用miR-34a抑制剂抑制miR-34a的作用可促进肿瘤干细胞增殖、侵袭转移。miR-34a可通过下调SIRT1而抑制乳腺癌干细胞的自我更新,其机制可能与Nanog蛋白表达下调有关。
研究显示miRNA let-7的表达下调与乳腺癌干细胞的分化潜能及自我更新能力成负相关,下调miRNA let-7的乳腺癌干细胞获得较强的致瘤性及转移能力[7]。Lin28是RNA结合蛋白,Lin28通过调节let-7的表达调控乳腺癌肿瘤干细胞的功能[8]。此外,miRNA-100也被证实与乳腺癌干细胞转移机制密切相关,下调miRNA-100,乳腺癌干细胞数量增加并提高体外乳腺癌细胞的增殖能力。低表达的miRNA-100可以提高乙醛脱氢酶1(acetaldehyde dehydrogenase 1,ALDH1)表达,并且降低乳腺癌患者的存活率[9]。因此,miRNA与肿瘤干细胞转移关系及相关机制的研究对寻找肿瘤治疗新途径有重要意义[10-11]。
2.2 药物对乳腺癌干细胞的调控随着人们对乳腺癌干细胞研究的逐渐深入,越来越多能够调控乳腺癌干细胞增殖和转移的药物被发现。钱钧强等[12]研究发现多烯紫杉醇可在一定程度上抑制乳腺癌干细胞的生长,其抑制乳腺癌干细胞生长的机制可能是:多烯紫杉醇能加快微管蛋白聚合成微管的速度并延缓微管的解聚作用,使细胞被阻抑于细胞周期的G2和M期,使得干细胞有丝分裂和细胞增殖被抑制。此外,多烯紫杉醇还可诱导乳腺癌干细胞早期凋亡,从而影响乳腺癌干细胞的增殖、黏附以及转移能力。
5-杂氮-2’-脱氧胞苷(5-aza-2’-deoxycytidine,DAC)是胞苷类似物,有抑制DNA甲基化的作用,由于DAC对DNA甲基化的抑制作用,又把DAC称为表观遗传抗癌药。有研究发现低浓度DAC通过抑制肿瘤干细胞自我更新抑制初级细胞球形成,高浓度DAC通过抑制肿瘤干细胞自我更新及诱导肿瘤干细胞凋亡抑制初级细胞球形成[13]。DAC可以下调乳腺癌初级细胞球Nanog mRNA和蛋白质的表达,表明DAC可以下调乳腺癌干细胞Nanog的表达,因此,肿瘤干细胞Nanog可能是治疗乳腺癌的一个新靶标。
盐霉素是一种一元羧酸聚醚类动物专用抗生素,具有一定的杀菌作用。尹宏达等[14]将BT-20乳腺癌细胞置于含有不同浓度盐霉素的培养液中培养48 h,通过MTT法测量不同浓度的盐霉素对乳腺癌细胞的抑制作用,并利用流式细胞仪分别对实验组和对照组细胞中ALDH1阳性的表达率进行检测,对比检测结果发现盐霉素可以降低乳腺癌细胞中干细胞的比例,对乳腺癌干细胞有一定的抑制作用。
2.3 趋化因子及受体对乳腺癌干细胞的调控趋化因子CXCL12又称基质细胞衍生因子-1(SDF-1),是小分子细胞因子,属于趋化因子蛋白家族。SDF-1与血管内皮生长因子(vascular endothelial growth factor,VEGF)和低氧诱导因子(hypoxia-inducible factor,HIF)同属于促血管新生因子家族。趋化因子受体4(CXCR4)是由352个氨基酸残基构成的视紫红质样G蛋白偶联受体。研究发现,乳腺癌干细胞在SDF-1/CXCR4作用下,通过缺氧-HIF-CXCR4途径可以激活HIF,从而提高CXCR4 mRNA表达及蛋白表达,加速肿瘤转移[15-16]。同时,现已成功研究出SDF-1/CXCR4有助于增强结肠癌和胰腺癌干细胞转移能力[17-18]。
此外,脂肪干细胞分化的间充质干细胞可通过HGF/c-Met信号通路增强乳腺癌干细胞的迁移和自我更新[19],在三阴性乳腺癌异种移植模型中,脂肪干细胞分化的间充质干细胞同样可以促进肿瘤的迁移和转移[20]。同时,研究者在所有晚期结肠癌细胞和具有转移能力的细胞内,发现了肿瘤干细胞标志物CD26的高表达,这为进一步研究肿瘤转移机制提供了新思路[17]。
2.4 信号转导通路对乳腺癌干细胞的调控乳腺癌干细胞增殖、分化的信号转导通路Notch、Wnt/β-catenin、Hedgehog是多种类型乳腺癌的发病基础。
Notch受体家族包括四位成员:Notch1、Notch2、Notch3和Notch4,Notch信号通路中又包括5个配体:Jagged1、Jagged2和Delta-like1(DLL1)、DLL4和DLL4。Notch家族的跨膜信号蛋白参与细胞形成和发展,并且在干细胞和早期祖细胞中都有表达。体外实验研究证实,Notch4能够抑制乳腺上皮细胞的分化。Notch信号通路的一个配体能够使“乳腺干细胞微球体”的形成能力增加十倍,能够使部分细胞的多向分化能力增加百倍,这些实验证明了Notch信号通路可以促进乳腺癌干细胞自我更新和分化,并且干预Notch4信号或许可以实现肿瘤干细胞与正常干细胞之间的转化。
Wnt信号通路所涉及的成员包括:Wnt蛋白、Frizzled、cadherin、β-catenin、GSK-3、Dsh、APC、Axin、LEF/TCF、Ub等,其中β-catenin是Wnt信号通路下游的靶点,在乳腺上皮干细胞中活性极强。在小鼠乳腺中,Wnt过表达可以增加乳腺癌的形成。有研究发现,在人乳腺上皮细胞中Wnt1的过度表达能够激活Notch信号通路的一系列相关因子,而阻断和抑制Notch信号通路相关配体的表达也能够抑制Wnt1介导的乳腺上皮细胞转化,由此可以推断,Wnt信号通路很可能是与Notch信号通路协同发挥作用,影响乳腺癌干细胞的自我更新、增殖和分化。
Hedgehog信号通路受体家族主要包括:Patch、Smoothened,以及三个配体:Ihh、Dhh和Shh。Patch参与早期胚胎肿瘤的发生。大量的乳腺癌患者中检测到了Shh、Patch1和Gli1蛋白的过度表达,此外,抑制Gli1蛋白的表达能够抑制乳腺癌干细胞的增殖能力[21],这表明Hedgehog信号通路同样在乳腺癌干细胞的形成与发展中发挥重要作用。
3 乳腺癌干细胞的作用 3.1 促进肿瘤血管新生肿瘤血管由内皮细胞和周皮细胞组成[22]。肿瘤血管新生是指通过内皮细胞激活及血管内皮下基底膜降解,由内皮细胞增殖及向肿瘤组织迁移并形成细胞条索及管腔结构的过程。在这个过程中促血管生成因子和抑制血管生成因子扮演了重要角色,当促血管生成因子表达高于抑制血管生成因子时,肿瘤血管便开始形成。Bussolati等[23]研究发现,乳腺癌干细胞能表达干细胞标志物(如巢蛋白和Oct-4)和内皮细胞标志物,当在培养液中加入血清后,乳腺癌干细胞可分化为上皮细胞,而加入血管内皮生长因子则可向内皮细胞分化,并在基质胶中形成微血管结构,随后将乳腺微球移植到SCID/NOD小鼠中形成了人源化瘤内血管及血管网络。亦有研究发现,通过在体内用连续荧光受体追踪胶质瘤干细胞发现其可以产生大量的周皮细胞,而选择性地消除这些胶质瘤干细胞则抑制血管新生和肿瘤生长[24]。这为进一步探究乳腺癌干细胞促进肿瘤血管新生提供了新的思路和方法。
3.2 参与乳腺癌转移肿瘤转移具有一定的靶器官特异性和亲和性,宿主的器官微环境和转移瘤细胞间的相互作用决定了肿瘤能否转移。EMT过程是乳腺癌侵袭和转移的关键步骤。首先,乳腺癌细胞接受间质信号启动EMT程序,提高了细胞的运动性和侵袭性,得以淋巴结转移。乳腺癌细胞经EMT转化后,上皮性标志物如上皮钙黏着蛋白(E-cadherin)、β-联蛋白(β-catenin)等表达降低,间质性标志物如波形蛋白(Vimentin)、纤连蛋白(Fibronectin)等表达增高,导致细胞间的黏附能力减弱、乳腺癌细胞运动能力增强[25],使乳腺癌细胞容易发生转移。宋尔卫等利用炎性反应因子抗体芯片筛查发现,发生EMT的乳腺癌干细胞参与乳腺癌转移[26]。CD44+/CD24−乳腺癌干细胞是具有转移特性肿瘤转移干细胞(migrating cancer stem cell,MCSC),Blick等发现人乳腺具有EMT特点的癌细胞系与表达CD44+/CD24−乳腺癌干细胞呈正相关。因此,可通过检测EMT过程来诊断肿瘤的侵袭和转移[27]。
4 结语乳腺癌干细胞对传统化疗和放疗具有抵抗作用,易引起体内肿瘤复发和转移,由于难以控制病情发生和发展而无法起到治疗效果。Wnt、Notch和Hedgehog等信号通路是与乳腺癌干细胞有着密切联系,针对调控乳腺癌干细胞信号通路的疗法也逐渐受到人们的重视。环巴胺能够通过抑制Hedgehog信号通路抑制成神经管细胞瘤,其在其他肿瘤中也有应用[15]。Notch信号能够促进干细胞的自我更新和增殖,并增加体外微球体的形成。γ-分泌酶是是Notch信号通路中重要的物质。GSI是Notch信号通路的受体,针对其中的一种受体GSI1的治疗可以降低γ-分泌酶活性并抑制Notch信号的形成进而抑制干细胞的增殖[28-30]。此外,Wnt信号通路的拮抗剂WIF1-Fc和SFRP1-Fc能够通过抑制Wnt信号活性,促进肿瘤细胞凋亡,抑制内皮祖细胞分化,抑制内皮祖细胞功能和肿瘤血管生成的方式抑制肿瘤的生长。建立靶向乳腺癌干细胞的免疫细胞疗法是一种新的恶性肿瘤生物疗法,但目前仍不成熟,还待进一步研究。基于乳腺癌干细胞理论研究的治疗策略虽然不会立刻让乳腺癌患者从中获益,但这些知识是癌症拼图中的重要部分,有助于为提高诊断准确性提供新的思路,有助于日后开发出更有效的乳腺癌治疗方法。因此,要彻底击溃乳腺癌,应进一步增加对乳腺癌干细胞致病机制、调控机制和信号转导机制等方面的研究,了解乳腺癌的发生、发展和调控位点。
| [1] | Al-Hajj M, Wicha MS, Benito-Hernandez A, et al. Prospective identification of tumorigenic breast cancer cells[J]. Proc Natl Acad Sci U S A, 2003, 100 (7) : 3983–8. DOI:10.1073/pnas.0530291100 |
| [2] | Morel AP, Lievre M, Thomas C, et al. Generation of breast cancer stem cells through epithelial-mesenchymal transition[J]. PLoS One, 2008, 3 (8) : e2888. DOI:10.1371/journal.pone.0002888 |
| [3] | Mani SA, Guo W, Liao MJ, et al. The epithelial–mesenchymal transition generates cells with properties of stem cells[J]. Cell, 2008, 133 (4) : 704–15. DOI:10.1016/j.cell.2008.03.027 |
| [4] | Li L, Xiao B, Tong H, et al. Regulation of breast cancer tumorigenesis and metastasis by miRNAs[J]. Expert Rev Proteomics, 2012, 9 (6) : 615–25. DOI:10.1586/epr.12.64 |
| [5] | Sun M, Gomes S, Chen P, et al. RKIP and HMGA2 regulate breast tumor survival and metastasis through lysyl oxidase and syndecan-2[J]. Oncogene, 2014, 33 (27) : 3528–37. DOI:10.1038/onc.2013.328 |
| [6] | Fan P, Fan S, Wang H, et al. Genistein decreases the breast cancer stem-like cell population through Hedgehog pathway[J]. Stem Cell Res Ther, 2013, 4 (6) : 146. DOI:10.1186/scrt357 |
| [7] | Sun X, Qin S, Fan C, et al. Let-7: a regulator of the ERα signaling pathway in human breast tumors and breast cancer stem cells[J]. Oncol Rep, 2013, 29 (5) : 2079–87. |
| [8] | Yang X, Lin X, Zhong X, et al. Double-negative feedback loop between reprogramming factor LIN28 and microRNA let-7 regulates aldehyde dehydrogenase 1-positive cancer stem cells[J]. Cancer Res, 2010, 70 (22) : 9463–72. DOI:10.1158/0008-5472.CAN-10-2388 |
| [9] | Deng L, Shang L, Bai S, et al. MicroRNA100 inhibits self-renewal of breast cancer stem-like cells and breast tumor development[J]. Cancer Res, 2014, 74 (22) : 6648–60. DOI:10.1158/0008-5472.CAN-13-3710 |
| [10] | Tang W, Yu F, Yao H, et al. miR-27a regulates endothelial differentiation of breast cancer stem like cells[J]. Oncogene, 2014, 33 (20) : 2629–38. DOI:10.1038/onc.2013.214 |
| [11] | Lee JK, Park SR, Jung YK, et al. Exosomes derived from mesenchymal stem cells suppress angiogenesis by down-regulating VEGF expression in breast cancer cells[J]. PLoS One, 2013, 8 (12) : e84256. DOI:10.1371/journal.pone.0084256 |
| [12] | Qian JQ, Zhang XP, Ma Y, et al. Effects of Docetaxel on Human Breast Cancer Stem Cells[J]. Zhongguo Quan Ke Yi Xue, 2011, 14 (24) : 2749–54. [ 钱钧强, 张霄蓓, 马懿, 等. 多西紫杉醇对乳腺癌干细胞的作用研究[J]. 中国全科医学, 2011, 14 (24) : 2749–54. ] |
| [13] | Xiong JB, Zhao JJ, Peng L, et al. BRCAl inhibits progesterone-induced proliferation and migration of breast cancer cells[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2012, 32 (8) : 1105–10. [ 熊静波, 赵嘉佳, 彭黎, 等. BRCAI抑制黄体酮刺激乳腺癌细胞增殖和迁移[J]. 南方医科大学学报, 2012, 32 (8) : 1105–10. ] |
| [14] | Yin HD, Xie ZB. Effect of salinomycin on breast cancer stem cells[J]. Shi Jie Zui Xin Yi Xue Xin Xi Wen Zhai(Lian Xu Xing Dian Zi Qi Kan, 2015, 15 (26) : 142–3. [ 尹宏达, 谢振斌. 盐霉素对乳腺癌干细胞作用的研究[J]. 世界最新医学信息文摘(连续型电子期刊), 2015, 15 (26) : 142–3. ] |
| [15] | Nigam A. Breast cancer stem cells, pathways and therapeutic perspectives 2011[J]. Indian J Surg, 2013, 75 (3) : 170–80. DOI:10.1007/s12262-012-0616-3 |
| [16] | Kokovay E, Goderie S, Wang Y, et al. Adult SVZ lineage cells home to and leave the vascular niche via differential responses to SDF1/CXCR4 signaling[J]. Cell Stem Cell, 2010, 7 (2) : 163–73. DOI:10.1016/j.stem.2010.05.019 |
| [17] | Pang R, Law WL, Chu AC, et al. A subpopulation of CD26+ cancer stem cells with metastatic capacity in human colorectal cancer[J]. Cell Stem Cell, 2010, 6 (6) : 603–15. DOI:10.1016/j.stem.2010.04.001 |
| [18] | Moriyama T, Ohuchida K, Mizumoto K. Enhanced cell migration and invasion of CD133+ Pancreatic cancer cells cocultured with pancreatic stromal cells[J]. Cancer, 2010, 116 (14) : 3357–68. DOI:10.1002/cncr.25121 |
| [19] | Eterno V, Zambelli A, Pavesi L, et al. Adipose-derived mesenchymal stem cells (ASCs) may favour breast cancer recurrence via HGF/c-Met signaling[J]. Oncotarget, 2014, 5 (3) : 613–33. DOI:10.18632/oncotarget |
| [20] | Rowan BG, Gimble JM, Sheng M, et al. Human adipose tissue-derived stromal/stem cells promote migration and early metastasis of triple negative breast cancer xenografts[J]. PLoS One, 2014, 9 (2) : e89595. DOI:10.1371/journal.pone.0089595 |
| [21] | Tanaka H, Nakamura M, Kameda C, et al. The Hedgehog signaling pathway plays an essential role in maintaining the CD44+CD24?/low subpopulation and the side population of breast cancer cells[J]. Anticancer Res, 2009, 29 (6) : 2147–57. |
| [22] | Carmeliet P, Jain RK. Principles and mechanisms of vessel normalization for cancer and other angiogenic diseases[J]. Nat Rev Drug Discov, 2011, 10 (6) : 417–27. DOI:10.1038/nrd3455 |
| [23] | Bussolati B, Grange C, Sapino A, et al. Endothelial cell differentiation of human breast tumour stem/progenitor cells[J]. Cell Mol Med, 2009, 13 (2) : 309–19. DOI:10.1111/j.1582-4934.2008.00338.x |
| [24] | Cheng L, Huang Z, Zhou W, et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth[J]. Cell, 2013, 153 (1) : 139–52. DOI:10.1016/j.cell.2013.02.021 |
| [25] | Geiger TR, Peeper DS. Metastasis mechanisms[J]. Biochimicaet Biophysica Acta, 2009, 1796 (2) : 293–308. |
| [26] | Su S, Liu Q, Chen J, et al. A positive feedback loop between mesenchymal-like cancer and macrophages is essential to breast cancer metastasis[J]. Cancer Cell, 2014, 25 (5) : 605–20. DOI:10.1016/j.ccr.2014.03.021 |
| [27] | Blick T, Hugo H, Widodo E, et al. Epithelial mesenchymal transition traits in human breast cancer cell lines parallel the CD44(hi/) CD24(lo/-) stem cell phenotype in human breast cancer[J]. J Mammary Gland Biol Neoplasia, 2010, 15 (2) : 235–52. DOI:10.1007/s10911-010-9175-z |
| [28] | Zhou W, Wang G, Guo S. Regulation of angiogenesis via Notch signaling in breast cancer and cancer stem cells[J]. Biochim Biophys Acta, 2013, 1863 (2) : 304–20. |
| [29] | Pece S, Confalonieri SR, Romano P, et al. NUMB-ing down cancer by more than just a NOTCH[J]. Biochim Biophys Acta, 2011, 1815 (1) : 26–43. |
| [30] | Chinchar E, Makey KL, Gibson J, et al. Sunitinib significantly suppresses the proliferation, migration, apoptosis resistance, tumor angiogenesis and growth of triple-negative breast cancers but increases breast cancer stem cells[J]. Vasc Cell, 2014, 6 : 12. DOI:10.1186/2045-824X-6-12 |
 2016, Vol. 43
2016, Vol. 43
