文章信息
- 乳腺伴间叶分化的化生性癌28例临床分析
- Metaplastic Carcinoma of Breast with Mesenchymal Differentiation: 28 Cases Report
- 肿瘤防治研究, 2016, 43(8): 690-693
- Cancer Research on Prevention and Treatment, 2016, 43(8): 690-693
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.08.008
- 收稿日期: 2015-11-02
- 修回日期: 2016-02-22
2012年WHO乳腺肿瘤组织学分类将乳腺化生性癌分为:(1)低级别腺鳞癌;(2)纤维瘤病样化生性癌;(3)鳞状细胞癌;(4)梭形细胞癌;(5)伴间叶分化的化生性癌:①软骨样分化;②骨样分化;③伴间叶分化的其他类型;(6)混合性化生性癌;(7)肌上皮癌。本研究收集了28例乳腺伴间叶分化的化生性癌患者临床病理资料,对其临床病理特征及预后进行初步探讨以提高对本病的认识。
1 资料与方法 1.1 临床资料收集天津医科大学肿瘤医院2003年至2013年收治的乳腺伴间叶分化的化生性癌患者28例。标本经两位病理科医生双盲法重新复习病理切片,按照2012年WHO乳腺和女性生殖系统肿瘤病理学和遗传学分类标准,所有患者均确诊为乳腺伴间叶分化的化生性癌。按照美国癌症联合委员会乳腺癌TNM分期第六版标准对其进行分期。
1.2 随访情况所有患者通过电话和门诊进行随访,随访截至2015年6月1日,随访内容包括患者生存状况,术后接受辅助治疗的情况,肿瘤有无复发、转移。无失访病例。
1.3 统计学方法应用SPSS17.0软件进行统计学分析。Kaplan-Meier法计算生存率并绘制生存曲线。
2 结果 2.1 临床病理特征本组28例患者均为女性,年龄30~89岁,中位年龄为53.5岁。全组患者均以无痛性乳腺肿物就诊,其中肿块伴溢液1例,伴乳头派杰氏病2例。肿瘤位于左乳22例,右乳6例。肿瘤最大直径为5.5 cm,平均最大直径为3.3 cm。自发现肿物至就诊时间为3天~1年。有恶性肿瘤家族史5例,其中有乳腺癌家族史2例,该2例中1例患者6年前曾患输卵管癌。绝经前8例,绝经后20例。24例术前接受乳腺超声检查的患者中,考虑为乳腺癌20例,考虑为良性病变4例。20例术前行乳腺钼钯检查的患者中,考虑为乳腺癌14例,考虑为良性6例。本组患者术前行空芯针活检8例,4例诊断为浸润性癌,1例诊断为叶状囊肉瘤,1例诊断为良性病变,2例不能明确诊断。24例行术中快速冰冻病理检查的患者中,其中诊断为浸润性癌16例,2例诊断为恶性叶状肿瘤,2例诊断为恶性肿瘤,1例诊断为叶状囊肉瘤,1例诊断为导管内癌,不排除浸润,2例不能明确诊断。术后石蜡病理示:乳腺癌肉瘤18例,乳腺产基质的癌6例,乳腺伴软骨化生的癌4例。免疫组织化学示:ER和(或)PR阳性患者3例,Her-2阳性患者1例; Ki-67高表达(Ki-67≥14.0%)27例,P53阳性表达18例,见表 1。行腋窝淋巴结清扫的26例患者中存在淋巴结转移3例。
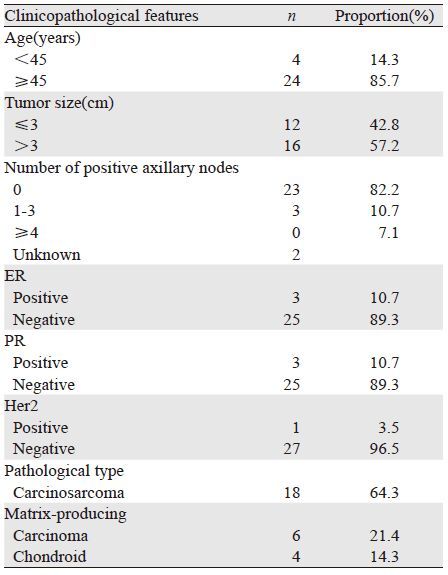
|
28例患者均接受手术治疗,其中乳腺癌根治术3例,乳腺癌改良根治术23例,肿瘤区段切除术2例。全组除1例行肿瘤区段切除术后患者放弃进一步治疗,其余27例患者术后均接受辅助化疗(化疗方案以紫杉类、蒽环类和铂类等为主),其中4例患者化疗完成后继续行同侧胸壁及锁骨上野放疗(照射处方剂量为50 Gy,分25次),3例激素受体阳性患者化疗后接受阿那曲唑或依西美坦内分泌治疗。
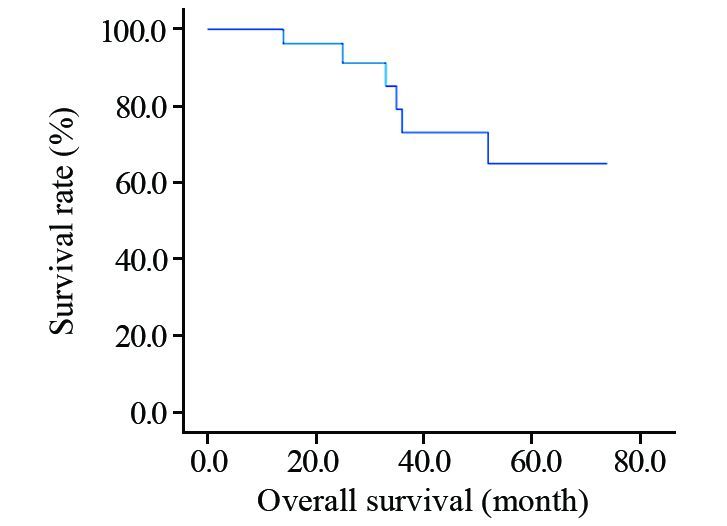
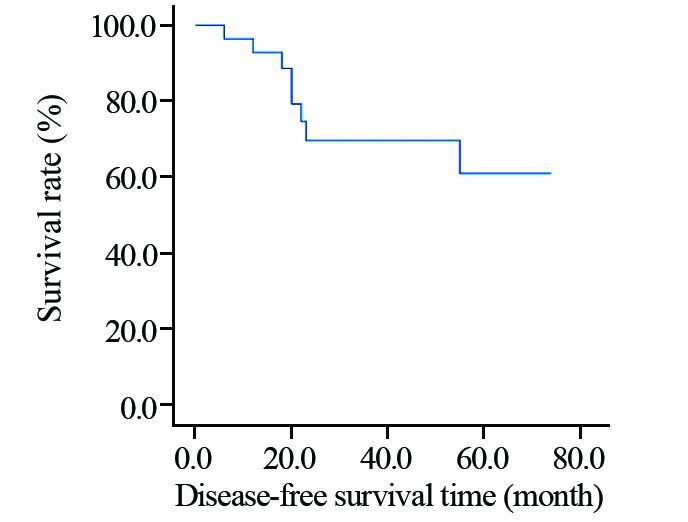
2.3 预后情况本组共28例患者均获得随访,随访时间为12~74月,中位随访时间为40月。28例患者5年生存率和5年无病生存率分别为64.9%和61%,见图 1、2。8例出现复发或远处转移,部位多见于肺(4/8),其他为脑、肝、骨、胸壁。其中6例发生转移者于8~30月死亡,其余2例为带瘤生存。
|
| 图 1 28例乳腺伴间叶分化的化生性癌患者总生存曲线 Figure 1 Overall survival curves of 28 metaplastic carcinoma of breast with mesenchymal differentiation patients |
|
| 图 2 28例乳腺伴间叶分化的化生性癌患者无病生存曲线 Figure 2 Disease-free survival curves of 28 metaplastic carcinoma of breast with mesenchymal differentiation patients |
乳腺化生性癌是以腺癌成分伴有明显的梭形细胞分化、鳞化和(或)间叶分化的一组异质性癌,仅占同期乳腺癌病例的1%不到[1-2]。据肿瘤形态将乳腺化生性癌分为2种类型:纯上皮型及上皮/间叶组织混合型[3]。和非特殊类型浸润性导管癌相比,乳腺伴间叶分化的化生性癌的临床特点及预后有其独自的特点:肿瘤体积更大、组织学分级高、激素受体阳性率低、淋巴结转移率低[4]。
本研究结果显示,乳腺伴间叶分化的化生性癌可发生在各年龄阶段的女性(30~89岁),中位发病年龄为53.5岁,绝经后多见。有研究[5]显示,乳腺化生性癌以中老年女性多见,本研究与文献报道一致。乳腺伴间叶分化的化生性癌临床特征与其他类型乳腺癌无明显差异,多数患者以无痛性肿块为主要原因就诊,本组病例中个别患者伴有乳头溢液及派杰氏病。本组病例肿瘤平均最大直径为3.3 cm,与文献[6]报道乳腺化生性癌一般肿物体积较大一致。
乳腺伴间叶分化的化生性癌临床与影像学表现无特殊性,且术前空芯针活检多不能发现化生性成分,因此术前诊断往往较困难。其确诊主要依靠术后病理及免疫组织化学检査[4]。本组病例中,接受空芯针活检和术中冰冻病理检查的患者确诊率较低,所以我们认为在乳腺伴间叶分化的化生性癌中,空芯针活检和术中冰冻病理检查对判断肿瘤的性质有一定的价值,而对其确诊仍需根据术后石蜡病理和免疫组织化学结果。
本组28例患者中,ER、PR和Her-2的阳性率分别为10.7%、10.7%和3%,激素受体阳性率明显低于我国乳腺癌的表达率[7],与国内外研究[8-9]相符。激素受体阳性率低可部分解释其恶性程度高的原因。激素受体阴性的乳腺癌具有更高的复发和转移率,乳腺伴间叶分化的化生性癌雌、孕激素受体常常表现为阴性,所以大多数人不适合内分泌治疗,但对激素受体阳性的患者进行内分泌治疗是必要的。本组行腋窝淋巴结清扫的26例患者中存在淋巴结转移3例,与国外研究[10-11]乳腺化生性癌淋巴结转移率低一致。
据NCCN乳腺伴间叶分化的化生性癌的治疗遵循非特殊类型浸润性乳腺癌综合治疗的原则,治疗以手术为主,术后辅以化疗和放疗等综合治疗。但由于化生性癌患者发现时肿块往往较大,因此其保乳手术率较非特殊类型浸润性乳腺癌相对要低,但对于适合保乳的患者可选择保乳治疗。国外研究[12]发现乳腺化生性癌根治术和保乳术总生存率和无病生存率无差别。乳腺伴间叶分化的化生性癌患者对术后辅助化疗敏感度较低,一个大样本回顾性研究显示和非特殊类型浸润性导管癌相比化生性癌患者在术后辅助化疗中获益较少[13]。但由于激素受体状态多阴性和Her-2阳性率较低,患者常接受术后辅助化疗。术后放疗后有无生存获益尚不明确。Tseng等[11]回顾分析1 051例乳腺化生性癌,38.6%患者接受术后放疗,多因素分析显示放疗可提高总生存率。
目前普遍认为乳腺化生性癌的预后较差。尽管淋巴结转移率低,但较容易发生远处转移。杨迎旭等[14]分析94例癌肉瘤患者5年总生存率率为65.5%,低于同期一般乳腺癌。文献报道[15]产生基质的化生性癌和非特殊类型导管癌相比,更容易局部复发和远处转移,无病生存期更短,而伴软骨样分化病例报道较少。本组8例患者出现复发或转移,其中肺转移4例,5年生存率和5年无病生存率分别为64.9%和61%,显示乳腺伴间叶分化的化生性癌侵袭性较非特殊类型浸润性乳腺癌要强。
本研究是单中心、回顾性研究,病例数较少,未进行单因素和多因素生存分析,未比较伴有不同间质成分的乳腺化生性癌之间预后或病理特点有何不同。需要进一步累积样本来明确其临床病理特征及预后。
总之,乳腺伴间叶分化的化生性癌是一种罕见的恶性肿瘤,其发病率低,临床特征缺乏特异性,确诊应依靠术后石蜡病理及免疫组织化学结果。激素受体阳性率低,侵袭性强,术后应密切随访。
| [1] | Luini A, Aguilar M, Gatti G, et al. Metaplastic carcinoma of the breast, an unusual disease with worse prognosis: the experience of the European Institute of Oncology and review of the literature[J]. Breast Cancer Res Treat, 2007, 101 (3) : 349–53. DOI:10.1007/s10549-006-9301-1 |
| [2] | McKinnon E, Xiao P. Metaplastic carcinoma of the breast[J]. Arch Pathol Lab Med, 2015, 139 (6) : 819–22. DOI:10.5858/arpa.2013-0358-RS |
| [3] | Gao LX, Ding HY. An overview of the characteristics of the new WHO breast invasive carcinoma[J]. Zhonghua Bing Li Xue Za Zhi, 2004, 33 (4) : 84–6. [ 皋岚湘, 丁华野. 新版WHO乳腺浸润性癌组织学类型的特点概述[J]. 中华病理学杂志, 2004, 33 (4) : 84–6. ] |
| [4] | Dunne B, Lee AH, Pinder SE, et al. An immunohistochemical study of metaplastic spindle cell carcinoma, phyllodes tumor and fibromatosis of the breast[J]. Hum Pathol, 2003, 34 (10) : 1009–15. DOI:10.1053/S0046-8177(03)00414-3 |
| [5] | Al Sayed AD, El Weshi AN, Tulbah AM, et al. Metaplastic carcinoma of the breast clinical presentation, treatment results and prognostic factors[J]. Acta Oncol, 2006, 45 (2) : 188–95. DOI:10.1080/02841860500513235 |
| [6] | Yamaguchi R, Horii R, Maeda I, et al. Clinicopathologic study of 53 metaplastic breast carcinomas: their elements and prognostic implications[J]. Hum Pathol, 2010, 41 (5) : 679–85. DOI:10.1016/j.humpath.2009.10.009 |
| [7] | Gao JD, Wang J, Feng XL, et al. Characterization of hormone receptor status in 5758 Chinese females with breast cancer[J]. Zhonghua Zhong Liu Za Zhi, 2009, 31 (9) : 683–6. [ 高纪东, 王靖, 冯晓丽, 等. 5758例女性乳腺癌激素受体状态及其相关因素分析[J]. 中华肿瘤杂志, 2009, 31 (9) : 683–6. ] |
| [8] | Song Y, Liu X, Zhang G, et al. Unique clinicopathological features of metaplastic breast carcinoma compared with invasive ductal carcinoma and poor prognostic indicators[J]. World J Surg Oncol, 2013, 11 : 129. DOI:10.1186/1477-7819-11-129 |
| [9] | Schwartz TL, Mogal H, Papageorgiou C, et al. Metaplastic breast cancer: histologic characteristics, prognostic factors and systemic treatment strategies[J]. Exp Hematol Oncol, 2013, 2 (1) : 31. DOI:10.1186/2162-3619-2-31 |
| [10] | Lester TR, Hunt KK, Nayeemuddin KM, et al. Metaplastic sarcomatoid carcinoma of the breast appears more aggressive than other triple receptor-negative breast cancers[J]. Breast Cancer Res Treat, 2012, 131 (1) : 41–8. DOI:10.1007/s10549-011-1393-6 |
| [11] | Tseng WH, Martinez SR. Metaplastic breast cancer: to radiate or not to radiate?[J]. Ann Surg Oncol, 2011, 18 (1) : 94–103. DOI:10.1245/s10434-010-1198-6 |
| [12] | Dave G, Cosmatos H, Do T, et al. Metaplastic carcinoma of the breast: a retrospective review[J]. Int J Radiat Oncol Biol Phys, 2006, 64 (3) : 771–5. DOI:10.1016/j.ijrobp.2005.08.024 |
| [13] | Pezzi C M, Patel-Parekh L, Cole K, et al. Characteristics and treatment of metaplastic breast cancer: analysis of 892 cases from the National Cancer Data Base[J]. Ann Surg Oncol, 2007, 14 (1) : 166–73. |
| [14] | Yang YX, Zhang LP, Guo GC. Analysis of clinicopathological features and prognosis of 94 patients with breast carcinosarcoma[J]. Zhong Liu, 2013, 33 (1) : 63–9. [ 杨迎旭, 张连平, 郭广成. 乳腺癌肉瘤患者94例临床病理特征和预后分析[J]. 肿瘤, 2013, 33 (1) : 63–9. ] |
| [15] | Zhang Z, Bu H, Huang H, et al. Matrix-producing metaplastic carcinoma: a clinicopathologic and prognostic analysis of 16 cases with review of literature[J]. Zhonghua Bing Li Xue Za Zhi, 2014, 43 (8) : 528–32. |
 2016, Vol. 43
2016, Vol. 43


