文章信息
- 不同乳腺组织中肿瘤相关巨噬细胞与CXCL12表达的相关性
- Correlation Between Tumor Associated Macrophages and CXCL12 Expression in Different Breast Tissues
- 肿瘤防治研究, 2016, 43(8): 685-689
- Cancer Research on Prevention and Treatment, 2016, 43(8): 685-689
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.08.007
- 收稿日期: 2015-11-23
- 修回日期: 2016-05-05
2. 442008 十堰,湖北医药学院附属东风医院病理科
2. Department of Pathology,Dongfeng Hospital,Hubei University of Medicine,Shiyan 442008,China
乳腺癌是女性恶性肿瘤死亡的主要原因,仅在2012年全球就有大约170万新发病例并有52万人死亡[1]。我国的乳腺癌发病率有逐年上升趋势。肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)可通过分泌多种刺激肿瘤细胞增殖和存活的细胞因子、增强蛋白水解酶的活性、促进血管淋巴管的生成、帮助癌细胞逃避机体免疫系统等途径,促进乳腺癌的发生发展[2]。趋化因子12(CXC chemokine ligand 12,CXCL12)具有趋化白细胞浸润、促进肿瘤细胞增殖及迁移、调节肿瘤血管生长、激活抗肿瘤免疫应答等生物学作用,与乳腺癌的发生发展也有密切关系。但乳腺癌CXCL12的表达与乳腺癌微环境中TAMs的关系鲜见文献报道。本实验用免疫组织化学法检测乳腺癌转移灶、乳腺癌原发灶、非典型导管增生及乳腺腺病组织中TAMs浸润情况与CXCL12的表达,分析TAMs、CXCL12与乳腺癌临床病理特征的关系,旨在探讨TAMs与CXCL12在乳腺癌的发生发展过程中的作用及其相关性。
1 资料与方法 1.1 标本与临床资料收集湖北医药学院附属东风医院病理科2000年1月—2006年12月病理资料完整的乳腺癌手术标本127例,所有病例均由两位副主任医师复核确认,术前乳腺癌患者均未行放、化疗。所选乳腺癌患者全部为女性,年龄29~70岁,中位年龄50岁,≤50岁59例、>50岁68例;乳腺癌病理学分型及组织学分级参照乳腺肿瘤WHO分类(2012版) 进行:非特殊型浸润性癌89例、浸润性小叶癌26例、其他类型浸润性乳腺癌12例(髓样癌5例、黏液癌5例、小管癌2例);组织学分级Ⅰ级18例、Ⅱ级83例、Ⅲ级26例;淋巴结转移58例,远处转移17例。同时收集同期乳腺非典型导管增生手术标本100例、乳腺腺病手术标本40例。
收集湖北医药学院附属东风医院病理科2000年1月—2010年12月乳腺癌转移灶手术标本71例,均为女性患者,年龄34~75岁,中位年龄48岁。其中59例为术后转移,12例为未手术已转移。术后发生转移的时间为9~67月,中位转移时间17月。转移部位手术标本以肺最多见(26/71,36.6%)、其次为颈部等体表淋巴结(19/71,26.8%)、肝(15/71,21.1%)、骨(9/71,12.7%)、脑(2/71,2.8%);同时有2个部位转移的病例6例(肺+体表淋巴结2例、肺+肝2例、肺+骨1例、骨+体表淋巴结1例)。
1.2 主要试剂兔抗人多克隆抗体CXCL12购自武汉博士德生物工程公司,鼠抗人单克隆抗体CD68(克隆号:KP1)、即用型快捷免疫组织化学MaxVision检测试剂盒、DAB显色剂及其他辅助试剂均购自福州迈新生物技术公司。
1.3 免疫组织化学染色方法所有标本均经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,免疫组织化学染色方法参照MaxVision检测试剂盒说明书进行,CXCL12稀释比例1:150,CD68稀释比例1:150,抗原修复方法为柠檬酸钠缓冲液高压修复(180℃ 3 min),滴加一抗后4℃孵育过夜,滴加二抗室温下孵育40 min,DAB显色室温下20 min,苏木精对比染色,常规封片。磷酸盐缓冲液(PBS)代替一抗作阴性对照。
1.4 免疫组织化学染色结果评估方法 1.4.1 TAMs免疫组织化学评估方法TAMs以CD68标记,CD68染色以细胞质内出现棕黄色颗粒为阳性;具体计数方法:由两个高年资临床病理医生采取双盲法分别阅片,低倍镜下(×40)查找CD68染色阳性细胞数最多的视野,再在高倍镜下(×200)计数5个视野中CD68阳性的细胞数量,然后取5个视野计数的平均值,两个病理医生的计数结果取平均数确定为该病例的最终计数结果;CD68免疫组织化学染色结果分类方法:取所有病例(338例)计数结果的中位数,以中位数为界把免疫组织化学染色结果分为两类,计数结果高于中位数者定义为高表达,低于中位数者定义为低表达。
1.4.2 CXCL12免疫组织化学评估方法结果评判由两个高年资临床病理医生采取双盲法分别阅片,按照目标细胞阳性率及染色强度综合评价免疫组织化学染色半定量结果。CXCL12染色以细胞质或(和)细胞核内出现棕黄色颗粒为阳性;随机选择目标细胞丰富的区域在高倍镜下(×200)评估5个高倍镜视野中细胞阳性率和染色强度。细胞阳性率分为5个等级:0(<5%),1(5%~25%),2(≥25%~50%),3(≥50%~75%),4(≥75%)。染色强度分为4个等级:0(阴性,无着色),1(弱阳性),2(中等阳性),3(强阳性)。然后将细胞阳性率分级与染色强度分级相乘的得分作为最终的染色得分,最终得分分为4个等级:-(0分),+(1~4分),++(5~8分),+++(9~12分)。最后把所有病例的免疫组织化学染色结果分为两类:低表达(包括-和+),高表达(包括++和+++)。两个病理医生对同一标本评分不一致的病例,则再次阅片讨论确定。
1.5 统计学方法实验数据应用SPSS19.0统计软件进行分析,各组间率的比较采用Pearson χ2检验,TAMs与CXCL12之间的相关性分析采用非参数Spearman等级相关分析法,P<0.05为差异有统计学意义。
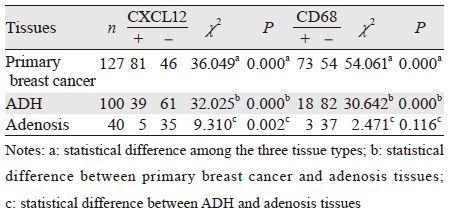
2 结果 2.1 乳腺癌转移灶、乳腺癌原发灶、非典型导管增生及乳腺腺病组织中CD68的表达免疫组织化学染色显示,CD68阳性信号主要定位于细胞质,呈粗颗粒状,见图 1。所有样本TAMs计数结果的中位数为117.5/HPF,乳腺癌转移灶、乳腺癌原发灶全部病例均有数量不等的CD68阳性TAMs浸润,各组TAMs(或巨噬细胞)计数、高表达率及分布特点如下:乳腺癌转移灶组TAMs平均数为505.7/HPF,高表达率80.3%,在转移癌间质内呈弥漫性分布;乳腺癌原发灶组平均数为234.4/HPF,高表达率57.5%,在癌巢间质内及癌周呈局灶性分布;非典型导管增生组平均数为60.2/HPF,高表达率18%,在病变周围间质内局灶性分布;乳腺腺病组织平均数为5.1/HPF,高表达率7.5%,偶见于乳腺间质内。非典型导管增生与乳腺腺病组间差异无统计学意义(P=0.116),其他组间差异均有统计学意义(P<0.01),见表 1~2。
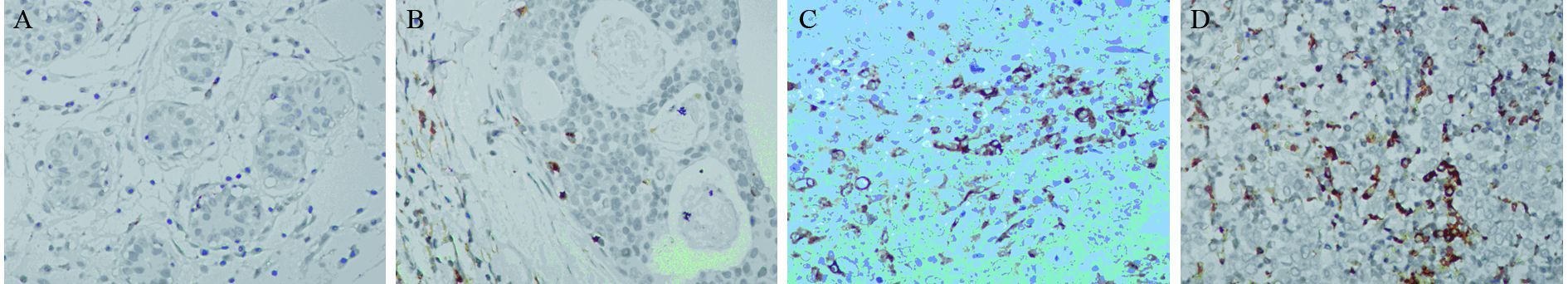
|
| A: adenosis tissues; B: atypical ductal hyperplasia(ADH) tissues; C: primary breast cancer tissues; D: metastatic breast cancer tissues 图 1 CD68在不同乳腺组织中的表达 (MaxVision×200) Figure 1 Expression of CD68 in different breast tissues (MaxVision ×200) |
|
乳腺癌转移灶与乳腺癌原发灶组间差异有统计学意义(P<0.05),乳腺癌转移灶与乳腺腺病组间差异有统计学意义(P<0.01),非典型导管增生与乳腺腺病组间差异无统计学意义(P=0.239),其他各组间差异均有统计学意义(P<0.01),见表 1~2及图 2。

|
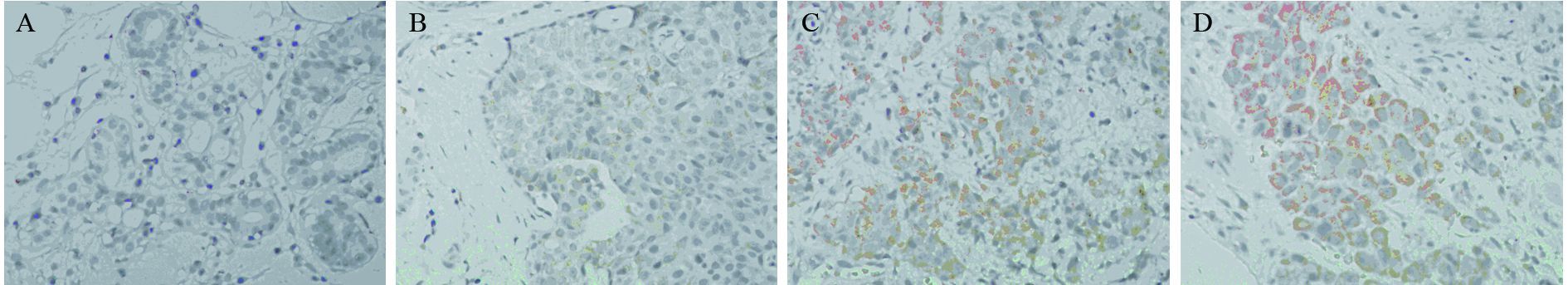
|
| A: adenosis tissues; B: ADH tissues; C: primary breast cancer tissues; D: metastatic breast cancer tissues 图 2 CXCL12在不同乳腺组织中的表达 (MaxVision ×200) Figure 2 Expression of CXCL12 in different breast tissues (MaxVision ×200) |
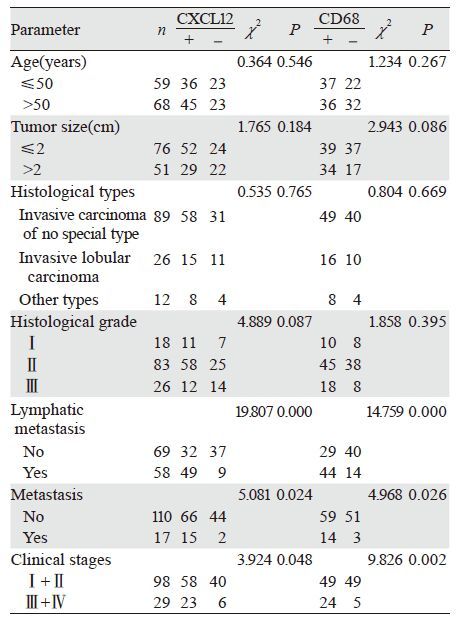
乳腺癌组织中TAMs浸润程度与淋巴结转移、远处转移及临床分期有关(P值分别为0.000,0.026,0.002),与患者年龄、肿瘤大小、组织学分型及组织学分级无关,见表 3。
2.4 CXCL12表达与乳腺癌临床病理特征的关系乳腺癌CXCL12的高表达与淋巴结转移、远处转移及临床分期有关(P值分别为0.000,0.024,0.048),与患者年龄、肿瘤大小、组织学分型及组织学分级无关,见表 3。
|
乳腺癌原发灶组TAMs浸润与CXCL12表达呈正相关(r=0.479,P=0.000),见表 4。乳腺癌转移灶组TAMs浸润与CXCL12表达呈正相关(r=0.524,P=0.000),见表 4。乳腺非典型导管增生组TAMs浸润与CXCL12表达呈正相关(r=0.319,P=0.001),见表 4。

|
肿瘤发生发展过程中始终伴随着炎性细胞的浸润,常见的有巨噬细胞、淋巴细胞、树突状细胞、NK细胞等,其中以巨噬细胞最为常见,可达到肿瘤相关炎性细胞总数的50%以上[3]。TAMs是指浸润于肿瘤间质中的巨噬细胞,按照其受到活化方式和表面标志的不同可分为两类:M1型和M2型巨噬细胞,前者具有递呈肿瘤抗原和吞噬肿瘤细胞等细胞毒性效应,后者可诱导局部免疫耐受状态。研究表明肿瘤中浸润的巨噬细胞大多为“促肿瘤的M2型巨噬细胞”,具有IL-12low/IL-10high表型。TAMs在乳腺癌的发生发展过程中发挥着重要作用,与乳腺癌细胞存在共生关系并相互促进。乳腺癌细胞可产生单核细胞趋化蛋白-1(MCP-1)、集落刺激因子-1(CSF-1)和血管内皮生长因子(VEGF)等众多具有巨噬细胞趋化性的趋化因子,趋化血液循环中的单核细胞进入乳腺癌组织,在乳腺癌微环境的诱导下转化成为TAMs [4],TAMs的分布以肿瘤缺氧部位为主。
而TAMs则可通过分泌多种细胞因子促进乳腺癌的发生发展。Król等[5]研究显示犬乳腺癌组织中TAMs数量的增加与肿瘤转移有关,Chen等[6]的最新研究发现,乳腺癌TAMs可通过自分泌CCL18的作用而促进肿瘤侵袭转移,降低患者生存率。同时在肿瘤模型中清除TAMs可以观察到肿瘤的生长受到抑制[7]。本实验结果显示TAMs数量在人乳腺腺病、乳腺导管非典型增生、乳腺癌原发灶组织中逐渐升高,提示TAMs的浸润与乳腺癌的发生有关;乳腺癌转移灶与乳腺癌原发灶相比,TAMs数量显著增加,提示TAMs的浸润与乳腺癌的转移有关;而且TAMs的浸润与乳腺癌的淋巴结转移、远处转移及临床分期密切相关。
趋化因子12又名基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)是CXC趋化因子亚家族的成员之一,可表达于人体多种组织或细胞,来源于骨髓基质细胞和特定间皮细胞及上皮细胞的持续分泌[8]。CXCL12是G蛋白藕联受体超家族CXCR4的唯一配体,而CXCL12有CXCR4及CXCR7两种受体,二者形成的CXCL12/CXCR4生物轴,具有调节胚胎组织器官发育、调节造血干细胞迁移、趋化白细胞浸润、促进肿瘤细胞增殖及迁移、调节肿瘤血管生长、激活抗肿瘤免疫应答等生物学作用。早期研究即发现CXCL12及CXCR4在乳腺癌患者的表达水平高于常人,临床分期较晚的乳腺癌患者的表达水平高于分期较早的患者,而且CXCL12在淋巴结、骨、肺、肝、脑等乳腺癌转移高发部位明显高表达[8]。后期研究进一步证实CXCL12的高表达与乳腺癌患者淋巴结转移、远处转移、患者预后差呈正相关[9]。但也有研究结果显示CXCL12的高表达与乳腺癌远处转移呈负相关[10],与患者临床预后差呈负相关[11]。
本实验结果显示,CXCL12在人乳腺腺病、乳腺非典型导管增生、乳腺癌原发灶组织中表达率逐渐升高,各组间CXCL12的表达差异性显著,提示CXCL12与乳腺癌的发生有关,可能是乳腺发生癌变过程中的重要事件之一;乳腺癌转移灶与乳腺癌原发灶相比,CXCL12的表达增加,提示CXCL12与乳腺癌的转移有关;而且CXCL12的表达与乳腺癌患者的淋巴结转移、远处转移及临床分期密切相关。其原因可能在于CXCL12的受体CXCR4:研究发现乳腺癌细胞表达功能性CXCR4,其与CXCL12结合后可促进肿瘤细胞的运动和迁移;CXCR4活化后还能选择性地调节促凋亡蛋白Bmf和抗凋亡蛋白Bcl-xL的功能与活性,使乳腺癌细胞失巢凋亡的敏感度降低,阻止肿瘤细胞失巢凋亡,促进乳腺癌远处转移。
乳腺癌TAMs浸润数量及CXCL12的表达分别与患者淋巴结转移、远处转移、临床分期存在密切关系,与患者年龄、肿瘤大小、组织学分型、组织学分级无关,而且乳腺癌CXCL12的表达与TAMs浸润数量呈正相关,在乳腺癌转移灶中二者的表达也呈正相关,提示TAMs与CXCL12在乳腺癌的发生发展过程中存在协同作用。该协同作用的可能机制为,肿瘤的缺氧状态可通过提高前列腺素的浓度和TAMs对CXCL12的敏感度而促使TAMs浸润到肿瘤缺氧部位;同时TAMs通过自身分泌的多种细胞因子如VEGF、EGF、TGF-β等与CXCL12共同调节肿瘤细胞增殖、凋亡、上皮间质转化、免疫逃逸、血管生成、淋巴管生成等环节作用于肿瘤发生发展进程[12]。国内近期有研究[13]显示TAMs与CXCL12的受体CXCR4的表达与乳腺良恶性病变有关,而与乳腺癌患者淋巴结转移无关。该研究与本实验不同的结果说明TAMs与CXCL12/CXCR4生物轴在乳腺癌的发生过程中可能存在协同作用,但在乳腺癌进展过程中的作用尚存在不确定性。
因此,进一步探索TAMs与CXCL12在乳腺癌发生发展过程中的相互作用关系以及二者在细胞信号转导等环节相互协同的分子调控机制,将有助于临床更加准确地判断乳腺癌的生物学行为,将有助于为乳腺癌的靶向治疗策略提供新思路,从而达到提高疗效、改善预后的目的。
| [1] | Yi T, Zhai B, Yu Y, et al. Quantitative phosphoproteomic analysis reveals system-wide signaling pathways downstream of SDF-1/CXCR4 in breast cancer stem cells[J]. Proc Natl Acad U S A, 2014, 111 (21) : E2182–90. DOI:10.1073/pnas.1404943111 |
| [2] | Wynn TA, Chawla A, Pollard JW. Macrophage biology in development, homeostasis and disease[J]. Nature, 2013, 496 (7446) : 445–55. DOI:10.1038/nature12034 |
| [3] | Mantovani A. Cancer:Inflaming metastasis[J]. Nature, 2009, 457 (7225) : 36–7. |
| [4] | Kuang DM, Zhao Q, Peng C, et al. Activated monocytes in peritumoral stroma of hepatocellular carcinoma foster immune privilege and disease progression through PD-L1[J]. J Exp Med, 2009, 206 (6) : 1327–37. DOI:10.1084/jem.20082173 |
| [5] | Król M, Pawlowski KM, Majchrzak K, et al. Density of tumor-associated macrophages (TAMs) and expression of their growth factor receptor MCSF-R and CD14 in canine mammary adenocarcinomas of various grade of malignancy and metastasis[J]. Pol J Vet Sci, 2011, 14 (1) : 3–10. |
| [6] | Chen J, Yao Y, Gong C, et al. CCL18 from tumor-associated macrophages promotes breast cancer metastasis via PITPNM3[J]. Cancer Cell, 2011, 19 (4) : 541–55. DOI:10.1016/j.ccr.2011.02.006 |
| [7] | Cortez-Retamozo V, Etzrodt M, Newton A, et al. Origins of tumor-associated macrophages and neutrophils[J]. Proc Natl Acad Sci U S A, 2012, 109 (7) : 2491–6. DOI:10.1073/pnas.1113744109 |
| [8] | Müller A, Homey B, Soto H, et al. Involvement of chemokine receptors in breast cancer metastasis[J]. Nature, 2001, 410 (6824) : 50–6. DOI:10.1038/35065016 |
| [9] | Kong LY, Yu ZG, Xue M, et al. Analysis of SDF-1/CXCR4 expression and survival outcomes in breast cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2014, 21 (8) : 605–11. [ 孔令禹, 余之刚, 薛梅, 等. 乳腺癌组织SDF-1/CXCR4表达与预后相关性分析[J]. 中华肿瘤防治杂志, 2014, 21 (8) : 605–11. ] |
| [10] | Wendt MK, Cooper AN, Dwinell MB. Epigenetic silencing of CXCL12 increases the metastatic potential of mammary carcinoma cells[J]. Oncogene, 2008, 27 (10) : 1461–71. DOI:10.1038/sj.onc.1210751 |
| [11] | Kobayashi T, Tsuda H, Moriya T, et al. Expression pattern of stromal cell-derived factor-1 chemokine in invasive breastcancer is correlated with estrogen receptor status and patient prognosis[J]. Breast Cancer Res Treat, 2010, 123 (3) : 733–45. DOI:10.1007/s10549-009-0672-y |
| [12] | Cho HJ, Jung JI, Lim do Y, et al. Bone marrow-derived, alternatively activated macrophages enhance solid tumor growth and lung metastasis of mammary carcinoma cells in a Balb/C mouse orthotopic model[J]. Breast Cancer Res, 2012, 14 (3) : R81. DOI:10.1186/bcr3195 |
| [13] | Zhu JF, Wu ZS, Nie J, et al. Reletionship between tumor associated macrophages and the expression of CXCR4 and significance in breast cancer[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2014, 30 (5) : 478–82. [ 朱敬凤, 吴正升, 聂静, 等. 乳腺癌中肿瘤相关巨噬细胞与CXCR4表达的关系及意义[J]. 临床与实验病理学杂志, 2014, 30 (5) : 478–82. ] |
 2016, Vol. 43
2016, Vol. 43


