文章信息
- NRP-1过表达对乳腺癌细胞MDA-MB-231、SK-BR-3生物学行为的影响
- Effects of NRP-1 Overexpression on Biological Behaviors of Breast Cancer Cell Lines MDA-MB-231 and SK-BR-3
- 肿瘤防治研究, 2016, 43(8): 678-684
- Cancer Research on Prevention and Treatment, 2016, 43(8): 678-684
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.08.006
- 收稿日期: 2015-10-09
- 修回日期: 2015-12-10
2. 271000 泰安,泰山医学院附属医院肿瘤科;
3. 221000 徐州,徐州医科大学附属医院肿瘤科
2. Department of Oncology, Affiliated Hospital of Taishan Medical University, Taian 271000, China;
3. Department of Oncology, The Affiliated Hospital of Xuzhou Medical University, Xuzhou 221000, China
肿瘤血管生成在乳腺癌发展、浸润、转移中起着关键作用[1]。神经纤毛蛋白-1(neuropilin-1,NRP-1)是一个由923个氨基酸组成的非酪氨酸蛋白激酶[2]。NRP-1可作为VEGF(vascular endothelial growth factor)的受体,以独立或依赖VEGFR-2(vascular endothelial growth factor receptor 2)的方式参与新生血管的生成及肿瘤的发展及转移[3]。我们通过构建NRP-1过表达乳腺癌细胞模型,观察其对乳腺癌细胞增殖、凋亡、迁移及侵袭能力的影响。
1 材料与方法 1.1 材料乳腺癌MCF-7细胞株购自南京凯基生物公司,MDA-MB-231、SK-BR-3细胞株购自中国科学院上海细胞库,BT549、T47D、Bcap37细胞株、质粒pcDNA3.1由江苏省肿瘤生物治疗研究所保存,质粒pCR-blunt购自美国Invitrogen公司,Phusion聚合酶、限制性内切酶EcolⅠ、限制性内切酶HindⅢ购自美国NEB公司,DMEM、RPMI 1640干粉培养液、胎牛血清为美国Gibco公司产品,抗兔NRP-1多克隆抗体购自美国Cell Signalling Technology公司,抗β-actin鼠单克隆抗体、辣根过氧化酶标记山羊抗兔IgG、辣根过氧化酶标记马抗小鼠IgG购自北京中杉金桥公司,BCA蛋白浓度测定试剂盒购自南京碧云天生物试剂研究所,G418购自美国Sigma公司,CCK-8试剂盒购自日本同仁化学研究所,AnnexinV-APC/7-AAD试剂盒购自美国BD Biosciences公司,Transwell小室购自美国Corning公司,Matrigel胶购自美国BD Biosciences公司。
1.2 方法 1.2.1 细胞培养人乳腺癌细胞MCF-7、SK-BR-3及T47D培养在含有10%胎牛血清的DMEM培养液中,BT549、MDA-MB-231及Bcap37培养在含有10%胎牛血清的RPMI 1640培养液中,置于37℃、5%CO2及饱和湿度的培养箱内常规传代培养。
1.2.2 Western blot鉴定NRP-1在乳腺癌细胞株中的表达提取MCF-7、SK-BR-3、BT549、T47D、MDA-MB-231、Bcap37六种乳腺癌细胞的总蛋白,BCA法检测蛋白浓度。取相等总蛋白量进行SDS-PAGE电泳,分离后,转至NC膜。明胶室温封闭1 h,一抗4℃冰箱平放过夜,Washing buffer洗涤3次,二抗室温孵育1 h,Washing buffer洗涤3次,ddH2O清洗3 min,倒掉ddH2O,置入新鲜配制的显色液中显色。
1.2.3 pCR-blunt-NRP-1克隆载体的构建取NRP-1表达量较高的MCF-7乳腺癌细胞,TRIzol法提取总RNA,反转录得到含NRP-1基因信息的cDNA,以cDNA为模板用Phusion酶行PCR扩增目的片段,扩增条件为:98℃ 2 min预变性,98℃ 30 s,68℃ 30 s,72℃ 2 min,共35个循环,最后72℃延伸2 min。PCR产物进行琼脂糖凝胶电泳,回收即得到目的基因片段。将目的基因片段与pCR-blunt载体用T4DNA连接酶连接,连接产物转化感受态细胞,挑取单克隆菌落摇菌过夜,小量提取质粒经EcolⅠ单酶切鉴定正确后送上海英俊公司测序,测序正确后将质粒命名为pCR-blunt-NRP-1。
1.2.4 pcDNA3.1-NRP-1表达载体的构建与鉴定EcolⅠ单酶切重组质粒pCR-blunt-NRP-1和pcDNA3.1,反应产物用0.7%的琼脂糖凝胶电泳检测并观察目的条带。胶回收NRP-1基因片段和pcDNA3.1,T4DNA连接酶连接。连接产物转化感受态细胞DH-5α。第二天挑取数个单克隆菌落,摇菌过夜后小提质粒,Hind Ⅲ单酶切鉴定重组质粒,将鉴定正确的质粒命名为pcDNA3.1-NRP-1,菌液-80℃保存。
1.2.5 NRP-1过表达稳定表达系的筛选先筛选抗生素G418剂量,将MDA-MB-231、SK-BR-3细胞以8 000个/孔接种于24孔板,设定G418浓度梯度为100、200、300、400、500、600、700、800、900、1 000 μg/ml,每个浓度设3复孔。计算活细胞数并取3孔的平均值。以10~14天杀死全部细胞的最低浓度为筛选浓度。测得MDA-MB-231、SK-BR-3的筛选浓度分别为600、500 μg/ml。转染前24 h将MDA-MB-231、SK-BR-3细胞以4×l05个/孔的密度接种于6孔板,温箱中培养24 h后,按照Invitrogen公司LipofectamineTM 2 000的说明书介导NRP-1表达质粒与空质粒转染两种乳腺癌细胞,分别用600、500 μg/ml G418筛选出稳定转染的MDA-MB-231、SK-BR-3细胞株,并予以扩大培养。后续实验将每种细胞分为未进行转染的正常细胞即空白对照(blank control,BC),转染空质粒的阴性对照(negative control,NC)及转染NRP-1表达质粒的过表达(pcDNA3.1-NRP-1)3组,共计6组。
1.2.6 实时荧光定量RT-PCR分析NRP-1 mRNA表达情况TRIzol法提取总RNA,M-MLV反转录酶反转录合成cDNA。采用LightCycler 480 SYBR Green ⅠMaster荧光定量PCR试剂盒检测6组细胞NRP-1的mRNA表达情况。NRP-1及内参β-actin引物序列如下:NRP-1上游引物:5’-GGAAGCTCTGGGCATGGAAT-3’,下游引物:5’-AGGAATCCTCTCCGGGAGTC-3’;β-actin上游引物:5’-CATGTACGTTGCTATCCAGGC-3’,下游引物:5’-CTCCTTAATGTCACGCACGAT-3’。反应条件:95℃变性5 s,60℃退火,延伸40 s,循环40次。荧光定量PCR反应结束后,由电脑自动分析结果,计算Ct值。NRP-1相对表达量用2-ΔΔCt表示,其中ΔΔCt =[Ct目的基因的平均值(样本组)- Ct管家基因的平均值(样本组)]-[Ct目的基因的平均值(校正组)- Ct管家基因的平均值(校正组)]。
1.2.7 Western blot分析NRP-1蛋白质的表达情况收集6组细胞,具体处理方法如1.2.2。
1.2.8 CCK-8法检测NRP-1过表达对乳腺癌细胞增殖的影响取6组细胞以5 000个/孔密度接种于96孔板,每组设3个副孔,同时设空白对照孔(只加培养液),分别培养24、48、72和96 h后吸去培养液,每孔加入不含血清的培养液,再加入CCK-8试剂10 μl,继续培养2 h后,于酶标仪波长450 nm处测OD值。抑制率(%)=(1-OD实验组/OD对照组)×100% 。
1.2.9 AnnexinⅤ-APC/7-AAD法结合流式细胞仪检测细胞凋亡率分别取对数生长期的6组细胞,以4×105个/孔密度接种于6孔板中培养,使每孔总体积为2 ml,每孔设3个复孔,常规培养24 h。24 h后1 000 r/min离心5 min,收集细胞;用预冷的PBS洗涤细胞2次(1 000 r/min离心5 min),1×Binding buffer洗一次,收集细胞;加入100 μl 1×Binding buffer重悬细胞; 加入5 μl AnnexinV-APC,室温避光孵育15 min后;加入1 ml 1×Binding buffer离心,弃上清液后,于200 μl 1×Binding buffer重悬细胞,再加入5 μl 7-AAD混匀;1 h内用流式细胞仪检测。
1.2.10 Transwell细胞迁移实验及侵袭实验 1.2.10.1 Transwell细胞迁移实验取MDA-MB-231空白对照(blank control,BC),阴性对照(negative control,NC)及过表达(pcDNA3.1-NRP-1)3组细胞。常规洗涤、消化,离心,收集细胞制成单悬,用无血清的培养液调整细胞密度为1×106/ml,接种于Transwell小室的上室150 µl,下室为10% FBS的培养液600 µl,培养12 h后,用棉签擦去上室内的细胞,95%甲醇固定20 min,PBS洗三遍,结晶紫染色30 min,拍照,计数。
1.2.10.2 Transwell细胞侵袭实验Transwell小室预处理:外膜涂50 μl纤维粘连蛋白(fibronection,FN),用枪头摊平,风干后内膜平铺以1:3比例稀释的Matrigel稀释液30 μl,37℃过夜凝胶。收集细胞制成单细胞悬液,调整细胞密度为1.5×106/ml接种于Transwell小室的上室,其他步骤同迁移实验。
1.3 统计学方法采用SPSS16.0统计软件进行统计处理,计量资料以均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析检验,假设检验水准按α=0.05判定,P<0.05为差异有统计学意义。
2 结果 2.1 NRP-1在不同乳腺癌细胞株中的表达NRP-1在六种乳腺癌细胞中都有表达。MCF-7表达量较其他细胞高,MDA-MB-231、SK-BR-3、T47D表达量较低。后续实验我们从MCF-7细胞提取NRP-1的RNA,以MDA-MB-231、SK-BR-3两种乳腺癌细胞用于过表达相关研究,见图 1。
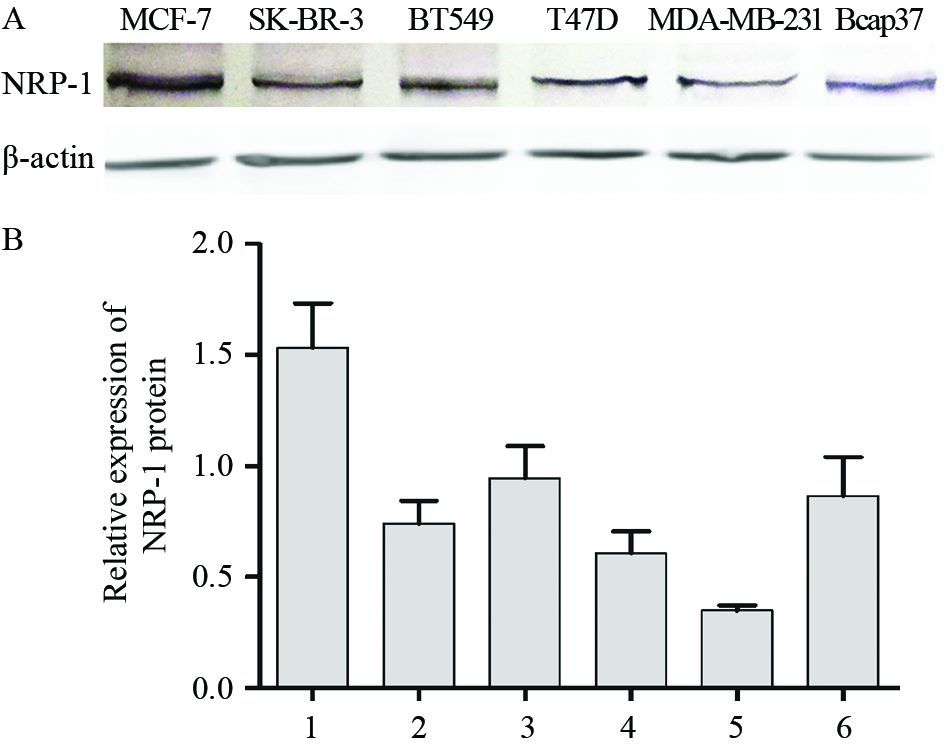
|
| 1: MCF-7; 2: SK-BR-3; 3: BT549; 4: T47D; 5: MDA-MB-231; 6: Bcap37 图 1 Western blot鉴定乳腺癌细胞株中NRP-1蛋白表达 Figure 1 Expression of NRP-1 protein in breast cancer cell lines detected by Western blot |
PCR产物经1.0%琼脂糖凝胶电泳,见一约1.8 kb的条带,与目的基因的大小相符,见图 2A。使用限制性内切酶EcolⅠ单酶切初步鉴定构建的重组质粒pCR-blunt-NRP-1,1.0%琼脂糖凝胶电泳可见大小约1.8 kb及3.5 kb两条清晰条带,与理论值相符,见图 2B。测序结果显示PCR产物与GeneBank公布的人NRP-1基因序列一致。
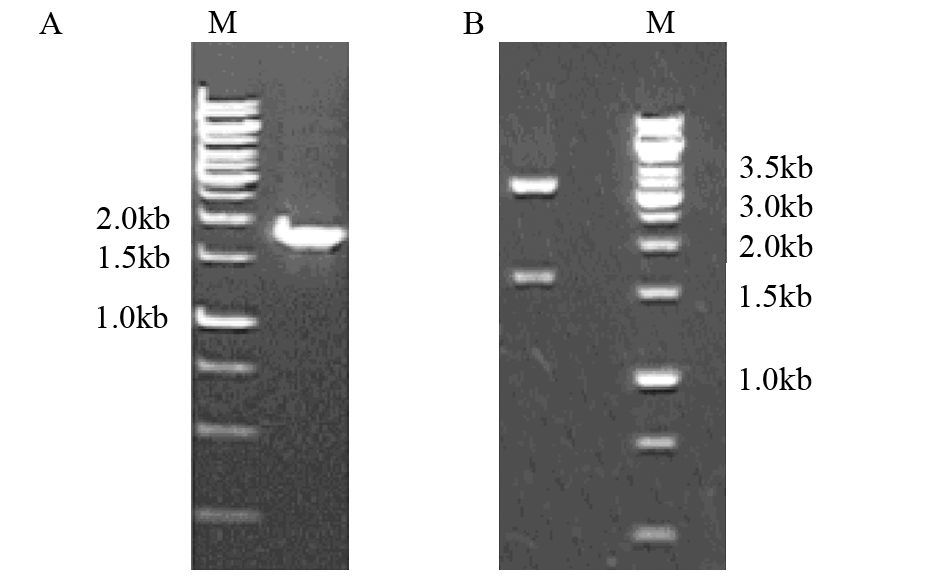
|
| A: amplified NRP-1; M: 1 kb DNA marker; B: recombinant plasmid; M: 1 kb DNA marker 图 2 NRP-1基因片段的扩增及pCR-blunt-NRP-1重组质粒的酶切 Figure 2 Fragment NRP-1 amplified by PCR and recombinant plasmid digested with restriction enzyme |
用T4DNA连接酶连接pcDNA3.1-NRP-1,Hind Ⅲ酶切鉴定,1.0%琼脂糖凝胶电泳可见大小约6 700 bp及600 bp的两条条带,与理论值相符,见图 3。
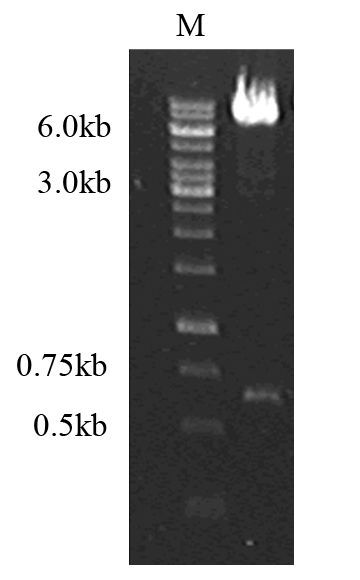
|
| M: 1 kb DNA marker 图 3 pcDNA3.1-NRP-1重组质粒的酶切 Figure 3 Recombinant plasmid pcDNA3.1-NRP-1 digested by Hind Ⅲ |
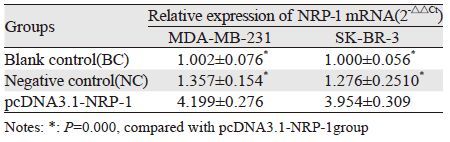
在MDA-MB-231细胞、SK-BR-3细胞,NRP-1在过表达组中的表达量较相应对照组细胞上调约4倍,和对照组比较,差异有统计学意义(P<0.05),见表 1。
|
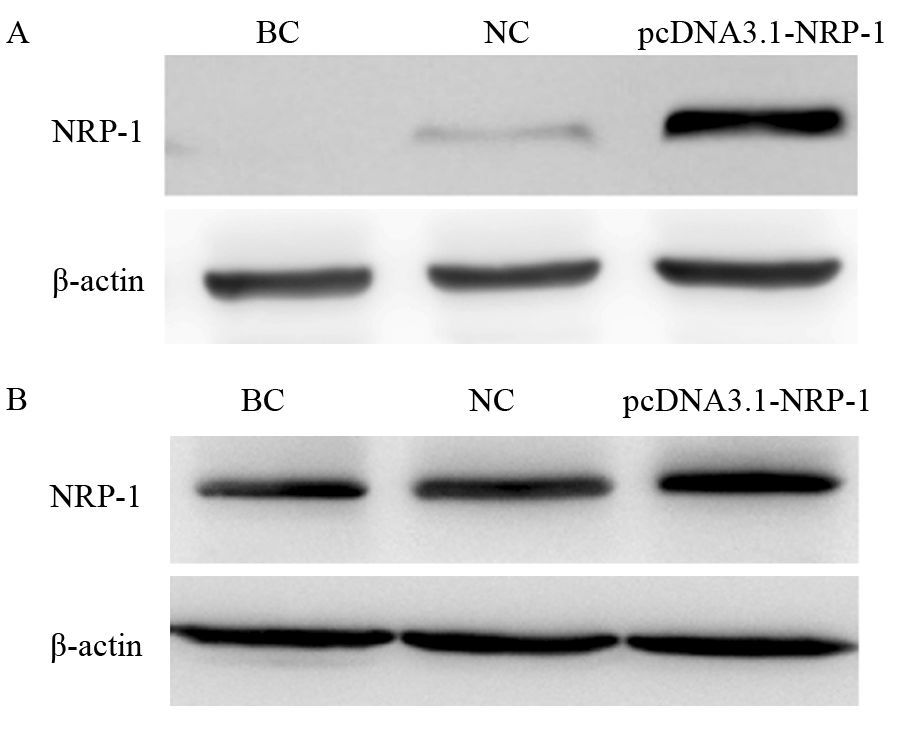
脂质体转染MDA-MB-231、SK-BR-3细胞后,与对照组比较,MDA-MB-231和SK-BR-3细胞过表达组(pcDNA3.1-NRP-1)中NRP-1蛋白的表达量分别升高了约13倍和2倍,与对照组比较差异有统计学意义(MDA-MB-231: pcDNA3.1-NRP-1组与BC、NC组比,P=0.002、P=0.005;SK-BR-3:pcDNA3.1-NRP-1组与BC、NC组比,P=0.003、P=0.029),见图 4。
|
| A: MDA-MB-231; B: SK-BR-3 图 4 过表达组pcDNA3.1-NRP-1中NRP-1蛋白的表达量 Figure 4 Expression of NRP-1 protein in pcDNA3.1-NRP-1 group |
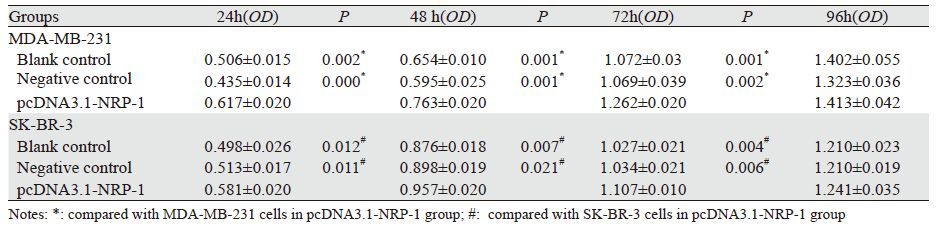
依据MDA-MB-231、SK-BR-3细胞空白组、阴性对照组、pcDNA3.1-NRP-1组在24、48、72和96 h的细胞增殖情况。两种细胞的pcDNA3.1-NRP-1组与对照组相比差异有统计学意义(P<0.05);而阴性对照(NC)与空白对照(BC)组相比差异无统计学意义(P<0.05),见表 2。
|
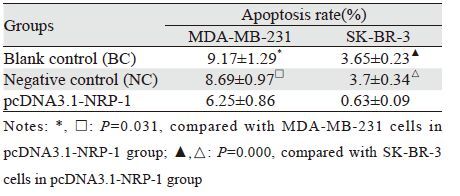
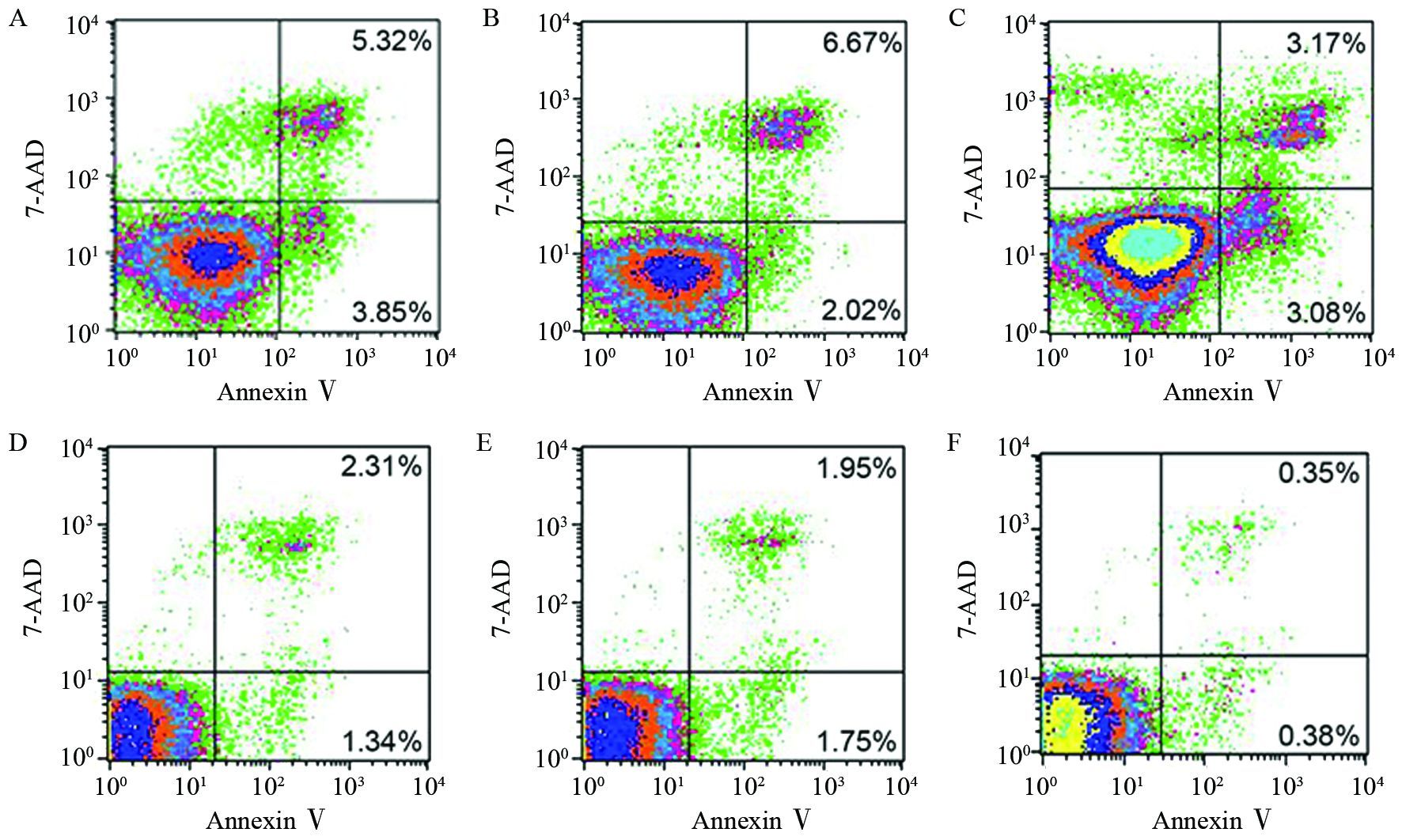
pcDNA3.1-NRP-1组细胞凋亡率低于对照组,两组比较差异有统计学意义(P<0.05),而阴性对照与空白对照组相比差异无统计学意义(P<0.05),见表 3、图 5。
|
|
| A: MDA-MB-231 blank control; B: MDA-MB-231 negative control; C: MDA-MB-231 pcDNA3.1-NRP-1; D: SK-BR-3 blank control; E: SK-BR-3 negative control; F: SK-BR-3 pcDNA3.1-NRP-1 图 5 NRP-1过表达后对细胞凋亡的影响 Figure 5 Cell apoptosis rates after lipofectamine transfection |
结果显示:空白对照组、阴性对照组和过表达组穿过Transwell小室的细胞数分别为(94.0±4.1)、(90.0±3.0)、(144.0±5.13)个,过表达组穿膜细胞数较空载体组及正常组明显升高,差异有统计学意义(pcDNA3.1-NRP-1组与BC、NC组比,P=0.000、P=0.000),见图 6。

|
| A: blank control (BC); B: negative control (NC); C: pcDNA3.1-NRP-1 图 6 NRP-1过表达对MDA-MB-231细胞迁移能力的影响 (×400) Figure 6 Migration abilities of MDA-MB-231 cells detected by Transwell (×400) |
结果显示:空白对照组、阴性对照组和过表达组穿过Transwell小室的细胞数分别为(56.0±5.12)、(55.0±4.5)、(86.0±5.14)个,过表达组穿过的细胞数明显高于对照组和空载体组,差异有统计学意义(pcDNA3.1-NRP-1组与BC、NC组比,P=0.002、P=0.001),见图 7。
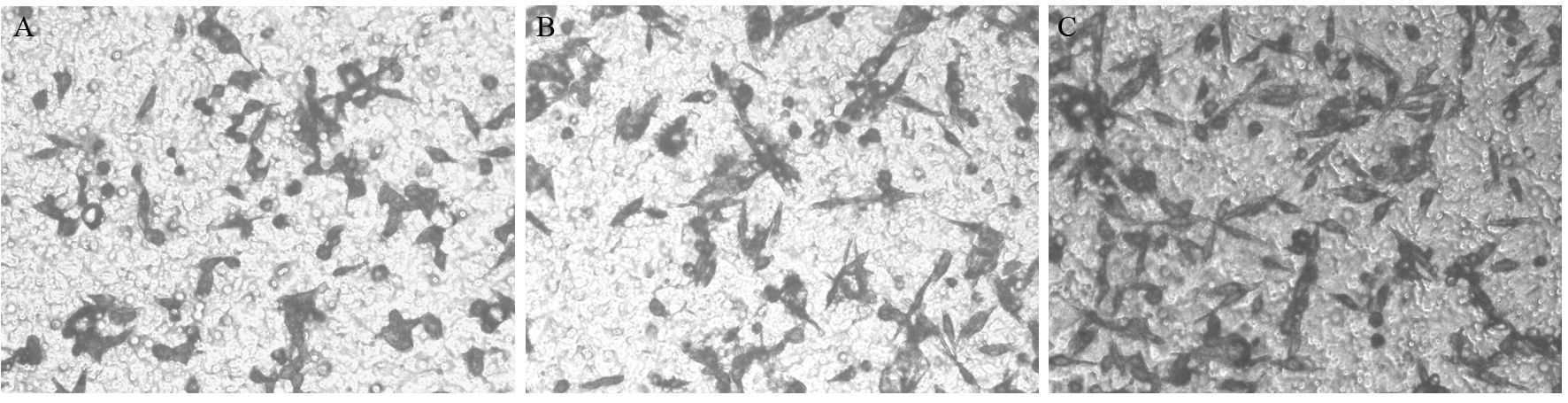
|
| A: blank control (BC); B: negative control (NC); C: pcDNA3.1-NRP-1 图 7 NRP-1过表达对MDA-MB-231细胞侵袭能力的影响(×400) Figure 7 Invasion abilities of MDA-MB-231 cells detected by Transwell (×400) |
据2014年美国癌症学会统计,乳腺癌是女性最常见的恶性肿瘤[4],近年来我国乳腺癌发病率不断上升,是导致女性死亡的主要病因之一。乳腺癌的治疗包括手术、放疗、化疗、内分泌治疗及分子靶向治疗,但总体治疗效果不尽如人意[5]。肿瘤生长依赖于血管生成,VEGF为肿瘤抗血管生成的主要靶点,其组织内新生血管形成是导致转移和进展的主要原因[6]。贝伐珠单抗是针对VEGF的人源化单克隆抗体,是靶向VEGF的典型代表药物,但有研究表明贝伐珠单抗并没有使OS显著提升[7],且长期使用会出现高血压、出血、器官损伤、心脏衰竭等一系列严重的不良反应[8]。因此急需寻找新的靶向治疗乳腺癌的方法。
NRP-1由胞外区、跨膜区、胞内区三部分组成,不仅表达于内皮细胞中,在乳腺癌、胰腺癌、肺癌、喉癌等多种肿瘤组织中广泛表达,表达量高于相应正常组织[9-12]。NRP-1作为VEGF的协同受体,其表达可增强VEGF与VEGFR-2的结合,从而增加其促进细胞有丝分裂及血管生成的活性[13]。NRP-1的过表达导致大量的血管生成,而NRP-1突变的胚胎中显示了血管缺陷,特别是神经脉管系统[14]。在多种肿瘤模型中如非小细胞肺癌、鼻咽癌、骨肉瘤等,用小干扰靶向NRP-1也明显抑制了肿瘤生长、血管生成、转移,这显示了NRP-1在血管生成中的重要作用[15-17]。王雅冰等[18]研究发现,乳腺癌组织中NRP-1阳性表达率明显高于乳腺纤维腺瘤和乳腺囊性增生症,其表达量高低与腋窝淋巴结转移和TNM分期密切相关,可作为评价肿瘤预后及恶性程度的指标,因此NRP-1或可成为乳腺癌靶向治疗的新型受体。目前关于NRP-1对乳腺癌细胞生物学行为影响的研究较少,本研究通过上调乳腺癌细胞株NRP-1的表达,探索其对乳腺癌细胞增殖、凋亡、迁移及侵袭的影响。
脂质体转染是非病毒转染法中运用最为广泛的一种方法,其较病毒转染法具有低毒、低免疫原性的特点,且其操作简便、转染效率较高,既可以用于稳定转染,也可以用于瞬时转染[19]。本研究通过脂质体稳定转染的方法使原本低表达NRP-1的乳腺癌细胞株MDA-MB-231、SK-BR-3过表达该基因,用Western blot、RT-qPCR方法检测到细胞NRP-1蛋白、RNA表达量增加。在CCK-8增殖实验中发现,NRP-1过表达组较对照组细胞增殖率增加。流式细胞仪检测结果表明NRP-1过表达组较对照组细胞凋亡率有所减少。Transwell细胞侵袭及迁移实验结果发现,NRP-1过表达组穿过小室的细胞数目较对照组的细胞数明显增多。表明NRP-1能够促进乳腺癌细胞的增殖、抑制其凋亡,并且能够显著增加细胞的侵袭及迁移能力,在乳腺癌发生、浸润、转移过程中起着一定作用。预示NRP-1可以作为治疗乳腺癌的新靶点,为乳腺癌的治疗提供了一个新思路。
| [1] | Weidner N, Folkman J, Pozza F, et al. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma[J]. J Natl Cancer Inst, 1992, 84 (24) : 1875–87. DOI:10.1093/jnci/84.24.1875 |
| [2] | Pellet-Many C, Frankel P, Jia H, et al. Neuropilins: structure, function and role in disease[J]. Biochem J, 2008, 411 (2) : 211–26. DOI:10.1042/BJ20071639 |
| [3] | Plein A, Fantin A, Ruhrberg C. Neuropilin regulation of angiogenesis, arteriogenesis, and vascular permeability[J]. Microcirculation, 2014, 21 (4) : 315–23. DOI:10.1111/micc.2014.21.issue-4 |
| [4] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64 (1) : 9–29. DOI:10.3322/caac.21208 |
| [5] | Alvarez RH, Valero V, Hortobagyi GN. Emerging targeted therapies for breast cancer[J]. J Clin Oncol, 2010, 28 (20) : 3366–79. DOI:10.1200/JCO.2009.25.4011 |
| [6] | Appleton BA, Wu P, Maloney J, et al. Structural studies of neuropilin/antibody complexes provide insights into semaphorin and VEGF binding[J]. EMBO J, 2007, 26 (23) : 4902–12. DOI:10.1038/sj.emboj.7601906 |
| [7] | Perez EA, Spano JP. Current and emerging targeted therapies for metastatic breast cancer[J]. Cancer, 2012, 118 (12) : 3014–25. DOI:10.1002/cncr.26356 |
| [8] | Choueiri TK, Mayer EL, Je Y, et al. Congestive heart failure risk in patients with breast cancer treated with bevacizumab[J]. J Clin Oncol, 2011, 29 (6) : 632–8. DOI:10.1200/JCO.2010.31.9129 |
| [9] | Jubb AM, Strickland LA, Liu SD, et al. Neuropilin-1 expression in cancer and development[J]. J Pathol, 2012, 226 (1) : 50–60. DOI:10.1002/path.v226.1 |
| [10] | Song HP, Wang CY, Zhang JH, et al. Expression of Neuropilin-1 in human pancreatic carcinoma and cell lines[J]. Zhong Liu Fang Zhi Yan Jiu, 2005, 32 (9) : 549–50. [ 宋海平, 王春友, 张景辉, 等. Neuropilin-1在胰腺癌组织及细胞系中的表达[J]. 肿瘤防治研究, 2005, 32 (9) : 549–50. ] |
| [11] | Liu HX. Expression of Nueropilin-1 in non-small cell lung cancer and its clinical significance[J]. Shi Yong Yu Fang Yi Xue, 2011, 18 (10) : 1941–3. [ 刘宏侠. NRP-1在非小细胞肺癌中的表达及临床意义[J]. 实用预防医学, 2011, 18 (10) : 1941–3. ] |
| [12] | Zhang J, Zhang SQ, Dong P, et al. Significance of changes in NRP-1 and VEGFR expression in squamous lung carcinomas[J]. Shandong Yi Yao, 2015, 50 (18) : 95–6. [ 张佳, 张速勤, 董频, 等. 喉鳞癌组织中NRP-1、VEGF的表达变化及意义[J]. 山东医药, 2015, 50 (18) : 95–6. ] |
| [13] | Soker S, Takashima S, Miao HQ, et al. Neuropilin-1 is expressed by endothelial and tumor cells as an isoform specific receptor for vascular endothelial growth factor[J]. Cell, 1998, 92 (6) : 735–45. DOI:10.1016/S0092-8674(00)81402-6 |
| [14] | Takashima S, Kitakaze M, Asakura M, et al. Targeting of both mouse neuropilin-1 and neuropilin-2 genes severely impairs developmental yolk sac and embryonic angiogenesis[J]. Proc Natl Acad Sci U S A, 2002, 99 (6) : 3657–62. DOI:10.1073/pnas.022017899 |
| [15] | Dong JC, Gao H, Zuo SY, et al. Neuropilin 1 expression correlates with the Radio-resistance of human non-small-cell lung cancer cells[J]. J Cell Mol Med, 2015, 19 (9) : 2286–95. |
| [16] | Sun J, Wang L, Lou WH, et al. NRP-1/shRNA silencing suppresses nasopharyngel carcinoma cell growth in vitro and in vivo[J]. Zhonghua Er Bi Hou Yan Tou Jing Wai Ke Za Zhi, 2015, 50 (4) : 312–7. [ 孙瑾, 王亮, 娄卫华, 等. shRNA沉默NRP-1基因抑制鼻咽癌CNE-2Z细胞生长的体内外研究[J]. 中华耳鼻咽喉头颈外科杂志, 2015, 50 (4) : 312–7. ] |
| [17] | Yue B, Ma JF, Yao G, et al. Knockdown of neuropilin-1 suppresses invasion, angiogenesis, and increases the chemosensitivity to doxorubicin in osteosarcoma cells-an in vitro study[J]. Eur Rev Med Pharmacol Sci, 2014, 18 (12) : 1735–41. |
| [18] | Wang YB, Sheng MJ. Expression and clinical significance of nueropilin-1 in breast invasive ductal carcinoma[J]. Shi Yong Yu Fang Yi Xue, 2011, 18 (7) : 1277–8. [ 王雅冰, 生孟军. 乳腺浸润性导管癌中NRP-1的表达及其临床意义[J]. 实用预防医学, 2011, 18 (7) : 1277–8. ] |
| [19] | Aronsohn AI, Hughes JA. Nuclear localization signal peptides enhance cationic liposome-mediated gene therapy[J]. J Drug Target, 1998, 5 (3) : 163–9. DOI:10.3109/10611869808995871 |
 2016, Vol. 43
2016, Vol. 43


