文章信息
- 缺氧对喉癌Hep-2细胞HIF-1α、GLUT-1、MMP-2表达的影响
- Effect of Hypoxia on Expression of HIF-1α, GLUT-1 and MMP-2 in Laryngeal Carcinoma Cell Line Hep-2
- 肿瘤防治研究, 2016, 43(8): 663-667
- Cancer Research on Prevention and Treatment, 2016, 43(8): 663-667
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.08.003
- 收稿日期: 2015-12-12
- 修回日期: 2016-03-12
喉癌是头颈部常见恶性肿瘤之一。在中国,喉癌约占头颈部肿瘤的13.9%,占全身恶性肿瘤的2.1%[1]。缺氧是实体肿瘤恶性增殖过程中一个普遍存在现象[2],缺氧诱导因子-lα(hypoxia inducible factor-1α, HIF-1α)是喉癌细胞缺氧反应元件上的重要调控因子,具有调节相关下游基因的转录的作用[3]。葡萄糖转运蛋白-1(glucose transporter-1, GLUT-1)参与喉癌细胞的葡萄糖跨膜转运,GLUT-1在喉癌细胞中的高表达与肿瘤细胞的增殖、侵袭及转移相关[4]。基质金属蛋白酶-2(MMP-2)通过降解基底膜中的Ⅳ型胶原,能促进喉癌细胞的转移[5]。本实验通过研究喉癌细胞系Hep-2在缺氧条件下HIF-1α、GLUT-1、MMP-2的表达变化,探讨喉癌细胞在缺氧环境下的部分生物学行为。
1 材料与方法 1.1 材料Hep-2喉癌细胞株购买于中国科学院(上海)。100 u/ml青霉素、L-谷氨酰氨、100 μg/ml链霉素均购自武汉博士德生物公司,DMEM培养液、小牛血清和胰蛋白酶购自美国Gibco公司,MTT试剂盒购自博士德生物公司(武汉);分光光度仪(Multiskan MS, Labsystems Oy, 芬兰赫尔辛基);细胞培养箱(美国热电,3111型);TRIzol总RNA提取试剂(美国Invitrogen公司);Quant OneStep RT-PCR Kit(北京天根生化);SYBR Green荧光实时定量PCR试剂盒(北京天根生化);鼠抗HIF-1α单克隆抗体(美国, Santa Cruz公司, sc13515);鼠抗MMP-2单克隆抗体(美国, Santa Cruz公司, sc13594);兔抗GLUT-1多克隆抗体(美国, Santa Cruz公司, sc7903);辣根酶标记羊抗小鼠lgG(英国, Abcam公司);辣根酶标记抗兔lgG抗体(英国, Abcam公司),ECL试剂盒(瑞典, Amersham Biosciences公司),辣根酶标记的β-actin抗体(上海兴悠生物科技有限公司);引物均由上海捷瑞生物工程有限公司合成。荧光定量PCR仪为ABI PSISM 6700型。
1.2 细胞培养Hep-2细胞在37℃、5%CO2,包含10%胎牛血清,2 ml L-谷氨酰氨溶液,100 u/ml青霉素和100 μg/ml链霉素的细胞培养液中培养。在细胞至60%~70%聚集时再将细胞置于37℃、含1%O2、5%CO2、94%N2的缺氧培养箱中继续培养,并分别收集培养0、12、24、36和48 h时的细胞提取总RNA及总蛋白。
1.3 MTT法检测细胞增殖将培养的Hep-2细胞,以5×104个/孔接种于96孔板,每孔接种100 μl,培养液为含有10%小牛血清的DMEM,待细胞长至60%~70%融合状态时,将Hep-2细胞以5.0×104/ml接种于96孔板中,每组均设6个平行孔,缺氧条件下分别培养0、12、24、36和48 h后加入20 μl MTT(5 mg/ml),继续培养4 h后加入DMSO振荡、调零,酶标仪570 nm波长处检测光密度OD值。
1.4 Transwell实验检测缺氧对喉癌Hep-2细胞侵袭能力的影响在上室膜表面均匀铺培养液稀释的Matrigel(1:3),37℃培养箱中放置30 min,Matrigel凝固。再加入200 μl无血清悬浮培养液,轻洗水化基底膜后备用。取对数生长期的Hep-2细胞常规消化后,用含1%FBS的培养液重悬细胞,调整浓度为5×105个每毫升,取 200 μl细胞悬液加入上室,另取200 μl含20%FBS的培养液放置于Transwell下室内,每组均设6个复孔,缺氧条件下分别培养12、24、36和48 h后,取出小室,弃去培养液,棉签擦去位于上室的细胞,PBS漂洗2次,每孔加入10%甲醇溶液固定,再弃甲醇溶液,加入细胞染液染色,弃染色液,蒸馏水洗涤,干燥,显微镜下随机选取5个视野,计数侵袭细胞数,实验独立重复3次。
1.5 划痕实验检测缺氧对喉癌Hep-2细胞迁移能力的影响取单层融合的Hep-2细胞,用1 ml枪头在细胞层上垂直划线,PBS冲洗3次,去除划下的细胞,缺氧培养12、24、36和48 h,显微镜下观察细胞的迁移情况,软件分析并计算平均划痕愈合率。
1.6 测定HIF-1α、GLUT-1、MMP-2 mRNA表达水平Hep-2细胞培养同1.3。设计上、下游引物:HIF-1α:上游引物5’-CAACCGGTTTAAGGACACATTCTG-3’,下游引物5’-TCTGGGTTGAAACTCAAGCAACTG-3’。HIF-1α扩增产物片段长度为150 bp;GLUT-1:上游引物5’-TCTCTGGGTAACAGGGATCAAACA-3’,下游引物5’-ACTGCAACGGCTTAGACTTCGAC-3’;GLUT-1扩增产物片段长度为102 bp;MMP-2:上游引物5’-GTATTTGATGGCATCGCTCA-3’,下游引物5’-TACTCCCTGCAAAGAACACA-3’;MMP-2扩增产物片段长度为198 bp;GAPDH:上游引物5’-GTCAACGGATTTGGTCGTATTG-3’下游引物5’-TGGAGGGATCTCGCTCCTGGAAGAT-3’。GAPDH扩增长度为214 bp。
提取Hep-2细胞总RNA;cDNA合成;取cDNA1 μl,2.5×RealMasterMix/20×SYBR Solution 11.25 μl,上下游引物各1 μl,加无Rnase水,总反应体积25 μl;PCR反应条件为:95℃变性2 min,循环95℃变性15 s,50℃退火30 s,68℃延伸50 s。共30个循环,结果采用ΔCt值法,ΔCt=样品的Ct均值-内参的Ct均值,2-ΔΔCt即某样品初始cDNA的相对量。
1.7 Western blot检测HIF-1α、GLUT-1、MMP-2蛋白表达水平收集不同缺氧时间点的Hep-2细胞,提取总蛋白,BCA法蛋白定量,上样,SDS-PAGE电泳后转膜,PBS洗膜,5%脱脂牛奶封闭l h;PBS洗膜后,加入一抗,4℃过夜;PBS洗膜,用辣根过氧化物酶标记的二抗,孵育0.5 h;洗膜后用增强化学发光试剂盒检测。结果扫描后,Quantity one图像分析软件进行光密度分析,以β-actin为内参校正。
1.8 统计学方法采用SPSS17.0软件进行统计分析,两组间均数比较用t检验。P<0.05为差异有统计学意义。
2 结果 2.1 MTT法检测缺氧下Hep-2细胞的生长活性缺氧条件下,Hep-2细胞的存活率随缺氧时间的延长,光密度值逐渐升高,提示细胞存活率增高。培养0、12、24、36和48 h时的细胞吸光度值比较,组间差异均有统计学意义(t=4.392, P=0.001; t=4.137, P=0.002; t=7.974, P=0.000; t=3.219, P=0.009),见图 1。
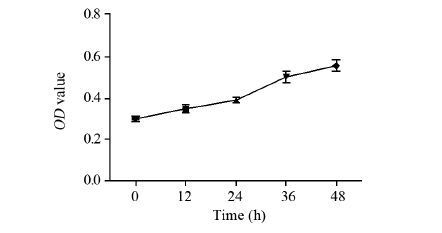
|
| 图 1 MTT法检测缺氧对Hep-2细胞增殖的影响(OD值) Figure 1 Effect of hypoxia on proliferation of Hep-2 cells detected by MTT (OD value) |
Transwell小室法检测结果表明:缺氧环境明显提高了喉癌Hep-2细胞的侵袭能力。缺氧培养24 h(t=5.870, P=0.000)、36 h(t=10.056, P=0.000)和48 h(t=10.178, P=0.000)喉癌Hep-2细胞的侵袭数量明显高于正常条件下喉癌Hep-2细胞的侵袭数量,见图 2。
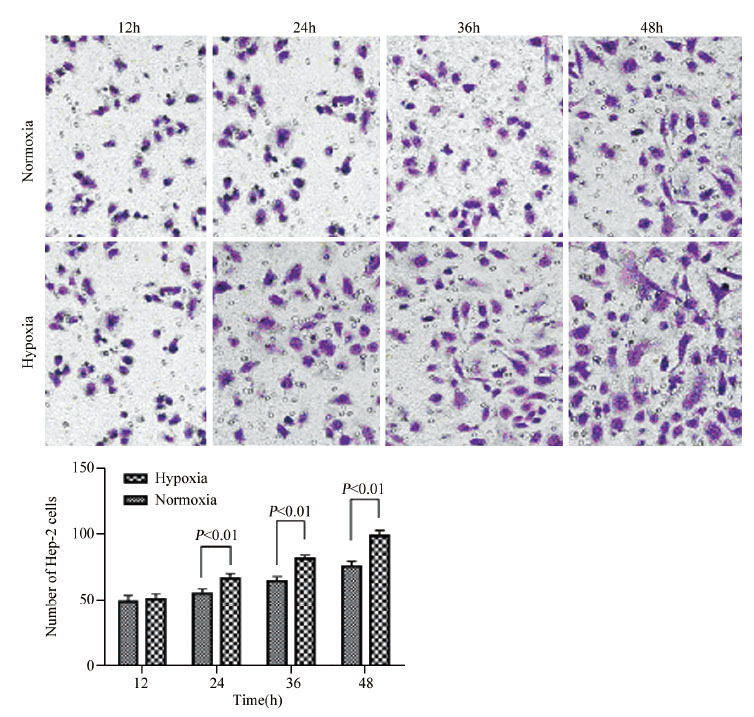
|
| 图 2 缺氧对喉癌Hep-2细胞侵袭能力的影响 Figure 2 Effect of hypoxia on invasive ability of laryngeal carcinoma cells Hep-2 detected by Transwell chamber assay |
划痕实验法检测结果表明:缺氧环境明显提高了喉癌Hep-2细胞的迁移能力。缺氧培养12 h(t=10.968, P=0.000)、24 h(t=11.122, P=0.000)、36 h(t=8.673, P=0.000)和48 h(t=9.778, P=0.000)喉癌Hep-2细胞的划痕愈合率明显高于正常条件下喉癌Hep-2细胞的划痕愈合率,见图 3。
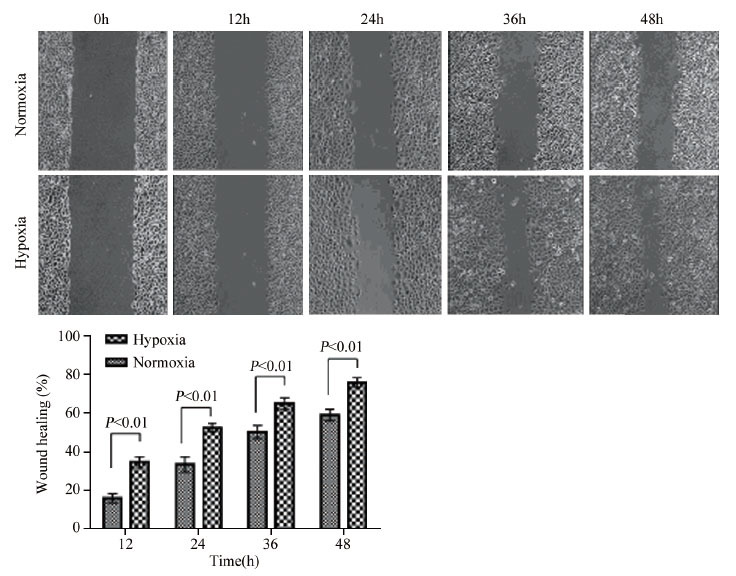
|
| 图 3 缺氧对喉癌Hep-2细胞迁移能力的影响 Figure 3 Effect of hypoxia on migration ability of laryngeal carcinoma Hep-2 cells detected by wound healing assay |
缺氧条件下,HIF-1α mRNA的表达水平相对稳定。与缺氧培养0 h比较,缺氧培养12、24 、36、48 h,HIF-1α mRNA的表达差异无统计学意义(t=1.439, P=0.181; t=0.378, P=0.714; t=0.739, P=0.477; t=0.352, P=0.732);缺氧培养0 h 和12 h比较,GLUT-1 mRNA的表达水平相对稳定(t=0.293, P=0.776);与缺氧培养0 h比较,缺氧培养24、36、48 h,GLUT1 mRNA的表达水平逐步升高,差异有统计学意义(t=12.76, P=0.000; t=3.222, P=0.009; t=5.406, P=0.000);与缺氧培养0 h比较,缺氧培养12、24、36、48 h,MMP-2 mRNA表达在不同时间点上逐步升高,差异有统计学意义(t=7.986, P=0.000; t=4.463, P=0.001; t=9.099, P=0.000; t=8.403, P=0.000),见图 4。
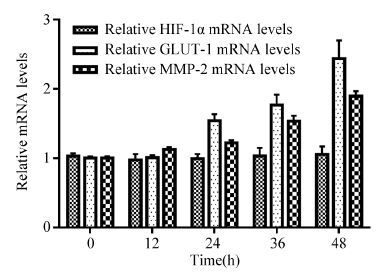
|
| 图 4 缺氧不同时间点HIF-1α、GLUT-l、MMP-2 mRNA在Hep-2细胞中的表达 Figure 4 mRNA expression of HIF-1α, GLUT-l and MMP-2 in Hep-2 cells at various time points under hypoxia |
缺氧条件下,HIF-1α蛋白在Hep-2细胞中的表达水平明显升高,与缺氧培养0 h比较,缺氧培养12、24、36、48 h,HIF-1α蛋白水平差异有统计学意义(t=3.691, P=0.004; t=2.553, P=0.029; t=2.909, P=0.016; t=10.73, P=0.000)。缺氧培养0 h和12 h比较,GLUT-1的蛋白表达水平相对稳定(t=0.4075, P=0.692);但与缺氧培养0 h比较,缺氧培养24、36、48 h,GLUT-1的蛋白表达在不同时间点差异均有统计学意义(t=11.15, P=0.000; t=3.995, P=0.003; t=6.914, P=0.000)。缺氧条件下,MMP-2蛋白表达水平明显提高,与缺氧培养0 h比较,缺氧培养12、24 h,MMP-2蛋白水平有显著性上升(t=14.58, P=0.000; t=25.32, P=0.000);但缺氧培养24、36 h,MMP-2蛋白水平无显著性变化(t=1.433, P=0.182);缺氧培养36、48 h,蛋白水平又显著性上升(t=16.84, P=0.000),见图 5。
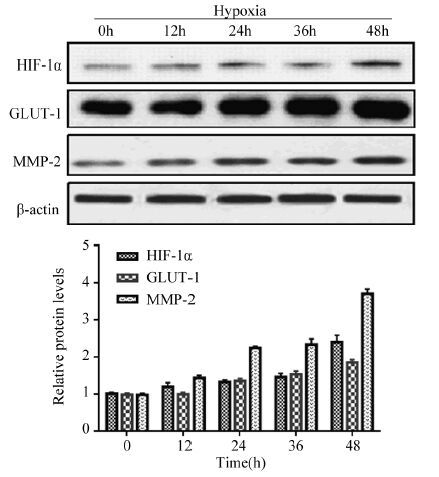
|
| 图 5 Western blot检测不同缺氧时间点的Hep-2细胞HIF-1α、GLUT-1和MMP-2蛋白的表达 Figure 5 Expression of HIF-1α, GLUT-1 and MMP-2 protein in Hep-2 cells at various time points under hypoxia detected by Western blot |
在喉癌肿瘤中,由于肿瘤组织生长过快,肿瘤细胞内部存在缺氧情况。本研究发现,随着缺氧时间的延长喉癌Hep-2细胞计数逐渐增高,侵袭和迁移能力逐渐增强。这说明一定程度的缺氧会促进喉癌Hep-2细胞的增殖,生物学行为发生变化以适应缺氧。
细胞适应缺氧的重要调节因子是HIF-1,HIF-1α是HIF-1氧调节亚单位,在正常条件下,HIF-1α被羟基化而降解,但缺氧条件下,HIF-1α的羟基化被抑制,HIF-1α浓度升高,进而上调下游靶基因的表达[6-7],从而促进能量摄取和代谢以满足肿瘤细胞的快速增殖。本研究表明:缺氧条件下,Hep-2细胞中HIF-lα mRNA水平基本稳定,仅是蛋白水平增加,这与其他文献报道一致[8],也进一步说明,缺氧影响HIF-1α蛋白的表达主要在转录后水平而在非转录水平上。
GLUT-1是膜表达的葡萄糖转运载体,在缺氧微环境中,肿瘤细胞高表达GLUT-1,增加葡萄糖转运和摄取,满足能量需求[9]。临床研究表明GLUT-1的表达与头颈部肿瘤的预后有密切关系[10]。本研究发现在正常条件下的Hep-2细胞中即有GLUT-1的表达,缺氧能增强其mRNA和蛋白的表达。Hayashi等[11]研究表明:在缺氧条件下,HIF-1α蛋白能上调GLUT-1表达。本研究中GLUT-1蛋白表达在缺氧24 h后才出现显著上升,且出现在HIF-1α蛋白表达上调之后,这一点也支持了上述观点。但也有研究认为缺氧时GLUT-1的表达是受HIF-1α和细胞氧化磷酸化双重调节的[12]。因此,两者之间的调控关系还需要进一步探讨。
MMP-2通过降解细胞外基质和胶原,在肿瘤的侵袭、转移中发挥重要作用[13]。研究表明MMP-2与喉癌淋巴转移有密切联系[5, 14]。另有研究表明,缺氧条件下,HIF-1α能够促进MMP-2的表达[15],本研究显示,缺氧条件下,Hep-2细胞中MMP-2 mRNA和蛋白的表达水平随时间逐渐升高。提示缺氧环境可以上调MMP-2的表达,这有利于喉癌细胞的侵袭和转移,但在喉癌Hep-2细胞中MMP-2的表达上调是否与HIF-1α有关还需要进一步研究。
综上,缺氧环境能促进喉癌Hep-2细胞增殖,增强其侵袭和迁移能力。缺氧能上调HIF-1α、GLUT-1、MMP-2蛋白的表达,能上调GLUT-1 mRNA、MMP-2 mRNA的表达。研究提示:在缺氧环境下,喉癌细胞通过上调HIF-1α、GLUT-1、MMP-2的表达,进而增强其增殖、侵袭、转移的能力,促进喉癌的发展。同时本研究也为以HIF-1α、GLUT-1、MMP-2为靶点的基因治疗提供了一定的依据。
| [1] | Kong WJ. Otorhinolaryngology-head and neck surgery[M]. 2nd Edition. Beijing: People's Medical Publishing House, 2010 : 460 . [ 孔维佳. 《耳鼻咽喉头颈外科学》[M]. 北京: 人民卫生出版社, 2010 : 460.] ] |
| [2] | Weljie AM, Jirik FR. Hypoxia induced metabolic shifts in cancer cells: moving beyond the Warburg effect[J]. Int J Biochem Cell Biol, 2011, 43 (7) : 981–9. DOI:10.1016/j.biocel.2010.08.009 |
| [3] | Yu L, Liu Y, Cui Y. Expression of hypoxia inducible factor-1alpha and its relationship to apoptosis and proliferation in human laryngeal squamous cell carcinoma[J]. J Huazhong Univ Sci Technolog Med Sci, 2004, 24 (6) : 636–8. DOI:10.1007/BF02911379 |
| [4] | Wu XH, Chen SP, Mao JY, et al. Expression and significance of hypoxia-inducible factor-1α and glucose transporter-1 in laryngealcarcinoma[J]. Oncol Lett, 2013, 5 (1) : 261–6. |
| [5] | Lotfi A, Mohammadi G, Saniee L, et al. Serum Level of Matrix Metalloproteinase-2 and -9 in Patients with Laryngeal Squamous Cell Carcinoma and Clinical Significance[J]. Asian Pac J Cancer Prev, 2015, 16 (15) : 6749–51. DOI:10.7314/APJCP.2015.16.15.6749 |
| [6] | Gatenby RA, Smallbone K, Maini PK, et al. Cellular adaptations to hypoxia and acidosis during somatic evolution of breast cancer[J]. Br J Cancer, 2007, 97 (5) : 646–53. DOI:10.1038/sj.bjc.6603922 |
| [7] | Zimna A, KurpiszM. Hypoxia-Inducible Factor-1 in Physiological and Pathophysiological Angiogenesis: Applications and Therapies[J]. Biomed Res Int, 2015, 2015 : 549412. |
| [8] | Xu L, Wang F, Wei W, et al. Effects of hypoxia on the expressions of hypoxia-inducible factor-1 alpha and miR-210 in hepatocellular carcinoma HepG2 cells[J]. Zhong Liu, 2011, 31 (6) : 502–7. [ 徐凌, 王锋, 卫巍, 等. 低氧对人肝癌HepG2细胞中HIF-lα及MIR-210表达的影响[J]. 肿瘤, 2011, 31 (6) : 502–7. ] |
| [9] | Bao YY, Zhou SH, Fan J, et al. Anticancer mechanism of apigenin and the implications of GLUT-1 expression in head and neck cancers[J]. Future Oncol, 2013, 9 (9) : 1353–64. DOI:10.2217/fon.13.84 |
| [10] | Eckert AW, Kappler M, Schubert J, et al. Correlation of expression of hypoxia-related proteins with prognosis in oral squamous cell carcinoma patients[J]. Oral Maxillofac Surg, 2012, 16 (2) : 189–96. DOI:10.1007/s10006-012-0335-8 |
| [11] | Hayashi M, Sakata M, Takeda T, et al. Induction of glucose transportor-1 expression through hypoxia-inducible factor 1 alpha under hypoxic conditions in trophoblast derived cells[J]. J Endocrinol, 2004, 183 (1) : 145–54. DOI:10.1677/joe.1.05599 |
| [12] | Behrooz A, Ismail-Beigi F. Dual control of glutl glucose transporter gene expression by hypoxia and by inhibition of oxidative phosphorylation[J]. J Biol Chem, 1997, 272 (9) : 5555–62. DOI:10.1074/jbc.272.9.5555 |
| [13] | Corcoran ML, Hewitt RE, Kleiner DE Jr, et al. MMP-2: expression, activation and inhibition[J]. Enzyme Protein, 1996, 49 (1-3) : 7–19. |
| [14] | Kondakova IV, Klisho EV, savenkova OV, et al. Matrix metalloproteinase 2 and 9 as the factor of head and neck tumor metastasis[J]. Biomed Khim, 2008, 54 (5) : 555–60. |
| [15] | Jing SW, Wang YD, Kuroda M, et al. HIF-1α contributes to hypoxia-induced invasion and metastasis of esophageal carcinoma via inhibiting E-cadherin and promoting MMP-2 expression[J]. Acta Med Okayama, 2012, 66 (5) : 399–407. |
 2016, Vol. 43
2016, Vol. 43
