文章信息
- 清肺合剂联合化疗治疗中晚期非小细胞肺癌的临床观察
- Clinical Investigation on Qingfei Mixture Combined with Chemotherapy on Middle and Advanced Non-small Cell Lung Cancer
- 肿瘤防治研究, 2016, 43(7): 609-615
- Cancer Research on Prevention and Treatment, 2016, 43(7): 609-615
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.07.014
- 收稿日期: 2016-01-15
- 修回日期: 2016-03-30
据最新的GLOBOCAN 2012报告,世界范围内恶性肿瘤新发病例和死亡病例占首位的均为肺癌(分别为180万,占13%;160万,占19.4%)[1]。《2012中国肿瘤登记年报》[2]显示,肺癌也占据中国恶性肿瘤发病和死亡的首位。
非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌的80%,以药物为主的内科治疗成为晚期NSCLC患者的主要治疗手段。传统化疗使其1年生存率提高了10%[3]。目前含铂两药方案是晚期NSCLC的标准治疗[4-5]。多数NSCLC患者年龄较大,常合并基础疾病,二线化疗耐受性较差,给晚期NSCLC患者选择一种高效、低毒、廉价、依从性好的治疗方案成为临床医生的难题[6-7]。
中医药治疗肺癌的理论核心是“辨证论治”,而辨证论治的核心就是个体化治疗。故中西医治疗二者之间是相辅相成的。
为此,我们以中药联合化疗治疗中晚期NSCLC减毒增效为切入点,采用随机对照的方法,通过观察入组患者的近期疗效、临床症状改善情况、总生存(overall survival, OS)等指标,试图确定中药联合化疗治疗中晚期NSCLC的优化方案,为中药联合化疗治疗中晚期NSCLC临床治疗规范化标准的制定提供数据,现将研究结果报道如下。
1 资料与方法 1.1 纳入和排除标准入组标准:(1)患者均签署知情同意;(2)年龄18岁及以上;(3)预计生存期大于12周;(4)经组织学或细胞学确诊的ⅢB/Ⅳ期初治或一线化疗失败的NSCLC;(5)体力状态评分(PS)0~2分;(6)血常规:白细胞≥4×109/L,中性粒细胞≥2×109/L,血小板≥100×109/L,血红蛋白≥100 g/L。肝功能:血胆红素≤1.5 ULN,谷丙转氨酶(ALT)、谷草转氨酶(AST)≤2.5 ULN;肾功能:血清肌酐≤1.5 ULN;(7)有客观的可评价病灶(在螺旋CT上最长径至少10 mm);(8)能够口服中药汤。
排除标准:(1)有症状的中枢神经系统转移;(2)哺乳期的妇女;(3)合并活动性的系统性疾病;(4)可行胸部放疗的ⅢB期患者;(5)治疗前4周内行放化疗治疗;(6)目前或计划参与其他临床试验的患者;(7)糖尿病患者。
剔除标准:(1)不符合入组标准的病例;(2)不遵守试验的要求,明显违反本方案,或中途改用其他治疗者;(3)因不良反应而出组不可评价疗效的病例,但将其不良反应列入统计。
伦理规范:每位患者入选本研究前,研究医师向患者完整、全面地介绍本研究的目的、药物的性能及其可能出现的不良反应和风险,让患者知道他们的权利,所要承担的风险和受益。入选前患者签署知情同意书,并保留在临床试验观察表(CRF)中。
本研究经医院伦理委员会批准后实施。在临床研究期间试验方案做任何修改均应向伦理委员会报告并备案。
1.2 病例分组2011年11月至2014年2月,根据研究方案制定的纳入和排除标准,剔除10例不符合入组标准的患者,共有98例浙江省肿瘤医院收治的中晚期NSCLC患者纳入本研究。按随机数字表法将患者分为两组:对照组34例行单纯化疗,其中男25例、女9例,年龄39~76岁,平均(58.0±9.6)岁;病理类型:鳞癌5例、腺癌20例、其他9例;按照1997年国际TNM分期标准分期,ⅢB期4例、Ⅳ期30例。试验组64例行清肺合剂联合化疗,其中男42例、女22例,年龄30~81岁,平均(58.0±10.5)岁;病理类型:鳞癌14例、腺癌40例、其他10例;分期ⅢB期13例、Ⅳ期51例。两组患者在性别、年龄、病理类型以及分期等方面差异无统计学意义(P>0.05)。
1.3 治疗方案试验组:化疗同时给予清肺合剂50 ml口服,每日3次,为避免个别脾胃虚寒者出现胃部不适及腹泻症状,要求患者饭后1 h温开水冲淡服用;对照组:仅予单纯化疗。
两组一线化疗方案为:卡铂AUC 5.0~6.0每3周的第1天,或顺铂75~100 mg/m2每3周的第1天给药,联合以下4种药物之一:吉西他滨1 000~1 250 mg/m2每3周的第1天和第8天给药;多西他赛60~70 mg/m2每3周的第1天给药;紫杉醇175~225 mg/m2每3周的第1天给药;长春瑞滨25~30 mg/m2每3周的第1天和第8天给药。
二线单药化疗方案为:多西他赛60~75 mg/m2,第1天,或者培美曲塞二钠500 mg/m2,第1天。以上方案均是每3周为一周期,共进行4~6周期。
本临床研究中不允许选用其他化疗方案。在本临床研究给药期间,停止使用非本研究同意的其他抗肿瘤药物(主要是指其他化疗药物、分子靶向药物、其他抗肿瘤中成药等)。
患者每周复查血常规,每周期复查肝肾功能、肿瘤标志物、心电图、影像学检查等。当药物引起不良反应需进行治疗时,给予对症处理的药物:当化疗药物引起白细胞或血小板减少时,可给予造血刺激因子支持;当患者因化疗而引起呕吐时,可给予止呕剂;疼痛患者建议给予止痛药;当患者因其他原因出现便秘、腹泻、失眠等症状时,可给予对症治疗药物;当患者诊断骨转移时,可予双膦酸盐。
1.4 中医症候评分采用中医症状量表对治疗前后两组的中医症候进行评分。中医症状量表采用《中药新药临床研究指导原则》(第12版)[8]中原发性肺癌症状分级化量表标准分为轻、中、重,为方便计算,分别赋值1、2、3。
1.5 疗效及不良反应评价 1.5.1 WHO实体瘤近期客观疗效评定按照WHO实体瘤近期客观疗效评价标准分为完全缓解(CR)、部分缓解(PR)、微效(MR)、稳定(SD)和进展(PD)。有效率(RR)=(CR+PR)/总例数×100%,疾病控制率(DCR)=(CR+PR+MR)/总例数×100%。患者每2个化疗周期评价一次疗效,直至疾病进展。对于第1次观察评估为CR或者PR的,至少28天即4周再进行第2次评估,如果仍是CR或者PR,才可以确定是CR或者是PR。
1.5.2 实体瘤的中医肿瘤疗效评定实体瘤的中医肿瘤疗效评定权重标准[9]:总疗效(100%)=瘤体变化(30%)+临床症状(15%)+体力状况(15%)+生存期(40%)。显效:75~100分;有效:50~74分;稳定:25~49分;无效:<25分。
(1)瘤体变化按照WHO通用标准。占30分,依实际所得分数×0.3。CR:完全缓解(100分);PR:部分缓解(80分);MR:微效(50分);SD:稳定(30分);PD:发展(0分)。
(2)临床症状按照症状疗效评分标准。占15分,依实际所得分数×0.15。采用肺癌症状分级法[8],根据症状表现,每个症状的得分合计后乘以1/6即折算为百分制得分,再以此分×0.15即为实际得分。
其中治疗后比治疗前下降2个级别者,为显效(100分);下降1个级别者,为有效(50分);无变化者,为稳定(25分);症状进一步发展,为无效(0分)。
(3)体力状况按东部肿瘤协作组(ECOG)身体状况(PS)分级标准。占15分,依实际所得分数×20×0.15。显效:体力状况较用药前提高40分者(100分);有效:体力状况较用药前提高20分者(50分);稳定:体力状况较用药前无明显变化者(25分);无效:体力状况较用药前下降者(0分)。
(4)生存期≥12月(1年以上),得40分。从开始治疗日开始计算,每生存1月得10/3分,余下类推。最后总得分以四舍五入计算。
1.5.3 不良反应评价参照NCICTC第3版关于药物不良反应的分级评价进行评价。
1.6 随访及生存评价采用门诊复查、电话以及书信等方式对该项研究全部受试者进行随访,随访时间11月~3年。随访时间为治疗结束后开始直至患者肿瘤复发、死亡。随访截至2014年12月31日。治疗完成后每6周进行1次随访,进行全面复查,包括胸腹CT、头部MRI、骨ECT,血生化和肿瘤标志物检查。记录所有的死亡病例。生存时间:研究对象从随机入组到死亡或失访的时间。
1.7 统计学方法采用SPSS17.0统计学软件,计量资料采用均数±标准差(x±s),计数资料采用百分数(%),两组之间比较采用χ2检验或者t检验,预后分析采用Kaplan-Meier法绘制生存曲线,并进行Log rank检验,P<0.05为差异有统计学意义。
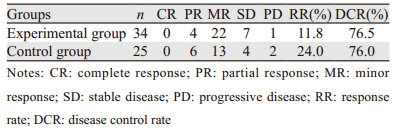
2 结果 2.1 临床疗效共有59例患者可以进行疗效评价,其中试验组34例,对照组25例。试验组CR 0例,PR 4例,RR为11.8%,DCR为76.5%。对照组CR 0例,PR 6例,RR为24.0%,DCR 76.0%,两组RR和DCR比较差异均无统计学意义(χ2=1.532, P=0.216; χ2=0.002, P=0.967),见表 1。
 |
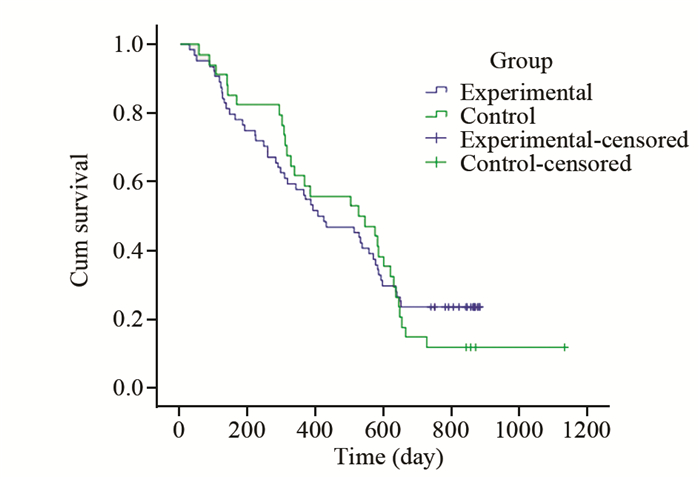
完成治疗的59例患者中失访6例,随访率为89.8%。试验组中位生存时间432天,对照组546天,两组比较差异无统计学意义(P=0.746);试验组1年生存率为57.8%,对照组61.8%,两组间比较差异无统计学意义(P=0.569);试验组2年生存率为23.4%,对照组11.8%,试验组略高于对照组,但经统计检验,两组差异无统计学意义(P=0.802),见图 1。
|
| 图 1 两组中晚期NSCLC患者生存曲线比较 Figure 1 Comparison of survival curves between two groups of advanced NSCLC patients |
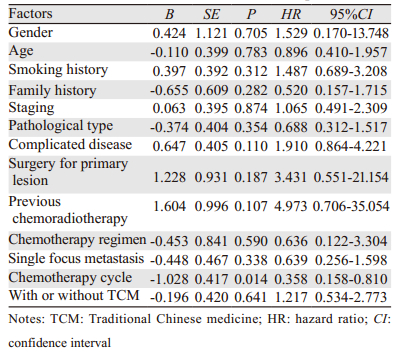
Cox回归模型多因素分析表明,化疗周期数是影响NSCLC患者预后的独立危险因素,见表 2,其中化疗周期≥4周期的患者相对于化疗周期<4周期的患者的风险比HR=0.358(95%CI: 0.158~0.810),P=0.014。
 |
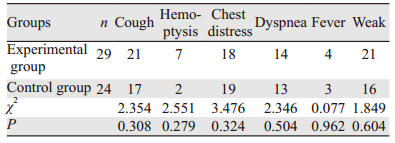
两组完成治疗的59例患者中,排除失访患者,共有53例患者可以进行临床症状方面比较。两组患者在临床症状(咳嗽、咯血、胸闷胸痛、气急、发热以及乏力)改善方面差异无统计学意义(P>0.05),见表 3。
 |
治疗前对照组和实验组分别有26例和44例患者可以进行中医症候评分比较,经比较两组差异无统计学意义(t=-0.675, P=0.502);治疗后对照组和实验组分别有25例和34例患者可以进行中医症候评分比较,经比较两组差异无统计学意义(t=-0.532, P=0.597)。实验组治疗前后差异也无统计学意义(t=-0.625, P=0.523),见表 4。
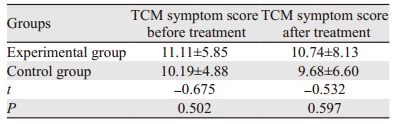 |
按照实体瘤的中医肿瘤疗效评定权重标准,对两组患者治疗后的疗效进行评价,对照组中医疗效评分为(50.89±6.47) ,实验组为(54.12±6.77),两组比较差异无统计学意义(t=0.334, P=0.742)。
2.6 主要不良反应指标比较两组患者均符合入组标准,治疗前两组血液学检查情况比较差异无统计学意义(P>0.05)。两组患者治疗期间在白细胞低值、血小板低值、血红蛋白低值、转氨酶高值以及肌酐高值上比较差异均无统计学意义(P>0.05),见表 5。
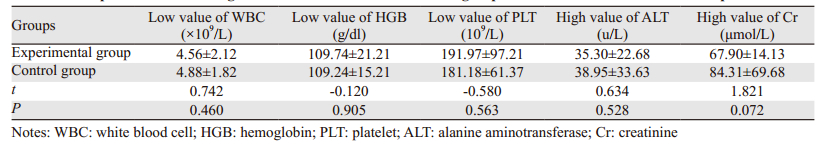 |
在肿瘤标志物检测方面,两组患者治疗前后CEA、CA125、SCC、 CYF211水平比较差异均无统计学意义(均P>0.05),见表 6~7。
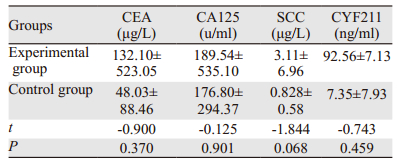 |
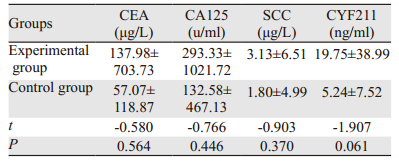 |
虽然目前肺癌研究领域无论从诊断技术还是治疗方式上都有了长足的进步,同步放化疗的应用和靶向药物的开发应用也使部分晚期肺癌患者的生存情况有了改善,患者的生存率得以不断提高,但是只限于有一定适应证或者特定分子亚型的患者等。
中晚期NSCLC患者多合并慢性病,手术切除概率已经很低,化疗是中晚期NSCLC治疗的主要手段。既往的多项临床研究显示,约40%左右的患者能够在一线治疗进展后接受二线治疗,20%左右的患者接受三线及后续的治疗[10]。一线治疗使1/3~2/5患者病情稳定,但2/3~3/4患者稳定后会进展,对ECOG评分0~2分的进展NSCLC患者行二线治疗可以延长生存期[11]。
以铂类为基础的化疗方案是NSCLC的主要治疗手段。Jiang等[5]进行了一项荟萃分析研究,研究中纳入了16项随机对照研究,比较不含铂的第三代化疗药物方案与含铂的第三代化疗药物方案对未接受过化疗的晚期NSCLC患者的治疗效果。分析研究显示,近期有效率上两种方案差异无统计学意义(RR=0.99, P=0.81),但在PFS方面,含铂方案优于非含铂方案(HR=1.06, P=0.03),说明含铂方案的治疗效果仍旧优于非含铂方案。研究表明[12],对于PS评分较差(PS=2)的患者,培美曲塞联合卡铂仍能获得生存及生活质量的优势。因此以铂类为基础的双药联合方案成为NSCLC的标准治疗方案。本研究中一线化疗方案就是选择铂类药物为基础的双药联合方案。
目前晚期NSCLC二线标准治疗为单药培美曲塞(非鳞癌患者)、多西他赛或厄洛替尼(针对EGFR突变阳性患者)[6]。然而由于晚期NSCLC患者常常因病情不允许或者其他原因导致肿瘤标本获取困难,或者考虑相关检测费用贵、费时等问题,临床中多数患者EGFR基因突变情况未知。本研究中,我们综合考虑,靶向治疗药物过于昂贵、且对EGFR突变者获益才更明显,而本研究中的患者接收基因突变检测的意愿比较低,因此本研究中晚期NSCLC二线治疗仍以单药化疗为主。
在患者较长的治疗周期中,化疗药物的毒性是影响治疗的重要因素。中医药联合西医治疗具有减轻化、放疗所致的不良反应和有利于化、放疗顺利进行的作用,并能一定程度上延长患者生存期。因此,在化疗的同时给予患者一定的积极的支持治疗是十分重要的。曹阳等[13]用夏枯草、白花蛇舌草、仙鹤草、天门冬、麦门冬、胆南星、五味子、枇杷叶、丹参、沙参等随证加减,治疗中晚期肺癌。虽然肿块控制效果较差,有效率低,但可以看到中医在延长生存时间、减轻症状、改善一般状况方面较放化疗还是有明显优势的。卢利员等[14]进行了自拟方益气养阴消积饮治疗NSCLC的研究。其中中药自拟方益气养阴消积饮,包括北沙参、麦冬、仙鹤草、莪术、干蟾皮、山海螺、太子参、八月札、百部、薏苡仁、瓜蒌皮、海藻、鱼腥草、生牡蛎,连续服3月。化疗采用的是NC(长春瑞滨+顺铂)方案或PC(泰素+顺铂)方案。92例NSCLC患者,分为中药+化疗组、单纯化疗组、单纯中药组,均治疗4周期。研究结果显示,在缩小实体瘤方面:化疗参与的两组缓解率均高于单纯中药组(均P<0.05),中药参与的两组稳定率均高于单纯化疗组(均P<0.05);有中药参与的两组治疗前后卡氏评分比较差异无统计学意义(P>0.05),单纯化疗组则明显下降(P<0.01);3组治疗后免疫功能指标均较治疗前明显上升(P<0.01),有中药参与的两组各项免疫功能指标均有明显优势(均P<0.01);此外,中药+化疗组出现Ⅲ期+Ⅳ期骨髓抑制比率明显低于单纯化疗组(P<0.05),中药显示出减毒增效的作用。说明中西医结合治疗NSCLC,从总体上看,比单纯化疗、单纯中药治疗有更多的优势。
中医治疗肿瘤是多因素共同作用的结果,与西医相比,虽然它缩小肿瘤效果弱,但不良反应小,症状改善明显,同时在提高生存质量和延长生存时间方面有明显优势。我们采用清肺合剂联合化疗对中晚期NSCLC患者进行治疗,试图进一步明确中西医结合治疗在肿瘤治疗中的作用,以便优化治疗方案,为更多患者服务。
本研究采用的清肺合剂,曾用名中肺合剂,1973年由我院开始研制,经三代中医师和中药师在临床实践过程中摸索并不断完善而开发出来,至今已经有40多年的历史。清肺合剂成品制剂为复方水提液,是由白花蛇舌草、重楼、仙鹤草、夏枯草、半枝莲等10味中药组方而成。该药以软坚散结、止咳化痰止痛为原则,以白花蛇舌草、重楼、半枝莲为主药,取其清热解毒、消肿止痛以抗癌;辅以有浙贝母清肺化痰、开郁散结、止咳平喘,天龙、夏枯草、龙葵消肿散结祛瘀,仙鹤草收敛止血、解毒抗癌并治素体虚损而固本。综合全方配伍严谨,群药相伍,共奏清热解毒、开郁化痰、止咳平喘、祛瘀散结之效[15-16]。基础研究表明清肺合剂对Lewis肺癌荷瘤小鼠肿瘤生长具有明显的抑制作用,而且对化疗有协同增效作用[17]。何福根等[18]发现清肺合剂具有显著的抑制肿瘤组织新生血管形成、抗肿瘤肺转移的作用,其机制可能与清肺合剂能降低肿瘤组织基质金属蛋白酶、血管内皮生长因子的表达水平,并降低肿瘤组织微血管密度有关。清肺合剂主要用于晚期肺癌的治疗和早、中期肺癌的辅助治疗,其疗效受到医生和患者的一致肯定[19]。
本研究中,采用单纯化疗和清肺合剂联合化疗进行比较性研究,经过4~6周期的治疗,实验组和对照组在有效率、疾病控制率等方面,两组之间比较差异均无统计学意义(P>0.05)。随访后的中位生存时间、1年、2年生存率比较,两组之间差异无统计学意义(P>0.05)。按照实体瘤的中医肿瘤疗效评定权重标准对两组患者治疗后的疗效进行评价,对照组和实验组间比较差异依然无统计学意义(t=0.334, P=0.742)。即本研究中没有观察到中西医结合治疗能提高患者的近远期疗效。
较多文献中都提到中医治疗或者中医联合化疗能够改善症状,但是我们观察到本研究中,实验组并没有明显改善患者咳嗽、咯血、胸闷胸痛、气急、发热以及乏力的临床症状;而且在中医症候评分上,治疗前后两组分别比较差异均无统计学意义。
此外,对不良反应如白细胞、血小板、血红蛋白、转氨酶以及肌酐水平变化的分析和肿瘤标志物CEA、CA125、SCC、CYF211水平的观察上,我们都没有看到两组差异有明显的统计学意义。很遗憾没有看到较多文献中报道的和我们所期望的中医治疗对中晚期NSCLC患者的增效减毒作用。其中可能的原因在于样本数量偏少,数据分析需要进一步完善,随访时间有待进一步延长,各个患者各个时期体质有变化,肺癌疾病发展中疾病特征不断变化等。这些都需要我们在之后的研究中不断改进,做更深入细致的研究。
虽然本研究得到的是阴性的结果,但是我们依然对中西医结合在肿瘤治疗中的应用充满着期待。由于原发耐药、继发耐药的存在,以及中晚期肺癌患者正气虚衰,单纯应用化疗效果不佳,疗效往往难以进一步提高。因此寻找新的、高效的、不良反应小的肿瘤治疗方法和药物成为肿瘤基础和临床研究的热点。对于晚期肺癌,中西医结合综合治疗及个性化治疗方法正逐渐被患者认同,患者依从性良好,临床上有部分患者已经从中西医结合治疗中获益。我们看到近年来很多医家采用中西医结合的方式治疗中晚期肺癌已经取得了可喜的结果[13, 20]。
国内外学者认识到抗肿瘤药物疗效,需结合症状改善,生存质量提高和生存期延长等指标综合评价才更为客观,而不应仅注重瘤体的缩小,这也正是中医药治疗肺癌的疗效特点[21-22]。我们将继续收集病例,深入研究,挖掘祖国传统医学的宝藏,造福肿瘤患者。
| [1] | Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, cancer incidence and mortality worldwide: IARC Cancer Base No. 11 [R/OL].(2013)[2015-11-30] http://globocan.iarc.fr. |
| [2] | He J, Chen WQ. Chinese cancer registry annual report 2012[M]. Beijing: Military Medical Science Press, 2012 . [赫捷, 陈万青. 2012中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2012 .] |
| [3] | Gerber DE, Dahlberg SE, Sandler AB, et al. Baseline tumour measurements predict survival in advanced non-small cell lung cancer[J]. Br J Cancer, 2013, 109 (6) : 1476–81. DOI:10.1038/bjc.2013.472 |
| [4] | Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J]. N Engl J Med, 2002, 346 (2) : 92–8. DOI:10.1056/NEJMoa011954 |
| [5] | Jiang J, Liang X, Zhou X, et al. Non-platinum doublets were as effective as platinum-based doublets for chemotherapy-naïve advanced non-small-cell lung cancer in the era of third-generation agents[J]. J Cancer Res Clin Oncol, 2013, 139 (1) : 25–38. DOI:10.1007/s00432-012-1294-z |
| [6] | Ma F, Shi XY, Meng W, et al. Treatment progress for EGFR wild-type advanced non-small cell lung cancer[J]. Zhongguo Fei Ai Za Zhi, 2014, 17 (7) : 575–80. [马峰, 史晓宇, 孟玮, 等. EGFR野生型晚期非小细胞肺癌的治疗进展[J]. 中国肺癌杂志,2014, 17 (7) : 575–80. ] |
| [7] | Liu B. Comparison of the cost of 4 kinds of second-line drug treatment regimes for non-small cell lung cancer[J]. Zhongguo Yao Fang, 2010, 21 (26) : 2403–6. [刘宝. 4种非小细胞肺癌二线药物治疗方案费用比较研究[J]. 中国药房,2010, 21 (26) : 2403–6. ] |
| [8] | Zheng XY. Guiding principle for clinical research of new traditional Chinese medicine[M]. Beijing: Chinese Medical Science and Technology Press, 2002 : 219 . [郑筱萸. 中药新药临床研究指导原则[M]. 北京: 中国医药科技出版社, 2002 : 219 .] |
| [9] | Jia YJ. Combination of traditional Chinese and western medicine of oncology[M]. Wuhan: Huazhong University of Science and Technology Press, 2009 . [贾英杰. 中西医结合肿瘤学[M]. 武汉: 华中科技大学出版社, 2009 .] |
| [10] | Girard N, Jacoulet P, Gainet M, et al. Third-line chemotherapy in advanced non-small cell lung cancer: identifying the candidates for routine practice[J]. J Thorac Oncol, 2009, 4 (12) : 1544–9. DOI:10.1097/JTO.0b013e3181bbf223 |
| [11] | Ning RL. Clinical observation of comparing pemetrexed with docetaxel as second-line treatment of non-small cell lung cancer[J]. Chongqing Yi Xue, 2013, 42 (3) : 292–6. [宁瑞玲. 培美曲赛对比多西他赛二线治疗非小细胞肺癌的临床观察[J]. 重庆医学,2013, 42 (3) : 292–6. ] |
| [12] | Socinski MA, Crowell R, Hensing TE, et al. Treatment of non small-cell lung cancer, stage IV: ACCP evidence-based clinical practice guidelines(2nd edition)[J]. Chest, 2007, 132 (3 Suppl) : 277S–89S. |
| [13] | Cao Y. TCM syndrome differentiation and treatment for 31 cases with advanced non-small cell lung cancer[J]. Beijing Zhong Yi Yao Da Xue Xue Bao, 2000, 23 (2) : 66. [曹阳. 辨证治疗晚期非小细胞肺癌31例[J]. 北京中医药大学学报,2000, 23 (2) : 66. ] |
| [14] | Lu LY, Huang B, Li YH, et al. Curative effect of Yiqi Yangyin Xiaoji Yin combining chemotherapy on advanced non-small cell lung cancer[J]. Beijing Zhong Yi Yao Da Xue Xue Bao, 2013, 36 (3) : 192–5. [卢利员, 黄斌, 李永浩, 等. 益气养阴消积饮结合化疗治疗晚期非小细胞肺癌的临床疗效观察[J]. 北京中医药大学学报,2013, 36 (3) : 192–5. ] |
| [15] | Hou GL, Zhang HY, Wang CL, et al. Preparation and clinical application of Qingfei Mixture[J]. Jiangxi Zhong Yi Yao, 2006, 2 (37) : 56–7. [侯桂兰, 章红燕, 王春雷, 等. 清肺合剂的制备及临床应用[J]. 江西中医药,2006, 2 (37) : 56–7. ] |
| [16] | Lu BZ, Lin NM, He XB, et al. An analysis on the application of Hedyotis diffusa in the antitumor treatment in our hospital[J]. Zhongguo Zhong Yao Za Zhi, 2006, 31 (18) : 1550–2. [芦柏震, 林能明, 何晓波, 等. 白花蛇舌草在我院抗肿瘤治疗中的应用分析[J]. 中国中药杂志,2006, 31 (18) : 1550–2. ] |
| [17] | Zhang HC. Experimental research on the anti-tumor and anti-metastasis effect of Qingfei Mixture[D]. Hangzhou: Zhejiang Chinese Medical University, 2010. [张会从. 清肺合剂抑瘤及抗转移实验研究[D]. 杭州: 浙江中医药大学, 2010.] |
| [18] | He FG, Lin NM, Han JM, et al. The effects of Zhongfei mixture on angiogenesis in tumor tissue from the mice bearing lewis lung carcinoma[J]. Zhonghua Zhong Yi Yao Xue Kan, 2010, 28 (2) : 355–7. [何福根, 林能明, 韩江敏, 等. 中肺合剂对Lewis肺癌小鼠肿瘤组织血管生成的影响[J]. 中华中医药学刊,2010, 28 (2) : 355–7. ] |
| [19] | Zhou JJ, Mao WM, Lu BZ. Retrospective analysis and presumption of Qing-fei Mixture[J]. Zhonghua Zhong Yi Yao Xue Kan, 2012, 30 (6) : 1299–301. [周佳佳, 毛伟敏, 芦柏震, 等. 清肺合剂研究的回顾与设想[J]. 中华中医药学刊,2012, 30 (6) : 1299–301. ] |
| [20] | Lin HS. Methods for the evaluation of efficacy of traditional Chinese medicine for the treatment of advanced lung cancer[J]. Zhongguo Zhong Liu, 2000, 9 (8) : 354. [林洪生. 中医治疗晚期肺癌的疗效评价方法[J]. 中国肿瘤,2000, 9 (8) : 354. ] |
| [21] | Jing XR, Liao H, Chen J. Clinical observation of Chinese medicine combined with chemotherapy in the treatment of advanced non-small cell lung cancer[J]. Shizhen Guo Yi Guo Yao, 2009, 20 (10) : 2619–21. [敬新蓉, 廖皓, 陈健. 中药配合化疗治疗晚期非小细胞肺癌临床观察[J]. 时珍国医国药,2009, 20 (10) : 2619–21. ] |
| [22] | Huang ZQ, Tian HQ, Chen XZ, et al. Influence of the Feiji Ricipe on existence quality and the immunity function in the patient with advanced NSCLC[J]. Liaoning Zhong Yi Za Zhi, 2010, 37 (9) : 1757–9. [黄志庆, 田华琴, 陈学彰, 等. 中药肺积方对晚期非小细胞肺癌患者生存质量和免疫功能的影响[J]. 辽宁中医杂志,2010, 37 (9) : 1757–9. ] |
 2016, Vol. 43
2016, Vol. 43


