文章信息
- 肺腺癌组织中MACC1和c-Met蛋白的表达及其与患者术后复发的关系
- Expressions of MACC1 and c-Met Proteins in Lung Adenocarcinoma and Their Correlation with Postoperative Recurrence
- 肿瘤防治研究, 2016, 43(7): 593-597
- Cancer Research on Prevention and Treatment, 2016, 43(7): 593-597
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.07.010
- 收稿日期: 2015-10-30
- 修回日期: 2016-01-05
肺癌是我国发病率及死亡率最高的肿瘤,其中腺癌约占44.5%[1]。尽管诊疗方式在提升,早期诊断率提高,然而肺癌的预后是不容乐观的,即使接受了完全性手术切除,患者5年生存率仅为50%[2]。Stein等[3]认为目前的临床和术后病理分期及相应的肿瘤标志物对评估患者复发转移风险的高低是不充分、不精确的。研究精确的预后评估指标已成为热门。结肠癌转移相关基因1(metastasis associated in colon cancer 1, MACC1)被认为是多种实体肿瘤预后的生物标志物,其表达高低与肿瘤的发生发展转移及生存期密切相关,是潜在的实体肿瘤的治疗靶点[3]。MACC1通过调节HGF-MET信号途径促进肿瘤侵袭性生长。c-Met蛋白是酪氨酸蛋白激酶家族成员,在多种恶性肿瘤中表达,与预后差存在相关性[4]。近期多项研究指出,MACC1与c-Met在恶性肿瘤中的表达呈正相关,高表达者较阴性患者无瘤生存期及总生存期明显缩短[5-9]。本研究通过检测肺腺癌组织中MACC1及c-Met的表达,探讨两者表达的相关性,及其与患者的分期、淋巴结转移、肿瘤T分期的关系,分析其与术后无复发时间的联系。
1 资料与方法 1.1 临床资料收集2011年7月至2013年7月在辽宁医学院附属第一医院胸外科行肺癌根治术的102例患者手术病理标本及57例癌旁正常组织,所有患者均病理证实为腺癌。其中男53例,女49例,年龄35~79岁,中位年龄61岁;根据最新术后病理分期,Ⅰ期62例、Ⅱ期16例、Ⅲ期24例(按照2010年AJCC/UICC制定的TNM分期);无淋巴转移患者67例,有淋巴结转移患者35例。33例(Ⅰ期6例,Ⅱ期9例,Ⅲ期18例)接受4~6周期铂类为基础的标准化疗,其中12例同时接受了局部放疗。随访从手术后病理确诊为腺癌开始,随访内容为患者肿瘤标志物的动态变化及影像学特点(头、胸部CT检查,必要时完善骨扫描等相关检查)。每2~4月跟踪随访1次,随访终点为肿瘤标志物检测、病理或影像学明确疾病复发进展。随访截至2015年8月。其中最短随访时间2月,最长48月。随访期间,1例失访,1例因与肺癌无关疾病死亡,8例患者随访结束未出现复发,4年无复发患者比例是8%。
1.2 免疫组织化学法检测c-Met蛋白及MACC1蛋白的表达手术标本行常规石蜡包埋,切片。行免疫组织化学检测c-Met蛋白和MACC1蛋白的表达水平。兔抗人c-Met多克隆抗体、SP免疫组织化学试剂盒及DAB显色试剂盒均购自北京博奥森生物技术有限公司。兔抗人MACC1单克隆抗体购自英国Abcam公司。阴性对照用PBS液代替一抗,阳性对照为已知阳性的肺腺癌组织切片。操作过程按SP免疫组织化学试剂盒说明书进行。由两位资历较高的病理医师采用双盲法观察每张切片。结果判定标准:c-Met阳性表达定位于细胞质和细胞膜,间质不着色。MACC1表达定位于细胞质和细胞核。在400倍光学显微镜下随机选择10个视野,每个视野连续计数100个细胞,分别进行肿瘤细胞染色强度和肿瘤阳性细胞百分率评分,最后表达以染色强度和阳性细胞率的得分之和进行判断。具体评分标准:无色记0分,淡黄色记1分,棕黄色记2分,棕褐色记3分;阳性细胞率≤10%记1分,>10%~50%记2分,>50%记3分。两者得分相加,以得分之和≥3分记为阳性表达。
1.3 统计学方法采用统计软件SPSS17.0进行数据分析,不同组间蛋白表达的比较采用χ2检验;c-Met蛋白和MACC1蛋白表达相关性采用Spearman秩相关性分析;生存分析采用Kaplan-Meier法,并进行Log rank检验;应用Cox回归模型对生存过程的可能影响因素进行分析。以P<0.05为差异有统计学意义,均为双侧检验。
2 结果 2.1 MACC1和c-Met蛋白的表达c-Met蛋白定位于细胞质和细胞膜,癌组织阳性表达率为54.90%(56/102),高于正常组织表达率10.53%(6/57)(χ2=30.269, P<0.001)。MACC1蛋白定位于细胞质和细胞核,在癌组织和癌旁组织阳性表达率分别为59.80%(61/102)、7.01%(4/57),差异有统计学意义(χ2=42.157, P<0.001),见图 1。
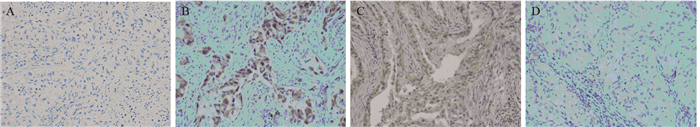
|
| A: negative expression of c-Met; B: positive expression of c-Met; C: positive expression of MACC1; D: negative expression of MACC1 图 1 c-Met和MACC1蛋白在肺腺癌组织中的表达(×200) Figure 1 c-Met和MACC1蛋白在肺腺癌组织中的表达(×200) |
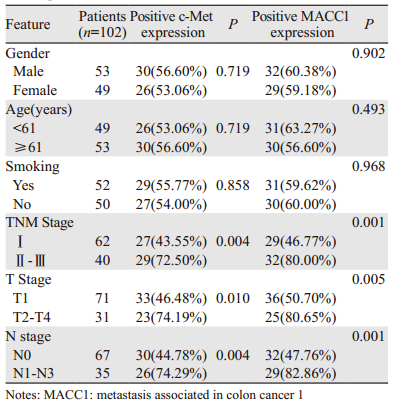
性别、年龄、吸烟与MACC1和c-Met的阳性表达无相关性(P>0.05)。MACC1蛋白在Ⅱ~Ⅲ期表达率高于Ⅰ期患者(72.50% vs. 43.55%,P=0.004),在T分期中T2~T4中的表达率高于T1期患者(P=0.010),淋巴结转移和未转移患者中表达率分别是74.29%、44.78%(P<0.05)。c-Met蛋白表达高低也与患者TNM分期、T分期、淋巴结转移密切相关,且差异有统计学意义(P<0.05),见表 1。
 |
在肺腺癌组织中MACC1和c-Met蛋白的表达呈正相关(r=0.262, P=0.008)。
2.4 肺腺癌组织中c-Met、MACC1蛋白表达与患者预后的关系Kaplan-Meier生存曲线显示,c-Met阳性组中位无病生存期(DFS)是15月,阴性组是34月,差异有统计学意义(P<0.001)。c-Met阳性表达2年内复发率为76.79%,明显高于阴性组的34.78%(χ2=18.272, P<0.05),见图 2A。MACC1阳性组和阴性组中位无病生存期分别是17月、34月(P<0.001)。MACC1表达2年内复发率阳性组与阴性组分别为73.77%、31.71%(χ2=17.686, P<0.05),见图 2B。提示c-Met、MACC1的表达是肺腺癌术后患者复发转移的危险因素。
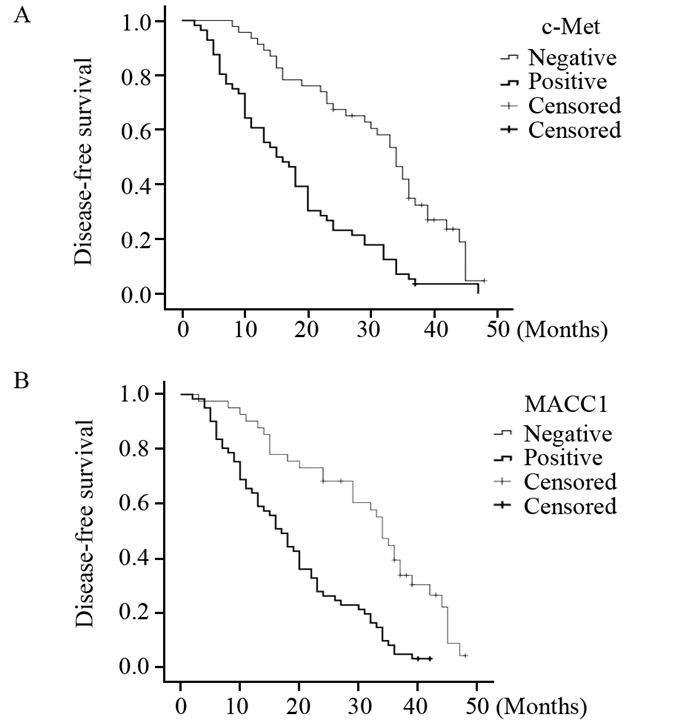
|
| 图 2 c-Met(A)和MACC1(B)蛋白阳性表达与阴性表达患者的无病生存期曲线 Figure 2 Disease-free survival curves of patients with positive and negative c-Met(A) and MACC1(B) expression |
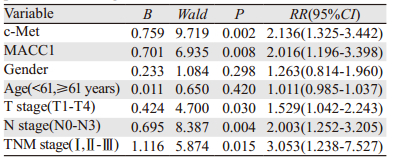
Cox多因素分析显示c-Met、MACC1蛋白表达影响患者的无病生存期(DFS),是肺腺癌术后患者复发转移的独立危险因素。此外,术后病理的TNM分期、肿瘤T分期、淋巴结转移情况影响着肿瘤患者的无病生存期,见表 2。
 |
肺腺癌是非小细胞肺癌的主要病理亚型,完全性切除术后预后仍不理想[2, 6]。如何准确评估术后患者的复发转移风险是目前医生面临的主要挑战。结肠癌转移相关基因MACC1位于7号染色体(7p21.1),是由Stein等[10]在结肠癌组织中发现的,进一步研究表明MACC1蛋白的表达是结肠癌复发转移的独立预后指标[11]。
Arlt等[11]研究发现MACC1在结肠癌组织中表达与结肠癌的浸润、转移及预后密切相关。MACC1低表达组5年生存率为80%,而高表达组仅为15%。Yang等[12]运用qRT-PCR和IHC检测MACC1在神经胶质瘤中的表达与临床预后的关系,发现在神经胶质瘤中MACC1高表达组预后差,总生存期明显缩短。其他多项研究显示MACC1的表达与多种实体肿瘤(如胃癌[13]、肝癌[5]、前列腺癌[14]等)的发生发展、转移及患者的生存密切相关,是一个潜在的抗癌及预防复发转移的治疗靶点[3, 5, 11-14]。
Shimokawa等[7]对146例Ⅰ期肺腺癌术后标本行qRT-PCR检测MACC1 mRNA的表达,并进行随访。结果提示术后复发与未复发患者表达率有显著性差异(69.2% vs. 39.9%,P=0.004),通过生存分析发现,MACC1的过表达与无病生存期密切相关(P=0.033)。Chundong等[15]进一步运用qRT-PCR和IHC检测MACC1 mRNA的表达和蛋白的表达,研究两者相关性及与预后的关系,结果显示两者的表达并没有明显相关性(r=0.115, P=0.109, 95%CI: -0.026~0.250)。但对预后价值的预测与Shimokawa的结果一致。本研究中MACC1蛋白检测结果显示术后复发患者的表达率高于未复发患者,阳性表达术后复发风险更大,可能是术后复发风险的预测因子。
c-Met是酪氨酸激酶受体(receptor tyrosine kinase)的一种,是由位于7号染色体7q21~q31上的原癌基因c-met编码的[16-17]。正常HGF/c-Met信号通路涉及胚胎发育、组织损伤修复等,正常细胞中c-Met mRNA低水平表达,仅在组织损伤后短暂上升,随即又恢复正常水平。相反,肿瘤细胞中存在c-Met的过表达,例如在结肠癌、胃癌、肝癌、非小细胞肺癌等细胞中均观察到c-Met的高表达,且c-Met的过度表达和多种肿瘤的预后密切相关[18]。在肺癌中,c-Met的表达率为40%~60%[19],4%的肺癌中发现c-met基因扩增,而基因扩增是EGFR获得性耐药的一个机制。目前,以c-Met为靶点的靶向治疗已在肺癌尤其在非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗中显现出其重要意义[20]。
Park等[8]对380例非小细胞肺癌患者术后标本行IHC检测,并对患者随访,发现c-Met阳性表达率为13.7%,表达率较其他研究[20]偏低,可能与样本早期患者比例较大及病理类型主要是鳞癌有关。高表达与患者无病生存期(P=0.010)和总生存期差相关(P=0.056)。多因素分析显示c-Met阳性表达死亡风险高(HR=1.618, 95%CI: 1.066~2.456, P=0.024)。
在本研究中,c-Met在肺腺癌组织中表达率是54.90%,与Lv等[19]报道一致。统计分析显示c-Met在腺癌中的表达与术后病理分期、肿瘤T分期、淋巴结转移相关。通过Kaplan-Meier单因素生存分析发现,c-Met高表达者无瘤生存期更短。MACC1和c-Met基因都位于7号染色体上[10, 18],MACC1蛋白主要通过作用于c-Met启动序列的SP1位点,上调c-Met的表达,增强HGF/c-Met信号途径的级联放大作用[21],导致一系列恶性变化,包括增殖、侵袭和血管形成[22]。
Kawamura等[9]通过qRT-PCR和IHC检测直肠癌术后标本中MACC1和c-Met基因的表达情况,发现其呈正相关(r=0.64, P<0.0001),且MACC1或MET高表达与无病生存期降低和预后差有关。本研究中发现c-Met和MACC1蛋白在肺腺癌中的表达也呈正相关,且与预后差有关。
综上所述,目前肺腺癌完全性切除后复发风险的评估正在研究中,过去临床分期、肿瘤T分期、淋巴结转移情况、分化程度并不能准确评估复发风险。MACC1和c-Met蛋白在多种恶性肿瘤中表达高于正常组织,且高表达者复发率高,总生存期短。本文研究了在肺腺癌中两种蛋白表达的情况与临床病理特征及预后的关系,得到了与其他研究相一致的结论,提示通过术后病理MACC1和c-Met蛋白的检测,可能对预后情况作出更加准确的评估,对治疗计划有一个更好的指导作用。此外,抑制MACC1的表达或许能够延长复发时间,提高总生存期。
| [1] | Li XX, Wang MJ, Gao J, et al. Retrospective analysis of clinical pathology characteristic in patients with lung neoplasms[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2012, 19 (2) : 130–3. [李学祥, 王慜杰, 高佳, 等. 肺肿瘤患者临床病理特征回顾性分析[J]. 中华肿瘤防治杂志,2012, 19 (2) : 130–3. ] |
| [2] | Goya T, Asamura H, Yoshimura H, et al. Prognosis of 6644 resected non-small cell lung cancers in Japan:a Japanese lung cancer registry study[J]. Lung Cancer, 2005, 50 (2) : 227–34. DOI:10.1016/j.lungcan.2005.05.021 |
| [3] | Stein U. MACC1-a novel target for solid cancers[J]. Expert Opin Ther Targets, 2013, 17 (9) : 1039–52. |
| [4] | Gumustekin M, Kargi A, Bulut G, et al. HGF/c-Met overexpression, but not met mution, correlates with progression of non-small cell lung cancer[J]. Pathol Oncol Res, 2012, 18 (2) : 209–18. DOI:10.1007/s12253-011-9430-7 |
| [5] | Qiu J, Huang P, Liu Q, et al. Identification of MACC1 as a novel prognostic marker in hepatocellular carcinoma[J]. J Transl Med, 2011, 9 : 166. DOI:10.1186/1479-5876-9-166 |
| [6] | Fan X, Zhang X, Wang H, et al. Reevaluation of survival and prognostic factors in pathologic stage adenocarcinoma by the new 2009 TNM classification[J]. Tumor Biol, 2014, 35 (6) : 5905–10. DOI:10.1007/s13277-014-1781-8 |
| [7] | Shimokawa H, Uramoto H, Onitsuka T, et al. Overexpression of MACC1 mRNA in lung adenocarcinoma is associated with postoperative recurrence[J]. J Thorac Cardiovasc Surg, 2011, 141 (4) : 895–8. DOI:10.1016/j.jtcvs.2010.09.044 |
| [8] | Park S, Choi YL, Sung CO, et al. High MET copy number and MET overexpression: poor outcome in non-small cell lung cancer patients[J]. Histol Histopathol, 2012, 27 (2) : 197–207. |
| [9] | Kawamura M, Saigusa S, Toiyama Y, et al. Correlation of MACC1 and MET expression in rectal cancer after neoadjuvant chemoradiotherapy[J]. Anticancer Res, 2012, 32 (4) : 1527–31. |
| [10] | Stein U, Walther W, Arh F, et al. MACC1, a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis[J]. Nat Med, 2009, 15 (1) : 59–67. DOI:10.1038/nm.1889 |
| [11] | Arlt F, Stein U. Colon cancer metastasis:MACC1 and Met as metastasis pacemakers[J]. Int J Biochem Cell Biol, 2009, 41 (12) : 2356–9. DOI:10.1016/j.biocel.2009.08.001 |
| [12] | Yang T, Kong B, Kuang YQ, et al. Overexpression of MACC1 protein and its clinical implications in patients with glioma[J]. Tumor Biol, 2014, 35 (1) : 815–9. DOI:10.1007/s13277-013-1112-5 |
| [13] | Yao JB, Duan YX, Zhang YB, et al. Expression and clinical implications of MACC1 in gastric cancer tissue[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2013, 20 (6) : 444–7. [姚继彬, 段耀星, 张永斌, 等. 胃癌组织MACC1表达及其临床意义分析[J]. 中华肿瘤防治杂志,2013, 20 (6) : 444–7. ] |
| [14] | He B, Wu CL, Hu HL, et al. Expressions of MACC1 and c-Met genes in prostate cancer tissues[J]. Tianjin Yi Yao, 2015, 43 (2) : 175–8. [何彬, 吴长利, 胡海龙, 等. MACC1及c-Met在前列腺癌组织中的表达[J]. 天津医药,2015, 43 (2) : 175–8. ] |
| [15] | Chundong G, Uramoto H, Onitsuka T, et al. Molecular diagnosis of MACC1 status in lung adenocarcinoma by immunohistochemical analysis[J]. Anticancer Res, 2011, 31 (4) : 1141–5. |
| [16] | Cecchi F, Rabe DC, Bottaro DP. Targeting the HGF/Met signaling pathway in cancer therapy[J]. Expert Opin Ther Targets, 2012, 16 (6) : 553–72. DOI:10.1517/14728222.2012.680957 |
| [17] | Corso S, Comoglio PM, Giordano S. Cancer therapy :can the challenge be MET[J]. Trends Mol Med, 2005, 11 (6) : 284–92. DOI:10.1016/j.molmed.2005.04.005 |
| [18] | Sgambato A, Casaluce F, Maione P, et al. The c-Met inhibitors : a new class of drugs in the battle against advanced nonsmall-cell lung cancer[J]. Curr Pharm Des, 2012, 18 (37) : 6155–68. DOI:10.2174/138161212803582478 |
| [19] | Lv H, Shan B, Tian Z, et al. Soluble c-Met is reliable and sensitive marker to detect c-Met expression level in lung cancer[J]. Biomed Res Int, 2015, 2015 : 626578. |
| [20] | Landi L, Minuti G, D’Incecco A, et al. Targeting c-MET in the battle against advanced non-small cell lung cancer[J]. Curr Opin Oncol, 2013, 25 (2) : 130–6. DOI:10.1097/CCO.0b013e32835daf37 |
| [21] | Boardman LA. Overexpression of MACC1 leads to downstream activation metastasis and recurrence of colorectal cancer[J]. Genome Med, 2009, 1 (4) : 36. |
| [22] | Huh CG, Factor VM, Sánchez A, et al. Hepatocyte growth factor/c-met signaling pathway is required for efficient liver regeneration and repair[J]. Proc Natl Acad Sci U S A, 2004, 101 (13) : 4477–82. DOI:10.1073/pnas.0306068101 |
 2016, Vol. 43
2016, Vol. 43


