文章信息
- 血管内皮钙黏蛋白对非小细胞肺癌侵袭转移的影响及其作用机制
- Effect of Vascular Endothelial Cadherin on Invasion and Metastasis of Non-small Cell Lung Cancer Cells and Related Mechanism
- 肿瘤防治研究, 2016, 43(7): 586-592
- Cancer Research on Prevention and Treatment, 2016, 43(7): 586-592
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.07.009
- 收稿日期: 2015-08-31
- 修回日期: 2016-02-01
2. 404000 重庆,重庆三峡中心医院呼吸内科
2. Department of Respiratory Medicine, Chongqing Three Gorges Central Hospital, Chongqing 404000, China
肺癌是世界范围内发病率最高的恶性肿瘤之一,在肿瘤相关死亡原因中居首位[1-2]。约30%的肺癌患者在诊断时已有远处转移,50%~60%的患者在治疗过程中发生远处转移,80%~90%的患者死亡是由转移引起[3]。肺癌转移是多因素参与、多步骤演化的复杂过程,导致肺癌转移的分子机制尚未完全阐明。因此,早期发现新的肺癌转移相关分子标志物是当前提高肺癌患者生存率和生活质量的迫切要求,对临床提供新的诊断及预后判断指标、早期确定肺癌的分级、分期具有重要意义。
VE-cadherin是钙黏蛋白家族成员之一,是特异性表达在血管内皮细胞的跨膜糖蛋白,介导Ca2+依赖的同型细胞间黏附[4]。VE-cadherin维持和控制内皮细胞间的连接,其介导的内皮间黏附对调节内皮细胞通透性、白细胞游走具有重要作用;而且可通过不同信号通路调节内皮细胞的增殖、凋亡、血管内皮生长因子受体(VEGFR)的功能[5]。近年研究发现,VE-cadherin在乳腺癌、骨肉瘤、高侵袭性黑色素瘤等肿瘤细胞中也有表达,并可通过TGF-β信号通路促进乳腺癌进展[6-8]。但目前关于VE-cadherin对肺癌侵袭转移影响的报道甚少。本实验通过观察VE-cadherin在NSCLC组织中的表达,调控VE-cadherin活性,观察VE-cadherin对NSCLC细胞侵袭迁移的影响,以期探讨VE-cadherin在肺癌转移过程中的作用及其分子机制。
1 资料与方法 1.1 临床资料收集2009年1月—2010年1月间在重庆医科大学附属第一医院行手术治疗的NSCLC肺癌患者97例,男61例、女36例,年龄37~85岁,平均年龄61岁。鳞癌53例、腺癌44例,高中度分化58例、低度分化39例,T1期39例、T2期及以上58例,有淋巴结转移者57例、无淋巴结转移者40例。患者术前均未行介入、化疗、放疗等治疗。另取97例癌旁正常肺组织作对照。
1.1.1 免疫组织化学法检测采用免疫组织化学SP二步染色法,进行VE-cadherin蛋白检测。VE-cadherin蛋白阳性细胞表现为胞质有棕黄色颗粒。在阳性细胞显示区域,每例计数至少100个肿瘤细胞,阳性细胞无染色为0分,弱染色为1分,强染色为2分;用阳性细胞染色强度得分乘以阳性细胞所占百分比,所得数值>20分可判定为阳性表达。
1.1.2 RT-PCR法检测按照TRIzol Kit(日本TaKaRa公司)说明书要求,提取人NSCLC组织总RNA,紫外分光光度计测其浓度及纯度,用反转录试剂盒(日本TaKaRa公司)将总RNA反转录为cDNA。引物购自上海生工。反应条件:37℃ 15 min,85℃ 5s。接着PCR扩增,反应条件:94℃ 5 min,94℃ 30 s,60℃ 15 s,72℃ 30 s;扩增30个循环。扩增结束后,PCR产物通过2%琼脂糖凝胶电泳,EB染色,采用凝胶图像分析系统,对电泳条带进行密度扫描。GAPDH作为内参照。VE-cadherin相对表达量=(VE-cadherin灰度值-背景灰度值)/(GAPDH灰度值-背景灰度值)。引物序列见表 1。
NSCLC细胞株PG、NCI-H460、A549及脐静脉内皮细胞HUVEC均获赠自重庆医科大学生命研究院。胰蛋白酶、胎牛血清、RPMI 1640培养液、青霉素、链霉素均为美国Hyclone公司产品;小鼠抗人VE-cadherin多克隆抗体、兔抗人P120ctn单克隆抗体购自英国Abcam公司;兔IgG、小鼠抗人β-actin单克隆抗体、HRP标记山羊抗小鼠二抗、HRP标记山羊抗兔二抗、ECL发光试剂盒、FITC标记山羊抗小鼠二抗、TRITC标记山羊抗兔二抗等均购自中国碧云天公司,Protein A/G PLUS-Agarose购自美国Santa公司;Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司;转染试剂Lipofectamine RNAi MAX Reagent购自美国Invitrogen公司。
1.2.1 细胞培养及VE-cadherin siRNA转染PG、NCI-H460、A549细胞用含10%FBS RPMI 1640培养液置于5%CO2,恒湿37℃培养箱。采用RNAi MAX脂质体转染反转录法,实验分为空白对照组、干扰组和阴性对照组,各组细胞均加500 μl Optimem培养液、5 μl RNAi MAX,干扰组细胞另加入1.5 μl VE-cadherin siRNA,阴性对照组细胞另加入1.5 μl NC-siRNA,混匀,室温静置20 min,每孔加入2×104细胞于6孔板,6 h后更换为完全培养液,继续培养至48 h,提取细胞总蛋白。
1.2.2 Western blot法检测收集细胞后,加入RIPA裂解液及蛋白酶抑制剂PMSF,冰上静置30 min。4℃、12 000 r/min离心10 min,将上清液移至一支新的EP管中,BCA法测定蛋白浓度,沸水煮5 min后上样,采用8%SDS-PAGE电泳,先用60 V电泳30 min左右至跑到分离胶处,再改为80 V电泳1.5 h左右,直至溴酚蓝跑至底部。做好“三明治”夹板,250 mA恒流转膜1.5 h,5%脱脂牛奶37℃孵育2 h,加入小鼠抗人VE-cadherin多克隆抗体(浓度均为1:1 000),4℃孵育过夜,次日TBST洗膜3次,HRP标记山羊抗小鼠二抗(浓度均为1:1 000),37℃孵育1.5 h,TBST洗膜3次。ECL化学发光试剂孵育1 min,于凝胶图像分析仪显影拍照分析。β-actin为内参照。
1.2.3 免疫共沉淀收集细胞后,加入RIPA裂解液及PMSF,冰上静置30 min。4℃、12 000 r/min离心10 min,将上清液移至一支新的EP管中。取0.5 ml上清液,加入1 μl普通兔IgG和20 μl充分重悬的Protein A/G PLUS-Agarose,4℃缓慢晃动30 min,4℃低温离心机2 500 r/min离心5 min,立即将上清液转移到另一支预冷EP管中。BCA法测定上清液浓度,用预冷PBS将上清液中蛋白浓度稀释到约1 mg/ml,按稀释比例将兔抗人P120ctn单克隆抗体加入到0.5 ml蛋白上清液中,4℃缓慢晃动过夜。将20 μl充分重悬的Protein A/G PLUS-Agarose加入到蛋白上清液中,4℃缓慢晃动2 h,4℃低温离心机2 500 r/min离心5 min,预冷PBS洗涤3次,1×loading buffer重悬蛋白样品,沸水煮5 min游离抗原、抗体、珠子,4℃低温离心机2 500 r/min离心5 min,将上清液电泳。Western blot蛋白定量检测。
1.2.4 免疫荧光染色法检测VE-cadherin、P120ctn将NCI-H460细胞以1×108/L密度接种于24孔板中预置的盖玻片上,待细胞贴壁后取出盖玻片,4%多聚甲醛固定20 min,0.2% Triton X-100透膜1 min;用5%BSA封闭30 min,加入小鼠抗人VE-cadherin多克隆抗体、兔抗人P120ctn单克隆抗体(浓度均为1:50),4℃孵育过夜,FITC标记山羊抗小鼠二抗、TRITC标记山羊抗兔二抗(浓度均为1: 200),37℃下避光孵育1.5 h,PBS冲洗3次后加DAPI染色液,室温作用5 min,缓冲甘油封片,荧光显微镜下观察并拍照。
1.2.5 Transwell实验侵袭实验: Matrigel:无血清RPMI 1640稀释比例为1:8,每个Transwell上室加入60 μl、37℃培养箱过夜。24孔板每孔加入100 μl无血清RPMI1640培养液,将Transwell小室基底膜浸润,37℃、30 min;将NCI-H460细胞分为3组:空白对照组、阴性对照组和干扰组,每组设3个复孔。各组细胞用0.25% 胰酶消化后,用无血清RPMI 1640培养液重悬为1×108/L。每个Transwell上室加入0.1 ml细胞悬液(约1×104细胞),下室加入0.6 ml含15%胎牛血清的RPMI 1640培养液,37℃、5%CO2培养箱中培养24 h后,取出小室并弃去上室液体,用棉签擦去膜上层细胞,4%多聚甲醛液固定15 min,结晶紫染色20 min,于倒置相差显微镜下计数膜下层的细胞。200倍光学显微镜随机选择10个视野计数,计算平均值。迁移实验不需要Matrigel胶包被基底膜,余同侵袭实验。
1.3 统计学方法采用GraphPad Prism 5.0统计软件进行分析。实验数据以均数±标准差(x±s)表示,两组间均数比较采用t检验;多组均数间比较采用单因素方差分析,各组间率的比较用χ2检验,Fisher精确检验,以P<0.05为差异有统计学意义。
2 结果 2.1 免疫组织化学及RT-PCR检测VE-cadherin在NSCLC组织及癌旁组织中的表达免疫组织化学结果显示在NSCLC组织中,VE-cadherin阳性表达率为51.5%(50/97),阳性蛋白定位于细胞膜及细胞质,癌旁正常肺组织未见VE-cadherin阳性表达,两者比较差异有统计学意义(P=0.000),见图 1A。VE-cadherin在性别、年龄、组织类型、组织学分级各组之间阳性表达率差异均无统计学意义(P>0.05);在41例有吸烟史分组中有30例阳性表达,与无吸烟史分组相比差异有统计学意义(P<0.05);在40例有淋巴结转移分组中有27例阳性表达,与无淋巴结转移分组相比差异有统计学意义(P<0.05),见表 2。RT-PCR结果亦显示与癌旁正常组织相比,NSCLC组织的VE-cadherin表达量增高,条带灰度增强(P=0.0097),见图 1B。

|
| A: immunohistochemical staining of VE-cadherin in NSCLC tissues and adjacent non-tumor tissues; Control: Adjacent tissues; ANTT: adjacent nontumor tissues; SCC: squamous cell carcinoma; ADC: adenocarcinoma; B: VE-cadherin mRNA expression in NSCLC tissues and non-tumor tissues. N: adjacent tissues; T: NSCLC tissues 图 1 人NSCLC组织及癌旁组织VE-cadherin表达情况 Figure 1 VE-cadherin expression in NSCLC and adjacent tissues |
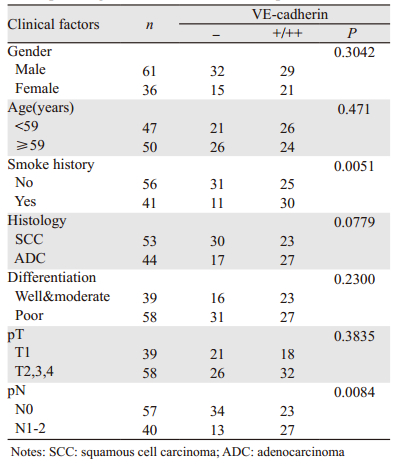 |
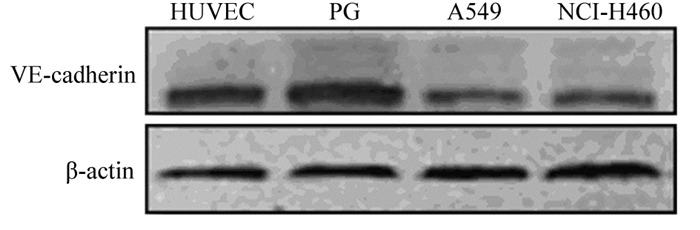
脐静脉内皮细胞作为阳性对照,Western blot结果显示:VE-cadherin在三种不同的NSCLC细胞株中均有表达,且表达水平有差异,其在三种细胞株中表达强度依次为PG、NCI-H460和A549细胞,见图 2。三种NSCLC细胞株中,NCI-H460细胞VE-cadherin表达水平适中,用来进行后续实验。
|
| 图 2 VE-cadherin在不同NSCLC细胞株中的表达情况 Figure 2 VE-cadherin expression in different NSCLC cell lines |
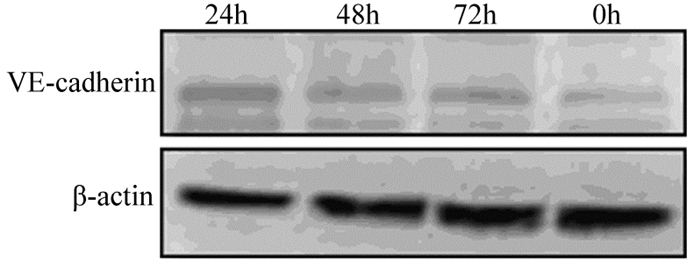
NCI-H460细胞暴露于2%氧浓度下不同时间,Western blot检测VE-cadherin表达情况。结果显示:低氧暴露24 h组,VE-cadherin表达水平明显增高。相较于暴露24 h组,暴露48 h组、72 h组,VE-cadherin表达水平有所下降,见图 3。
|
| 图 3 低氧对NCI-H460细胞VE-cadherin表达的影响 Figure 3 Effects of hypoxia on VE-cadherin expression in NCI-H460 cells |
Western blot结果显示:与空白及阴性对照组相比,干扰组VE-cadherin表达明显降低。Transwell小室侵袭和迁移实验结果表明:空白对照组与阴性对照组相比,侵袭和迁移细胞数目差异均无统计学意义(P>0.05);与空白对照组相比,干扰组侵袭(P=0.0001)和迁移(P=0.0016)细胞数目明显减少,差异有统计学意义,见图 4。

|
| A: VE-cadherin expression in NCI-H460 cells transfected with siRNAs targeting VE-cadherin after 48 hours; B: effects of stable suppression VEcadherin on the invasion and migration abilities of NCI-H460 cells 图 4 沉默VE-cadherin对NCI-H460细胞侵袭迁移能力的影响 Figure 4 Impact of silencing VE-cadherin on invasion and migration abilities of NCI-H460 cells |
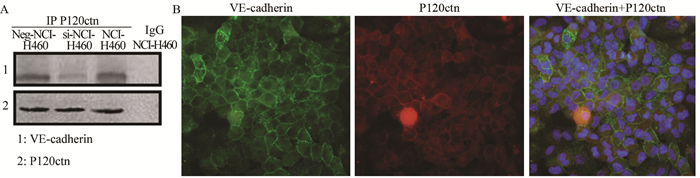
细胞免疫荧光结果显示:VE-cadherin主要在NCI-H460细胞膜及细胞质聚集表达,而在细胞膜上相同位置,P120ctn出现强信号;与此同时,免疫共沉淀技术发现:在NCI-H460细胞中VE-cadherin与P120ctn存在结构上的连接,见图 5。
|
| A: interacts of VE-cadherin and P120 catenin in NCI-H460 cell line detected by immunoprecipitation; B: interacts of VE-cadherin and P120 catenin in NCI-H460 cell line detected by immunofluorescence co-localization 图 5 VE-cadherin与P120ctn在NCI-H460细胞结构上的连接 Figure 5 Interacts of VE-cadherin and P120ctn in NCI-H460 cell line |
肿瘤转移是多因素参与的、多步骤的、复杂的、连续的、动态的过程,肺癌也是如此,其过程包括肿瘤细胞骨架重排、变形,从原发肿瘤脱落;脱落的肿瘤细胞与细胞外基质的黏附并降解细胞外基质;肿瘤细胞移动、侵入血管和淋巴管进入循环系统,与血小板相互作用绞结成簇,并与靶点处内皮细胞黏附,进而穿出血管壁;肿瘤细胞增殖,局部血管生成,形成转移灶,之后再次转移,形成恶性循环[9]。
正常情况下,VE-cadherin表达于血管内皮细胞,然而Hendrix等发现在高侵袭性黑色素瘤细胞中有VE-cadherin的表达,而低侵袭性黑色素瘤则无[8]。本研究发现NSCLC组织中VE-cadherin表达高于癌旁正常组织,在高侵袭性人肺癌细胞系PG细胞中VE-cadherin高表达,同时在低侵袭性人肺癌细胞系A549细胞中检测到低水平VE-cadherin表达,与上述研究结果不完全一致。
本研究免疫组织化学结果显示:与非吸烟NSCLC患者相比,吸烟患者VE-cadherin阳性表达上调。Naik等发现将人脑微血管内皮细胞hCMEC/D3烟草提取物暴露可致VE-cadherin的表达明显增加[10],与本研究结果相一致。吸烟时气道所接触的CO浓度达74.04 mg/m2,CO与血红蛋白结合能力比O2大200~300倍,其血中HbCO浓度相当于健康者的11倍,且HbCO解离速度非常缓慢,红细胞携氧能力下降引起吸烟者长期慢性缺氧[11]。体内实验发现将A549细胞及BEAS2B等气道上皮细胞暴露于烟草提取物后,缺氧诱导因子1α(HIF-1α)应答基因碳酸酐酶9(CA9)的mRNA表达水平明显上调,shRNA干扰HIF-1α后CA9表达水平下降;体外研究证实将小鼠暴露于烟雾环境中6月后,其肺组织中CA9 mRNA表达水平明显增高,体内外实验均提示吸烟可通过HIF-1α引起机体缺氧信号的活化[12]。缺氧条件下HIF-1α、HIF-2α与VE-cadherin启动子相结合,促进恶性胶质瘤细胞及食管癌细胞VE-cadherin的表达[13-14];本研究也发现缺氧可诱导NCI-H460细胞VE-cadherin表达增加。因此长期吸烟可致机体内缺氧信号活化,HIF转录增强,从而使吸烟NSCLC患者VE-cadherin阳性表达上调。
肿瘤细胞生长迅速、繁殖能力强、新陈代谢旺盛,对能量需求高,因此随着肿瘤体积的不断增大,许多恶性肿瘤组织中存在缺氧状态,而缺氧是多种实质性肿瘤中心微环境的特征之一。HIF-1α的表达受氧浓度的调控,其高表达常与肿瘤转移和不良临床预后有关。局部急性持续的缺氧微环境能够增强HIF的转录和肿瘤细胞的转移潜能,筛选出侵袭性和生存能力更强的恶性肿瘤细胞。肿瘤转移有赖于血管形成,血管化程度越高,肿瘤细胞进入循环系统可能性越大,转移的概率越高。缺氧微环境下为满足肿瘤组织能量及氧气需求,多种恶性肿瘤形成另一种独特的血管生成方式—血管生成拟态(vasculogenic mimicry,VM),即肿瘤细胞通过自身变形并与细胞外基质相互作用,形成一种模拟血管壁结构的、可输送血液的管道系统,从而重塑肿瘤微循环,使肿瘤获得血液供应,由Maniotis和Folberg在对人眼葡萄膜黑色素瘤微循环的研究中发现并于1999年首次提出[15]。VE-cadherin是VM的重要分子标志物之一,下调VE-cadherin的表达会抑制高侵袭性黑色素瘤细胞VM的形成[8]。除此之外,也有越来越多的证据表明VE-cadherin是Twist1、螺旋环螺旋 DNA结合抑制因子-2、β-半乳糖苷结合蛋白等众多VM调控因子的靶分子,其在VM形成过程中发挥重要作用[16-18]。本研究发现VE-cadherin表达与NSCLC淋巴结转移有关,因此我们猜测拟态血管可能与淋巴管道之间存在交通联系。近些年来,随着对淋巴管生长因子及其受体、淋巴管内皮细胞特异性标志物的发现及研究的不断深入,肿瘤组织内及瘤周存在大量新生的淋巴管已被一些研究证实,且肿瘤相关淋巴管生成在介导肿瘤区域淋巴结转移过程中发挥重要作用[19]。肿瘤细胞可通过自身运动经微血管或直接进入瘤内或瘤周淋巴管,进入淋巴循环,发生前哨淋巴结转移,并经右锁骨下静脉和胸导管进入血循环,随血流转移至远处器官[20]。肿瘤内部的拟态血管可与肿瘤边缘长入的静脉相连[21],从而为肿瘤组织提供氧及营养物质。血循环和淋巴循环在肿瘤播散过程中紧密相连,缺一不可,两者协同作用促进肿瘤侵袭转移。上述研究为我们的猜测提供了理论依据,但鉴于目前VM及肿瘤新生淋巴管的研究尚不成熟,VM与淋巴管道之间是否存在直接联系尚需下一步研究证实。
Fry等发现乳腺癌诊断后5年内,有复发、远处转移患者血清中VE-钙黏蛋白水平显著高于无复发转移患者,其在鉴别乳腺癌患者有、无复发转移的特异性可达90%,是乳腺癌转移的新的生物标志物[22];用VE-cadherin的抗体阻断其介导的同嗜黏附作用,可以抑制人A431上皮癌细胞和裸鼠皮下种植的Lewis肺癌细胞的生长和转移[23],提示VE-cadherin与肿瘤转移关系密切。本研究发现siRNA技术干扰VE-cadherin表达可降低NCI-H460细胞侵袭迁移能力,进一步证实VE-cadherin可能在NSCLC侵袭转移过程中发挥重要作用。
VE-cadherin与P120ctn在NCI-H460细胞中存在结构上的连接。P120ctn是连环蛋白家族的重要成员,参与调节肿瘤细胞增殖、黏附,并与肿瘤细胞分化、侵袭转移密切相关[24],其扮演着“变阻器”分子角色,与E-cadherin结合抑制细胞的运动能力,与非上皮性钙黏蛋白结合促进细胞的转移、侵袭[25]。因此VE-cadherin可能通过介导P120ctn影响NSCLC侵袭、转移。
综上所述:体内研究发现VE-cadherin在NSCLC癌组织中过表达,且高表达的VE-cadherin与非小细胞肺癌吸烟史及淋巴结转移有关,可能系吸烟肺癌患者癌组织内缺氧信号活化及VM形成使得VE-cadherin在肺癌侵袭转移过程中发挥作用所致;同时体外研究证实VE-cadherin可通过介导P120ctn促进肺癌侵袭迁移。因此,抑制VE-cadherin可抑制非小细胞肺癌侵袭转移,VE-cadherin有望成为非小细胞肺癌靶向治疗的新靶点。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64 (1) : 9–29. DOI:10.3322/caac.21208 |
| [2] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2) : 69–90. DOI:10.3322/caac.v61:2 |
| [3] | Liu HY, Chen J. Advance on lung cancer metastasis[J]. Zhongguo Fei Ai Za Zhi, 2008, 11 (1) : 40–2. [刘红雨, 陈军. 肺癌转移进展[J]. 中国肺癌杂志,2008, 11 (1) : 40–2. ] |
| [4] | Gavard J. Endothelial permeability and VE-cadherin: a wacky comradeship[J]. Cell Adh Migr, 2014, 8 (2) : 158–64. DOI:10.4161/cam.29026 |
| [5] | Dejana E, Vestweber D. The role of VE-cadherin in vascular morphogenesis and permeability control[J]. Prog Mol Biol Transl Sci, 2013, 116 : 119–44. DOI:10.1016/B978-0-12-394311-8.00006-6 |
| [6] | Zhang LZ, Mei J, Qian ZK, et al. The role of VE-cadherin in osteosarcoma cells[J]. Pathol Oncol Res, 2010, 16 (1) : 111–7. DOI:10.1007/s12253-009-9198-1 |
| [7] | Breier G, Grosser M, Rezaei M. Endothelial cadherins in cancer[J]. Cell Tissue Res, 2014, 355 (3) : 523–7. DOI:10.1007/s00441-014-1851-7 |
| [8] | Hendrix MJ, Seftor EA, Meltzer PS, et al. Expression and functional significance of VE-cadherin in aggressive human melanoma cells: role in vasculogenic mimicry[J]. Proc Natl Acad Sci U S A, 2001, 98 (14) : 8018–23. DOI:10.1073/pnas.131209798 |
| [9] | Zuo YH, Shi X. Update of the metastatic mechanisms of malignant tumors[J]. Yi Xue Yan Jiu Sheng Xue Bao, 2008, 21 (3) : 293–6. [左衍海, 施鑫. 恶性肿瘤转移机制研究新进展[J]. 医学研究生学报,2008, 21 (3) : 293–6. ] |
| [10] | Naik P, Fofaria N, Prasad S, et al. Oxidative and pro-inflammatory impact of regular and denicotinized cigarettes on blood brain barrier endothelial cells: is smoking reduced or nicotine-free products really safe?[J]. BMC Neurosci, 2014, 15 : 51. DOI:10.1186/1471-2202-15-51 |
| [11] | Chen YL, Wu DM, Qian J, et al. The detection of exhaled carbon monoxide and inhalatable particle concentration[J]. Zhongguo Gong Gong Wei Sheng, 2004, 20 (3) : 333. [陈宇炼, 吴冬梅, 钱婕, 等. 吸烟者呼出气中一氧化碳、可吸入颗粒物测定[J]. 中国公共卫生,2004, 20 (3) : 333. ] |
| [12] | Eurlings IM, Reynaert NL, van den Beucken T, et al. Cigarette smoke extract induces a phenotypic shift in epithelial cells; involvement of HIF1alpha in mesenchymal transition[J]. PLoS One, 2014, 9 (10) : e107757. DOI:10.1371/journal.pone.0107757 |
| [13] | Mao XG, Xue XY, Wang L, et al. CDH5 is specifically activated in glioblastoma stemlike cells and contributes to vasculogenic mimicry induced by hypoxia[J]. Neuro Oncol, 2013, 15 (7) : 865–79. DOI:10.1093/neuonc/not029 |
| [14] | Tang NN, Zhu H, Zhang HJ, et al. HIF-1alpha induces VE-cadherin expression and modulates vasculogenic mimicry in esophageal carcinoma cells[J]. World J Gastroenterol, 2014, 20 (47) : 17894–904. |
| [15] | Maniotis AJ, Folberg R, Hess A, et al. Vascular channel formation by human melanoma cells in vivo and in vitro_ vasculogenic mimicry[J]. Am J Pathol, 1999, 155 (3) : 739–52. DOI:10.1016/S0002-9440(10)65173-5 |
| [16] | Sun T, Zhao N, Zhao XL, et al. Expression and functional significance of Twist1 in hepatocellular carcinoma: its role in vasculogenic mimicry[J]. Hepatology, 2010, 51 (2) : 545–56. DOI:10.1002/hep.23311 |
| [17] | Mourad-Zeidan AA, Melnikova VO, Wang H, et al. Expression profiling of Galectin-3-depleted melanoma cells reveals its major role in melanoma cell plasticity and vasculogenic mimicry[J]. Am J Pathol, 2008, 173 (6) : 1839–52. DOI:10.2353/ajpath.2008.080380 |
| [18] | Su F, Li B, Wang J, et al. Molecular regulation of vasculogenic mimicry in human uveal melanoma cells: role of helix-loop-helix Id2 (inhibitor of DNA binding 2)[J]. Graefes Arch Clin Exp Ophthalmol, 2009, 247 (3) : 411–9. DOI:10.1007/s00417-008-1008-z |
| [19] | Streit M, Detmar M. Angiogenesis, lymphangiogenesis, and melanoma metastasis[J]. Oncogene, 2003, 22 (20) : 3172–9. DOI:10.1038/sj.onc.1206457 |
| [20] | Deng L, Liu TW. Lymphangiogenesis and tumor metastasis[J]. Shi Yong Ai Zheng Za Zhi, 2013, 28 (1) : 95–7, 100. [邓恋, 刘陶文. 淋巴管新生与肿瘤转移的研究进展[J]. 实用癌症杂志,2013, 28 (1) : 95–7, 100. ] |
| [21] | Chang YS, Tomaso Ed, McDonald DM, et al. Mosaic blood vessels in tumors: Frequency of cancer cells in contact with flowing blood[J]. Proc Natl Acad Sci U S A, 2000, 97 (26) : 14608–13. DOI:10.1073/pnas.97.26.14608 |
| [22] | Fry SA, Sinclair J, Timms JF, et al. A targeted glycoproteomic approach identifies cadherin-5 as a novel biomarker of metastatic breast cancer[J]. Cancer Lett, 2013, 328 (2) : 335–44. DOI:10.1016/j.canlet.2012.10.011 |
| [23] | Liao F, Li Y, O’Connor W, et al. Monoclonal antibody to vascular endothelial cadherin is a potent inhibitor of angiogenesis, tumor growth and metastasis[J]. Cancer Res, 2000, 60 (24) : 6805–10. |
| [24] | Xia CS, Wang SG, Li D, et al. Catenin family member P120ctn[J]. Yi Xue Fen Zi Sheng Wu Xue Za Zhi, 2011, 8 (2) : 180–4. [夏传生, 王书刚, 李丹, 等. 连环蛋白家族成员P120ctn的作用及相关机制[J]. 医学分子生物学杂志,2011, 8 (2) : 180–4. ] |
| [25] | Yanagisawa M, Anastasiadis PZ. p120 catenin is essential for mesenchymal cadherin-mediated regulation of cell motility and invasiveness[J]. J Cell Biol, 2006, 174 (7) : 1087–96. DOI:10.1083/jcb.200605022 |
 2016, Vol. 43
2016, Vol. 43



