文章信息
- 莱菔硫烷抑制肺癌干细胞增殖的体外实验
- Sulforaphane Suppressed Proliferation of Lung Cancer Stem Cells in vitro
- 肿瘤防治研究, 2016, 43(7): 555-559
- Cancer Research on Prevention and Treatment, 2016, 43(7): 555-559
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.07.003
- 收稿日期: 2015-09-25
- 修回日期: 2016-01-13
2. 030012 太原,山西省人民医院放疗科
2. Department of Radiotherapy, Shanxi Province People' s Hospital, Taiyuan 030012, China
肺癌是我国最常见的恶性肿瘤之一,以非小细胞肺癌多见,其发病率呈逐年上升的趋势,多数患者确诊时已为中晚期,手术或放化疗的效果较差,多数患者死于肿瘤的远处转移。肿瘤的发生、转移及复发与肿瘤干细胞(cancer stem cells, CSCs)密切相关,靶向抑制肿瘤干细胞是根治肿瘤的最有效方法。近年来研究提示莱菔硫烷(sulforaphane, SFN)不仅预防肿瘤的发生,还能在乳腺癌和胰腺癌中抑制肿瘤干细胞的自我更新和增殖,展现了较高的抗肿瘤干细胞潜能[1-3]。本研究探讨莱菔硫烷对肺癌干细胞增殖的效果及机制,为莱菔硫烷的临床应用提供实验依据。
1 材料与方法 1.1 试剂莱菔硫烷购自美国Sigma公司,鼠抗人β-catenin、Oct4、Sox2、c-Myc、Nanog等单克隆抗体购自美国Santa Cruz公司。莱菔硫烷以少量DMSO溶解分装并贮存在-20℃冰箱中备用。
1.2 细胞株人肺癌细胞株H460购于中科院上海细胞中心,常规培养备用。sh-H460细胞株:委托上海生工构建shRNA慢病毒载体并制备成病毒液后,由本实验室感染H460细胞,经流式细胞术纯化后获得稳定低表达β-catenin的细胞株。实验用细胞均处于对数生长期。
1.3 MTT实验贴壁细胞经胰酶消化后制备单细胞悬液,计数并调整细胞密度为(1.0~1.5)×104/ml,加入96孔板中,200微升每孔,即2 000~3 000个/孔,共9孔。设重复孔3孔。细胞种植后常规培养过夜后(12 h以上)加入不同浓度莱菔硫烷(0、0.5、1.0、2.5、5.0、10、12.5、15、20μmol/L)处理72 h。处理后加入噻唑蓝(MTT),终浓度为5 mg/ml,孵育4 h后弃上清液,加入DMSO,200微升每孔,37℃恒温摇床振荡10 min,用酶标仪在490 nm波长处测定各孔吸光度值。
1.4 凋亡检测适量H460细胞种植于6孔板内,共6孔,常规培养过夜。第2天加入药物处理,分为3组:对照组,常规培养,不加任何处理;SFN 5组,加入莱菔硫烷(5.0μmol/L);SFN 10组,加入莱菔硫烷(10.0μmol/L)。采用AnnexinⅤ-FITC/PI双染色法。按美国KeyGene公司产品说明书进行操作。
1.5 肿瘤球形成实验贴壁细胞经胰酶消化后离心,1 000 r/min,离心2 min,弃上清液。以无菌PBS反复离心、洗涤3次后加入无血清培养液,制备单细胞悬液。调整细胞密度为1 500/ml,将单细胞悬液均匀地转移到超低黏附6孔板内,进行原代肿瘤球培养。分为以下4组:空白组和莱菔硫烷(1.0、2.0、5.0μmol/L)。每3~4天更换培养液1次,7天后观察肿瘤球形成数量并测量体积。肿瘤球体积的计算按以下公式:V=(4/3)πR3。R为肿瘤球半径。
1.6 侧群细胞检测分为对照组及处理组。处理组在细胞贴壁后(细胞密度以10%为宜)加入莱菔硫烷(5.0μmol/L),培养72 h。对照组常规培养,不加任何处理。细胞经消化并以2%胎牛血清RPMI1640培养液重悬为单细胞悬液,计数并调整细胞密度为l×l05/ml。细胞加入适当浓度Hoechst 33342,在37℃缓慢旋转孵育90 min。孵育90 min后离心5 min,300 g,4℃,并以预冷PBS重悬细胞。共洗涤细胞2次后保存在冰上,加入碘化丙啶,终浓度为l pg/ml,以区分死细胞。样品保存于冰上,用于流式细胞术检测。
1.7 蛋白电泳实验按5×105/ml接种细胞于200 ml培养瓶中,贴壁后分别用不同浓度莱菔硫烷(0、2.5、5.0、10、25μmol/L)处理72 h,收获细胞并提取细胞总蛋白,测量蛋白含量,然后加入等量的3×SDS PAGE缓冲液,96℃恒温水浴加热5 min,各组取等量蛋白进行12%SDS PAGE电泳并转移到NC膜上,NC膜用5%脱脂奶粉4℃封闭2 h,TBST洗涤后将膜与稀释的一抗4℃冰箱中孵育过夜,TBST液充分洗膜3次,每次振摇10 min。再与二抗室温孵育2 h。冲洗除去未结合过氧化物酶标记的羊抗鼠二抗,TBST摇洗3次,每次8 min。取出NC膜应用免疫发光反应,在数字成像系统中显影。
1.8 统计学方法应用SPSS13.0软件进行统计分析,数据以均数±标准差表示并进行单因素组间方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 莱菔硫烷抑制肺癌细胞的生长MTT检测结果表明,莱菔硫烷抑制H460细胞增殖(P < 0.01),且呈剂量依赖关系,其IC50值为11.2μmol/L。
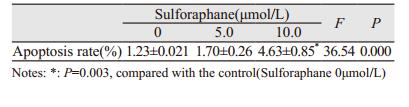
2.2 莱菔硫烷诱导肺癌细胞凋亡浓度为5、10μmol/L莱菔硫烷处理H460细胞72 h后,凋亡细胞比例显著增加, 呈剂量依赖性(F=36.54, P=0.000),见表 1和图 1。

|
| 图 1 莱菔硫烷对H460细胞凋亡率的影响 Figure 1 Sulforaphane(SFN) induced apoptosis of H460 cells |
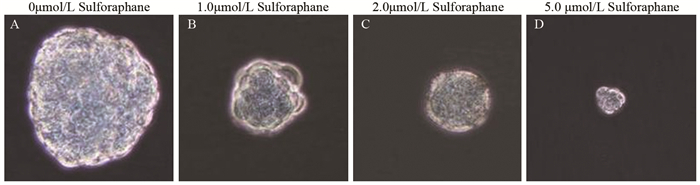
不同浓度莱菔硫烷(0、1.0、2.0和5.0μmol/L)处理细胞7天后,肿瘤球体积随药物浓度增加而明显变小(P=0.000),体积减少4~70倍,见图 2、表 2,且莱菔硫烷在较低浓度(1.0μmol/L)下即有明显的抑制作用。另一方面,肿瘤球的数量各组别间均有所不同,差异有统计学意义(F=87.971,P=0.000)。与空白组比较,莱菔硫烷各浓度组肿瘤球数量均下降(P < 0.05),见表 2。
|
| 图 2 莱菔硫烷对原代肺癌细胞肿瘤球形成能力的影响(n=3) Figure 2 Sulforaphane suppressed forming ability of primary tumor sphere (n=3) |
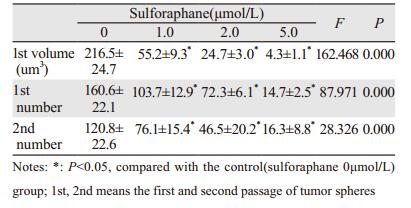 |
将原代肿瘤球再次消化为单细胞悬液后,重新进行肿瘤球(即次代肿瘤球)培养,共7天,不加入任何药物处理。结果表明,经莱菔硫烷处理后的肿瘤球细胞,在缺少莱菔硫烷情况下,各组肿瘤球数量随原代肿瘤球莱菔硫烷处理浓度增高而降低(F=28.326, P=0.000)。与空白组对比,莱菔硫烷各浓度组肿瘤球数量均有减少(P < 0.05),见表 2。
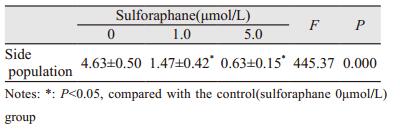
2.4 莱菔硫烷减少肺癌侧群细胞比例不同浓度莱菔硫烷(0、1.0、5.0μmol/L)处理H460细胞3天后,经流式细胞术检测发现,莱菔硫烷有效地减少侧群细胞比例,其抑制效果随着浓度的增加而增强(F=445.37, P=0.000),见图 3。与对照组比较,莱菔硫烷1.0和5.0μmol/L浓度处理组侧群细胞比例均明显下降,差异有统计学意义(P < 0.05),见表 3。
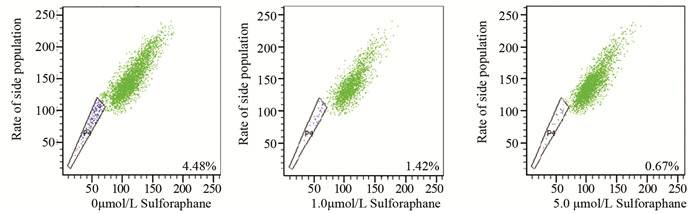
|
| 图 3 莱菔硫烷对H460侧群细胞比例的影响 Figure 3 Effect of sulforaphane on side population of H460 cells |
不同浓度莱菔硫烷处理H460细胞72 h后,应用蛋白电泳法检测发现,随着莱菔硫烷处理浓度增高,β-catenin、Oct4、Sox2、c-Myc和Nanog等蛋白表达逐渐下降,呈剂量依赖性,见图 4A、4B。除β-catenin对Sox2、c-Myc和Nanog等干性相关基因的影响外,本实验构建了β-catenin低表达的H460细胞株,见图 4C。按以上步骤再次检测Oct4、Sox2、c-Myc、Nanog等干性相关基因的表达时发现,Oct4、Sox2、c-Myc和Nanog基因表达水平与莱菔硫烷的作用浓度有关,见图 4D。
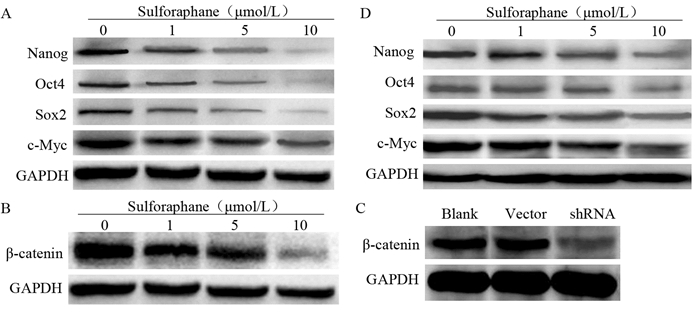
|
| A: Sulforaphane dose-dependently suppressed the expression of Oct4, Sox2, c-Myc and Nanog; B: Sulforaphane dose-dependently suppressed the expression ofβ-catenin; C: H460 cells withβ-catenin silenced by shRNA method was constructed and validated by Western blot; D: Sulforaphane suppressed the expression of Oct4, Sox2, c-Myc and Nanog in condition ofβ-catenin silenced 图 4 莱菔硫烷对H460细胞干性相关基因表达的影响 Figure 4 Sulforaphane suppressed expression of stemness-related genes in H460 cells |
莱菔硫烷是从绿花椰菜或其幼芽中提取的一种天然化合物,其预防肿瘤和抗肿瘤的效果在包括乳腺癌、膀胱癌、结肠癌、肺癌等多种恶性肿瘤中得到证实[3-6]。在乳腺癌的研究中表明,莱菔硫烷能有效地抑制乳腺癌干细胞的自我更新和增殖,且在较低的浓度下即可发挥抑制作用[3]。本研究结果表明,莱菔硫烷不仅能有效抑制肺癌细胞,还能有效抑制肺癌细胞形成肿瘤球的能力,有效降低侧群细胞比例。尤其重要的是,莱菔硫烷抑制肺癌干细胞的有效浓度(11.2μmol/L)明显低于其抑制肺癌细胞的浓度(1.0μmol/L),这说明莱菔硫烷在较低浓度下优先靶向抑制肺癌干细胞。另外,本实验将经莱菔硫烷处理过的肿瘤球细胞再次进行传代培养时发现,即使不再加入莱菔硫烷处理,肿瘤细胞形成肿瘤球的能力依然随莱菔硫烷浓度增高而减少。这说明莱菔硫烷直接影响到了肿瘤干细胞的自我更新和增殖,原代肿瘤球内肿瘤干细胞的比例减少。
肿瘤干细胞自我更新和增殖的调控网络较为复杂,其中包括Wnt/β-catenin、hedgehog(SHH)、Notch和PI3K/PTEN/Akt等。Wnt/β-catenin上调与许多肿瘤的发生发展密切相关,是调控肿瘤干细胞自我更新的关键信号通路之一[7-9]。近年研究证实在乳腺癌中莱菔硫烷可下调Wnt/β-catenin通路,可通过GSK3β诱导β-catenin磷酸化和泛素化降解[3]。本实验结果表明,莱菔硫烷能有效抑制β-catenin的表达。这一结果与以往的报告相符。
此外,研究表明多种信号通路蛋白(如Sox2、c-Myc、Nanog、Oct4等)在维持肿瘤干细胞干性特征或在已分化细胞向多潜能干细胞转变过程中起到重要作用,称之为干性相关基因[10-12]。在多数肿瘤干细胞的调控中干性相关基因的表达水平与β-catenin呈正相关性。本实验也发现Sox2、c-Myc、Nanog、Oct4等干性相关基因在莱菔硫烷处理过程中的表达变化与β-catenin表达趋势类似。但在低表达β-catenin的肺癌细胞中莱菔硫烷仍呈剂量依赖性地抑制Sox2、c-Myc、Nanog和Oct4等基因的表达。这提示莱菔硫烷除了通过Wnt/β-catenin通路抑制肿瘤干细胞,还能通过Sox2、c-Myc、Nanog和Oct4等信号分子直接或间接地参与调控。
综上所述,莱菔硫烷能特异地通过β-catenin和干性相关基因(Sox2、c-Myc、Nanog和Oct4)特异地抑制肺癌干细胞的增殖。但这些重要调节因子的相互作用关系仍不清楚,不除外这些基因存在共同的上游调控基因或调控元件。研究表明,莱菔硫烷不仅在基因水平上调节多种关键信号通路,还在miRNA水平或表遗传学水平上参与生物调节[13-14]。特别是最近研究表明,莱菔硫烷可直接作用于DNA或RNA的特殊碱基序列,从宏观上影响染色体的结构稳定性[15]。以上证据显示,莱菔硫烷对肿瘤细胞或肿瘤干细胞的生物学行为调控网络非常广泛而复杂,值得进行更深入的基础和临床研究。
| [1] | Rausch V, Liu L, Kallifatidis G, et al. Synergistic activity of sorafenib and sulforaphane abolishes pancreatic cancer stem cell characteristics[J]. Cancer Res, 2010, 70 (12) : 5004–13. DOI:10.1158/0008-5472.CAN-10-0066 |
| [2] | Kallifatidis G, Rausch V, Baumann B, et al. Sulforaphane targets pancreatic tumour-initiating cells by NF-kappaB-induced antiapoptotic signalling[J]. Gut, 2009, 58 (7) : 949–63. DOI:10.1136/gut.2008.149039 |
| [3] | Li Y, Zhang T, Korkaya H, et al. Sulforaphane, a dietary component of broccoli/broccoli sprouts, inhibits breast cancer stem cells[J]. Clin Cancer Res, 2010, 16 (9) : 2580–90. DOI:10.1158/1078-0432.CCR-09-2937 |
| [4] | Dang YM, Huang G, Chen YR, et al. Sulforaphane inhibits the proliferation of the BIU87 bladder cancer cell line via IGFBP-3 elevation[J]. Asian Pac J Cancer Prev, 2014, 15 (4) : 1517–20. DOI:10.7314/APJCP.2014.15.4.1517 |
| [5] | Wang M, Zhu JY, Chen S, et al. Effects of co-treatment with sulforaphane and autophagy modulators on uridine 5' -diphospho-glucuronosyltransferase 1A isoforms and cytochrome P450 3A4 expression in Caco-2 human colon cancer cells[J]. Oncol Lett, 2014, 8 (6) : 2407–16. |
| [6] | Yang GJ, Zhang J, Cui LL, et al. Effects of SFN on expression of CYR61 in A549 cell lines[J]. Zhong Liu Fang Zhi Yan Jiu, 2009, 36 (10) : 821–4. [杨国俊, 张军, 崔玲玲, 等. 莱菔硫烷对A549细胞株CYR61基因表达的影响[J]. 肿瘤防治研究,2009, 36 (10) : 821–4. ] |
| [7] | Lan F, Pan Q, Yu H, et al. Sulforaphane enhances temozolomide-induced apoptosis because of down-regulation of miR-21 via Wnt/β-catenin signaling in glioblastoma[J]. J Neurochem, 2015, 134 (5) : 811–8. DOI:10.1111/jnc.2015.134.issue-5 |
| [8] | Lin LC, Yeh CT, Kuo CC, et al. Sulforaphane potentiates the efficacy of imatinib against chronic leukemia cancer stem cells through enhanced abrogation of Wnt/β-catenin function[J]. J Agric Food Chem, 2012, 60 (28) : 7031–9. DOI:10.1021/jf301981n |
| [9] | Niu X, Liu S, Jia L, et al. Role of MiR-3619-5p inβ-Catenin-Mediated Non-Small Cell Lung Cancer Growth and Invasion[J]. Cell Physiol Biochem, 2015, 37 (4) : 1527–36. DOI:10.1159/000438520 |
| [10] | Apostolou P, Toloudi M, Ioannou E, et al. Study of the interaction among Notch pathway receptors, correlation with stemness, as well as their interaction with CD44, dipeptidyl peptidase-IV, hepatocyte growth factor receptor and the SETMAR transferase, in colon cancer stem cells[J]. J Recept Signal Transduct Res, 2013, 33 (6) : 353–8. DOI:10.3109/10799893.2013.828072 |
| [11] | Seymour T, Twigger AJ, Kakulas F. Pluripotency Genes and Their Functions in the Normal and Aberrant Breast and Brain[J]. Int J Mol Sci, 2015, 16 (11) : 27288–301. DOI:10.3390/ijms161126024 |
| [12] | Filipczyk A, Marr C, Hastreiter S, et al. Network plasticity of pluripotency transcription factors in embryonic stem cells[J]. Nat Cell Biol, 2015, 17 (10) : 1235–46. DOI:10.1038/ncb3237 |
| [13] | Wang Y, Li Y, Liu X, et al. Genetic and epigenetic studies for determining molecular targets of natural product anticancer agents[J]. Curr Cancer Drug Targets, 2013, 13 (5) : 506–18. DOI:10.2174/15680096113139990033 |
| [14] | Appari M, Babu KR, Kaczorowski A, et al. Sulforaphane, quercetin and catechins complement each other in elimination of advanced pancreatic cancer by miR-let-7 induction and K-ras inhibition[J]. Int J Oncol, 2014, 45 (4) : 1391–400. |
| [15] | Abassi Joozdani F, Yari F, Abassi Joozdani P, et al. Interaction of Sulforaphane with DNA and RNA[J]. PLoS One, 2015, 10 (6) : e0127541. DOI:10.1371/journal.pone.0127541 |
 2016, Vol. 43
2016, Vol. 43