文章信息
- TNF-α和TNFR1在宫颈鳞癌组织中的表达及临床意义
- Expression and Significance of TNF-α and TNFR1 in Human Cervical Squamous Cell Carcinoma Tissues
- 肿瘤防治研究, 2016, 43(6): 497-501
- Cancer Research on Prevention and Treatment, 2016, 43(6): 497-501
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.06.013
- 收稿日期: 2015-09-10
- 修回日期: 2016-01-08
2. 063000 唐山,华北理工大学公共卫生学院;
3. 063000 唐山,唐山工人医院妇二科
2. Public Health School of North China University of Science and Technology,Tangshan 063000, China;
3. Department of The Second Gynecology, Tangshan GongrenHospital, Tangshan 063000, China
宫颈癌在全世界女性的癌症发病率中居第二位[1],人乳头瘤病毒(HPV)尤其是高危型HPV(16、18型)持续感染是其发生发展的必要因素[2]。慢性炎症作为HPV的协同或独立因素参与肿瘤的发生发展、的不同阶段[3]。TNF-α和TNFR1通过调节肿瘤微环境参与多种肿瘤癌变,但在宫颈鳞癌中的表达及意义尚不明确。本研究通过检测正常宫颈、宫颈上皮内瘤样病变(CIN)和宫颈鳞癌组织中TNF-α和不同亚型受体TNFR的表达变化,探讨TNF-α和TNFR1在宫颈癌变中的作用。
1 资料与方法 1.1 样本的收集与保存自2013年6月—2015年6月共收集唐山市工人医院妇产科门诊和住院患者活检或手术切除获得的各类宫颈组织共134例,所有患者病例资料完整,且术前均未接受化疗。其中正常宫颈(Normal组)组织48例、宫颈上皮内瘤变(CIN组)组织47例、宫颈鳞癌(SCC组)组织39例,全部病理组织均由病理科的两位病理学家审查了组织学类型以及分级。同时各组患者年龄差异不明显,其中Normal组患者平均年龄(45.8±3.42)岁,CIN组平均年龄(43.2±6.61)岁,SCC组平均年龄(44.8±4.6)岁。根据WHO细胞分化标准,SCC组高中分化者20例、低分化者19例;按国际妇产科联盟FIGO分期,Ⅰ~Ⅱ期28例、Ⅲ~Ⅳ期11例。有淋巴结转移13例、无淋巴结转移者26例。留取的新鲜宫颈组织标本,每个组织一部分采用石蜡包埋用于免疫组织化学,另一部分置于灭菌的锡箔纸内,液氮保存用于RT-PCR或Western blot检测。TRIzol试剂、反转录试剂盒、Real-time PCR反应试剂盒均购自美国Invitrogen公司,PCR引物由北京赛百盛基因技术有限公司合成,TNFR1抗体、GAPDH抗体、HRP标记的抗体均购自美国Santa Cruz公司,SABC免疫组织化学试剂盒购自武汉博士得生物工程有限公司。
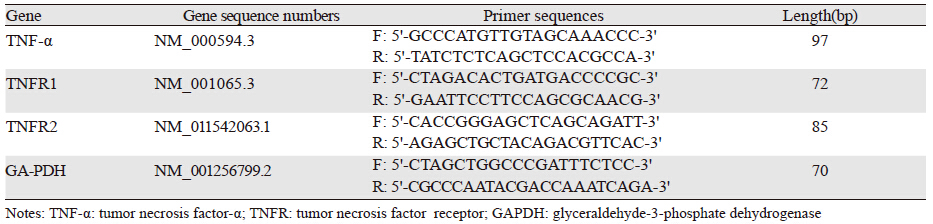
1.2 方法 1.2.1 实时定量RT-PCR分析不同病理类型宫颈组织中TNF-α和不同亚型TNFR mRNA的表达使用TRIzol法提取液氮保存的宫颈组织中的RNA,运用反转录试剂盒合成cDNA,采用SYBGreen染料试剂盒进行Real-time PCR反应。在NCBI数据库中检索并设计TNF-α、TNFR1、TNFR2及GAPDH的引物序列,见表 1。实时定量RT-PCR反应条件:50℃2 min,95℃ 10 min;然后95℃ 15 s,60℃ 30 s,共40个循环,所有反应重复三次,以GAPDH为内参,采用2-△△Ct法确定基因的相对表达。
采用黏附载玻片展片,65℃干燥2 h,经二甲苯脱蜡、梯度乙醇洗涤水化,最后置于磷酸缓冲盐水(PBS,pH7.4)中,高压法抗原修复,按照试剂盒步骤染色,正置尼康显微镜(×400)下观察、拍照。
1.2.3 Western blot定量分析不同病理类型宫颈组织中TNFR1和TNFR2的表达将宫颈组织研碎,加入比例为5 g/L的蛋白裂解液提取蛋白并测定含量,进行10% SDS-PAGE凝胶电泳分离1.5 h,100 V电压转膜2 h,转移到硝酸纤维素膜上,在37℃室温下用5%脱脂奶粉封闭2 h,以Santa Cruz公司的兔抗人TNFR1蛋白抗体、兔抗人TNFR2蛋白抗体(稀释浓度1:500)、兔抗人β-肌动蛋白抗体(稀释浓度1:1 000)作为一抗,以HRP标记的羊抗兔IgG抗体(稀释浓度1:2 000)为二抗,一抗封闭过夜,洗膜,二抗封闭2 h,以NBT/BCIP/缓冲液试剂盒进行蛋白显色。采用Image J凝胶图像处理系统分析计算条带的吸光度值,以目标蛋白条带灰度值/内参条带灰度值来表示目的基因相对蛋白表达水平。
1.3 统计学方法用SPSS19.0统计软件对数据进行分析,所得数据用均数±标准差的方式来表示,同时使用t检验和单因素方差分析计量资料,使用χ2检验分析计数资料,各组间以P<0.05为差异有统计学意义。
2 结果 2.1 实时定量RT-PCR法分析不同病理类型宫颈组织中TNF-α mRNA的表达TNF-α mRNA在不同病理类型宫颈组织中的表达水平分别为Normal组(1.3±0.2)、CIN组(3.633±0.404)、SCC组(7.5±1.411),各组间差异均有统计学意义(F=40.068,P<0.05,SCC组与CIN、Normal组比较P=0.01,0.002,CIN组与Normal组比较P=0.001),并且在不同病理类型宫颈组织中的表达水平随着病理分级的升高而逐渐升高,见图 1。

|
| CIN: cervical intraepithelial neoplasia; SCC: squamous cell carcinoma; *: P<0.05,compared with normal cervical group; #: P<0.05,compared with CIN group 图 1 实时定量RT-PCR分析不同病理类型宫颈组织中 TNF-α mRNA的表达 Figure 1 Expression of TNF-α mRNA in different pathological cervical tissues detected by real-time quantitative RT-PCR |
TNFR1阳性表达主要定位于细胞膜,呈棕黄色,见图 2。TNF-α表达随着宫颈病理程度的增加,其表达逐渐增强。使用Image-pro Plus软件计算其阳性率,分别为Normal组(6.25±3.2)%、CIN组(58.82±11.32)%、SCC组(71.79±9.85)%,经χ2检验,组间差异有统计学意义(P=0.00)。

|
| A: normal cervical (Control) group; B: cervical intraepithelial neoplasia (CIN)group; C: cervical squamous cell carcinoma (SCC) group; D: the histogramsof TNF-α positive expression rate; a,b,c: the proportionally scaled image ofthe typical sites (dashed box) of A,B,C 图 2 免疫组织化学显示TNF-α在不同病理类型宫颈组织中的表达 Figure 2 Expression of TNF-α protein in different pathologicalcervical tissues detected by immunohistochemistry method |
蛋白印迹实验检测结果显示,在蛋白表达水平上,TNFR1在SCC组表达最强,与Normal组和CIN组比较(P=0.00,0.08),CIN组与Normal组比较(P=0.03),差异均有统计学意义(F=52.499,P<0.05),TNFR2在各组的表达差异不明显,SCC组与Normal组和CIN组比较(P=0.111,0.584),Normal组和CIN组比较(P=0.423),差异无统计学意义(F=3.419,P>0.05),蛋白表达结果与mRNA检测结果一致,见图 3。

|
| A: electrophoresis images of TNFR1,2 and internal reference protein; B: TNFR1,2 protein relative expression levels; C: TNFR1,2 mRNA relativeexpression levels; a: normal cervix group; b: cervical intraepithelial neoplasia group; c: cervical squamous cell carcinoma group; *: P<0.05,comparedwith normal cervical group; #: P<0.05,compared with CIN group 图 3 TNFR1、2蛋白和mRNA在不同病理类型宫颈组织中的表达 Figure 3 Expression of TNFR1,2 protein and mRNA in different pathological cervical tissues |
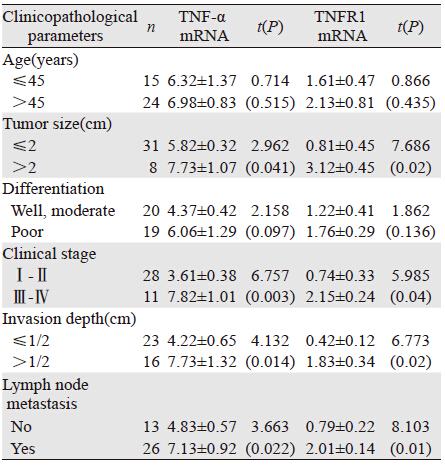
将宫颈鳞癌组中TNF-α和TNFR1 mRNA表达与宫颈鳞癌临床病理参数进行相关性分析,TNF-α和TNFR1 mRNA的表达量与肿瘤大小、临床分期、浸润深度以及淋巴结转移情况呈正相关性,差异有统计学意义(P<0.05);与患者年龄以及细胞分化程度无明显的相关性,差异无统计学意义(P>0.05),见表 2。
 |
TNF-α作为一种重要的内源性肿瘤启动子,主要通过与两个不同的受体TNF-α受体I(TNFR1;P55或P60)和TNF-α受体Ⅱ(TNFR2;P75或P80)的结合而发挥生物学功能,而TNFR1介导其大多数生物学活性,并且与TNFR2相比较,TNFR1对转录因子NF-κB的激活作用更显著也更广泛[4-5]。同时,TNF-α和TNFR1在不同肿瘤组织中的肿瘤促进作用已经在各种小鼠肿瘤模型中得到证明。在结肠炎相关结肠癌以及转基因胃癌的小鼠模型中,通过药物阻断或者敲除小鼠的TNF-α和TNFR1,可以抑制肿瘤的发展,这表明TNF-α和TNFR1在肿瘤的发展过程中起着关键作用[6-7]。此外,在肺转移小鼠模型中,TNF-α通过激活TNFR1能够通过诱导肝细胞生长因子(HGF)的表达,诱导肿瘤新血管形成,促进肺癌转移[8],而且组织细胞实验也证明TNF-α和TNFR1参与促进肺癌的转移[9]。另外还有学者研究证实,TNF-α和TNFR1参与弥漫性大B细胞淋巴瘤、骨肉瘤、卵巢癌等多种恶性肿瘤的发生发展[10-12]。本研究同样证实TNFR1在基因转录和翻译表达水平均与宫颈鳞癌癌变呈正相关,TNFR2亚型表达不明显。由此可知TNF-α和TNFR1在宫颈癌的恶变和转移过程中起促进作用。
有研究证明,在不同病理类型的宫颈组织中核因子-κB(NF-κB)的表达水平为宫颈鳞癌(SCC)组>CIN组>正常宫颈组织,炎性反应增强,而半胱氨酸蛋白水解酶-3(Caspase-3)的表达为SCC组<CIN组<正常宫颈组织[13],凋亡程度下降。本研究结果同样证实了宫颈组织癌变过程中TNF-α和TNFR1表达增强。而其作为激活经典炎症途径NFκB的上游信号,导致宫颈局部组织的持续性炎症微环境,并最终诱导上皮细胞的抗凋亡,促进癌细胞的增殖。虽然TNFR1包含死亡结构域,但是TNF-α与TNFR1结合后可以通过RIP1、E3连接酶、细胞凋亡抑制蛋白家族(cLAPs)等激活经典的NF-κB信号途径,发挥促炎和致癌作用[14]。此外,TNF-α和TNFR1也可通过激活p42/p44 MAPK、JNK、Akt以及VEGF-C-VEGFR3等多种下游信号通路发挥促进癌细胞增殖作用[15-16]。
综上所述,TNF-α主要通过TNFR1介导下游信号通路的激活,参与宫颈鳞癌的发生、进展以及转移等过程,检测TNF-α和TNFR1的表达对于宫颈鳞癌的预防、治疗以及预后具有重要的临床意义。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CACancer J Clin, 2015, 65 (1) : 5–29. |
| [2] | Gillison ML, Castellsagué X, Chaturvedi A, et al. EuroginRoadmap: comparative epidemiology of HPV infection andassociated cancers of the head and neck and cervix[J]. Int J Cancer, 2014, 134 (3) : 497–507. |
| [3] | Fernandes JV, Medeiros Fernandes TA, DE Azevedo JC, et al. Linkbetween chronic inflammation and human papillomavirus-induced carcinogenesis (Review)[J]. Oncol Lett, 2015, 9 (3) : 1015–26. |
| [4] | Vallabhapurapu S, Karin M. Regulation and function of NFkappaBtranscription factors in the immune system[J]. Annu Rev Immunol, 2009, 27 : 693–733. |
| [5] | Gerondakis S, Grumont R, Gugasyan R, et al. Unravelling thecomplexities of the NF-κB signalling pathway using mouse knockout and transgenic models[J]. Oncogene, 2006, 25 (51) : 6781–99. |
| [6] | Popivanova BK, Kitamura K, Wu Y, et al. Blocking TNF-α inmice reduces colorectal carcinogenesis associated with chronic colitis[J]. J Clin Invest, 2008, 118 (2) : 560–70. |
| [7] | Oshima H, Ishikawa T, Yoshida GJ, et al. TNF-α/TNFR1 signalingpromotes gastric tumorigenesis through induction of Noxo1 and Gna14 in tumor cells[J]. Oncogene, 2014, 33 (29) : 3820–9. |
| [8] | Tomita Y, Yang X, Ishida Y, et al. Spontaneous regression of lung metastasis in the absence of tumor necrosis factor receptor p55[J]. Int J Cancer, 2004, 112 (6) : 927–33. |
| [9] | Yang YF, Jan YH, Liu YP, et al. Squalene synthase induces tumor necrosis factor receptor 1 enrichment in lipid rafts to promote lung cancer metastasis[J]. Am J Respir Criti Care Med, 2014, 190 (6) : 675–87. |
| [10] | Nakayama S, Yokote T, Tsuji M, et al. Expression of tumour necrosis factor-α and its receptors in Hodgkin lymphoma[J]. Br J Haematol, 2014, 167 (4) : 574–7. |
| [11] | Chiechi A, Novello C, Magagnoli G, et al. Elevated TNFR1 andserotonin in bone metastasis are correlated with poor survivalfollowing bone metastasis diagnosis for both carcinoma and sarcoma primary tumors[J]. Clin Cancer Res, 2013, 19 (9) : 2473–85. |
| [12] | Zhu G, Du Q, Wang X, et al. TNF-α promotes gallbladder cancercell growth and invasion through autocrine mechanisms[J]. Int J Mol Med, 2014, 33 (6) : 1431–40. |
| [13] | Xia L, Xue XZ. Immunohistochemical study of NF-κB p65, c-IAP2and caspase-3 expression in cervical cancer[J]. Oncol Lett, 2012, 3 (4) : 839–44. |
| [14] | Wajant H, Scheurich P. TNFR1-induced activation of the classicalNF-κB pathway[J]. FEBS J, 2011, 278 (6) : 862–76. |
| [15] | Rivas MA, Carnevale RP, Proietti CJ, et al. TNF alpha acting on TNFR1 promotes breast cancer growth via p42/P44 MAPK, JNK, Akt and NF-kappa B-dependent pathways[J]. Exp Cell Res, 2008, 314 (3) : 509–29. |
| [16] | Ji H, Cao R, Yang Y, et al. TNFR1 mediates TNF-α-inducedtumour lymphangiogenesis and metastasis by modulating VEGFC-VEGFR3 signalling[J]. Nat Commun, 2014, 5 : 4944. |
 2016, Vol. 43
2016, Vol. 43