文章信息
- 每周脂质体紫杉醇或奥沙利铂联合替吉奥方案治疗老年晚期胃癌的疗效及安全性分析
- Efficacy and Safety of Weekly Liposome-paclitaxel or Oxaliplatin Combined with Tegafur on Elderly Advanced Gastric Cancer
- 肿瘤防治研究, 2016, 43(5): 400-403
- Cancer Research on Prevention and Treatment, 2016, 43(5): 400-403
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.05.017
- 收稿日期: 2015-12-23
- 修回日期: 2016-03-10
胃癌是世界上第四常见恶性肿瘤,是世界上肿瘤致死的第二常见原因。超过70%胃癌病例发生在发展中国家,其中有一半的病例发生在东亚地区(主要在中国)[1]。晚期胃癌患者往往由于营养状态差,大多无法耐受三药联合方案化疗,老年患者更是如此[2]。因此探索高效、低毒的两药联合化疗方案尤为重要。
本研究收集119例老年晚期胃癌患者的临床资料,总结了脂质体紫杉醇或奥沙利铂联合替吉奥一线治疗老年晚期胃癌患者的疗效及不良反应,为老年晚期胃癌患者的一线化疗提供新的依据。
1 资料与方法 1.1 临床资料纳入119例研究对象为 2011年10月至2014年10月苏州大学附属第二医院收治的老年晚期胃癌患者,所有患者均经电子胃镜或手术病理确诊,随机分为两组:A组62例患者采用每周脂质体紫杉醇联合替吉奥方案;B组57例患者采用奥沙利铂联合替吉奥方案。A组:男32例,女30例;中位年龄为71岁(65~82岁);胃癌根治术后复发的患者24例,行剖腹探查术或姑息手术者4例,初次诊断即为晚期并且失去手术机会的患者34例;B组:男30例,女27例;中位年龄为69岁(65~80岁);胃癌根治术后复发的患者23例,行剖腹探查术或姑息手术者3例,初次诊断即为晚期并且失去手术机会的患者31例。具体见表 1。
1.2 入组标准
ECOG评分0~2分,血液学标准:中性粒细胞计数≥1.5×109/L,血红蛋白≥90 g/L,血小板计数≥100×109/L;肝功能:血清总胆红素≤2.0 mg/dl,转氨酶<3倍正常值(肝脏转移患者则<5倍正常值);肾功能:血清肌酐≤1.5 mg/dl、或者肌酐清除率≥50 ml/min。应用紫杉醇类、奥沙利铂类药物或替吉奥类药物辅助化疗复发的患者距离辅助化疗的时间应大于6月。
1.3 排除标准既往接受过姑息化疗的患者;患有其他严重医学疾病的患者;对紫杉醇类、奥沙利铂类药物或者替吉奥过敏的患者。
1.4 治疗方法A组:脂质体紫杉醇60 mg/m2(为年轻患者的80%剂量),d1、8、15、22,替吉奥60 mg(体表面积≥1.5 m2)或者50 mg(体表面积>1.25 m2~1.5 m2),每日2次,第1~28天口服用药,6周一疗程,每2疗程评价疗效。B组:奥沙利铂130 mg/m2,d1,替吉奥用法同A组,第1~14天口服用药,3周一疗程,每3疗程评价疗效。治疗持续至患者病情进展或出现不可耐受的不良反应。
所有患者化疗前均行胸部CT、腹部CT、盆腔CT增强扫描来记录病灶的基线水平。疗效评价根据RECIST 1.1标准分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。以(CR+PR)/总数×100%计算客观有效率(ORR),(CR+PR+SD)/总数×100%计算疾病控制率(DCR)。无疾病进展时间(PFS)指肿瘤疾病患者从接受治疗开始,到观察到疾病进展或者发生因为任何原因死亡的这段时间。生存时间(OS)指从接受治疗开始至死亡或随访截止时间。不良反应采用NCI-CTC 3.0毒性评价标准分为0~Ⅳ级。
1.5 统计学方法所有患者都采用电话随访,末次随访时间为2015年4月30日。数据采用SPSS17.0软件进行分析,分类资料用百分率进行描述,组间比较采用χ2检验,Kaplan-Meier法进行生存分析,Log rank公式检验,P<0.05为差异有统计学意义。
2 结果 2.1 近期疗效115例患者可评价疗效,A组62例患者中59例患者可评价疗效,完全缓解(CR)1例,部分缓解(PR)12例,疾病稳定(SD)28例,疾病进展(PD)18例;B组57例患者中1例患者中断治疗,完全缓解(CR)0例,部分缓解(PR)14例,疾病稳定(SD)24例,疾病进展(PD)18例。两组的客观有效率(ORR)分别为21.0%、25.0%(P=0.708),疾病控制率(DCR)分别为69.5%、67.9%(P=0.850)。两组结果比较差异无统计学意义,近期疗效相似。
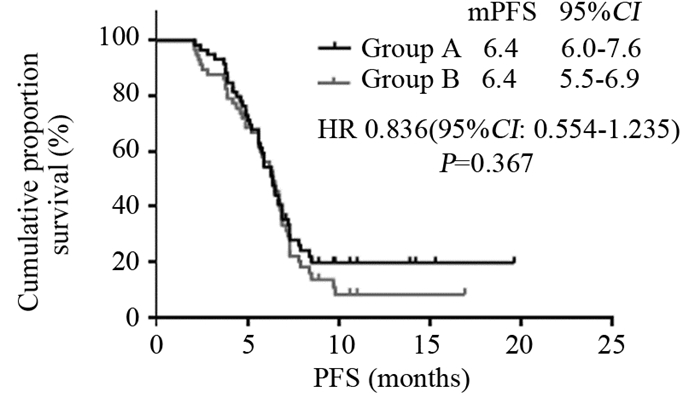
2.2 无疾病进展时间及总生存时间A组中位PFS为6.4月(2.1~19.6月),95%CI: 6.0~7.6月;B组中位PFS为6.4月(2.1~16.9月),95%CI: 5.5~6.9月。两组差异无统计学意义(P=0.367)。
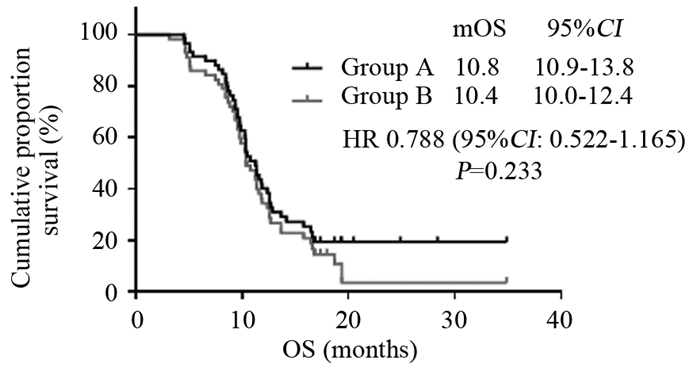
A组中位OS为10.8月(4.6~34.9月),95%CI: 10.9~13.8月;B组中位OS为10.4月(3.2~34.9月),95%CI: 10.0~12.4月。两组差异无统计学意义(P=0.233)。结果见图 1、2。
|
| 图 1 115例晚期胃癌患者疾病进展曲线 Figure 1 Progression free survival (PFS) curves of 115 elderly patients with advanced gastric cancer |
|
| 图 2 115例晚期胃癌患者总生存时间曲线 Figure 2 Overall survival (OS) curves of 115 elderly patients with advanced gastric cancer |
2.3 不良反应
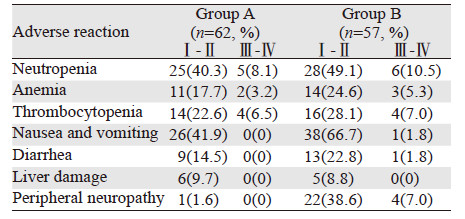
治疗期间患者的主要不良反应包括骨髓抑制(中性粒细胞减少、贫血、血小板减少)、胃肠道反应(恶心呕吐、腹泻)和外周神经毒性,见表 2。B组患者的Ⅰ~Ⅱ级胃肠道反应发生率明显高于A组,差异有统计学意义(P=0.007),主要表现为恶心呕吐,其中有1例患者因严重呕吐而中断治疗。B组患者的Ⅰ~Ⅱ级、Ⅲ~Ⅳ级外周神经毒性发生率明显高于A组,差异均有统计学意义(P均<0.05)。两组患者的骨髓抑制情况大致相仿,差异无统计学意义(P均>0.05)。
|
3 讨论
晚期胃癌虽然难以治愈,但与最佳支持治疗相比,规范化化疗不仅可以缓解患者症状,还可延长患者的生存期,因此化疗已成为晚期胃癌患者综合治疗中的重要组成部分。然而,迄今为止,晚期胃癌患者仍没有标准一线化疗方案。临床上应用的化疗方案有单药、两药联合、三药联合等多种方式,但是临床医师权衡疗效和不良反应后,大多应用两药联合方案[2-3]。
目前比较紫杉醇、奥沙利铂、氟尿嘧啶三类药物两两联合的化疗方案用于治疗晚期胃癌的文献较多[4-7],但研究周方案脂质体紫杉醇联合替吉奥对比奥沙利铂联合替吉奥方案的较少。本研究选用的三种药物均为新一代化疗药物,其疗效显著且不良作用相对较低。其中,脂质体紫杉醇大幅度降低了传统紫杉醇溶解剂聚氧乙烯蓖麻油引起过敏的风险[8],且更容易从血管渗漏到肿瘤组织[9],研究表明脂质体紫杉醇具有更佳的疗效、更低的过敏反应发生率[10]。此外,目前研究者发现每周紫杉醇的给药方式与传统的三周疗法疗效相近,但患者的不良反应更小、耐受性更好[11]。奥沙利铂是第三代铂类化疗药物,具有更广谱的抗肿瘤活性,肾毒性及消化道反应明显减轻,使得铂类药物可以应用于体质较弱的老年晚期胃癌患者[12-13],其突出的剂量限制性毒性为外周神经毒性。替吉奥胶囊是一种新型的口服氟尿嘧啶类药物,其单药或联合顺铂化疗已在大规模人群中证实对晚期胃癌有效[14],且具有较好的安全性。
本研究结果表明每周脂质体紫杉醇联合替吉奥方案的疗效与我们前期的研究结果[11]一致,但患者发生骨髓抑制及消化道不良反应略有上升,可能和入组患者年龄偏大、耐受性差有关。马晴晴等[5]将每周脂质体紫杉醇联合替吉奥方案与每周脂质体紫杉醇联合奥沙利铂方案进行比较,结果表明两方案疗效相当、骨髓抑制及主要消化道不良反应无显著差异,但前一方案患者发生外周神经毒性及Ⅲ~Ⅳ度腹泻发生率明显降低。而本研究比较了老年晚期胃癌患者中采用替吉奥联合每周脂质体紫杉醇或替吉奥联合奥沙利铂方案的疗效及安全性,发现两组客观有效率、疾病控制率相似,无疾病进展时间和总生存时间亦相近,差异无统计学意义(P均>0.05),但每周脂质体紫杉醇联合替吉奥组较奥沙利铂联合替吉奥组具有更低的胃肠道反应发生率和更低的外周神经毒性发生率。且每周脂质体紫杉醇低剂量、持续给药方案并没有出现传统的三周紫杉醇方案的严重骨髓毒性。因此对于老年晚期胃癌患者而言,每周脂质体紫杉醇联合替吉奥的两药化疗方案具有更好的耐受性,该两药方案值得我们在老年晚期胃癌患者中进一步推广。
| [1] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127 (12) : 2893–917. |
| [2] | Ajani JA, Moiseyenko VM, Tjulandtn S, et al. Clinical benifit with docetaxel plus fluorouracil and cisplatin compared with cisplatin and fluorouracil in a phase Ⅲ trial of advanced gastric or gastroesophageal cancer adenocarcinoma: the V-325 Study Group[J]. J Clin Oncol, 2007, 25 (22) : 3205–9. |
| [3] | Lorenzen S, Pauligk C, Homann N, et al. Feasibility of perioperative chemotherapy with infusional 5-FU, leucovorin, and oxaliplatin with (FLOT) or without (FLO) docetaxel in elderly patients with locally advanced esophagogastric cancer[J]. Br J Cancer, 2013, 108 (3) : 519–26. |
| [4] | Li JH, Li B, Jiang HR, et al. Weekly regimen of paclitaxel liposome combined with cisplatin and 5-fluorouracil continuous infusion in the treatment of advanced gastric carcinoma[J]. Zhonghua Zhong Liu Za Zhi, 2011, 33 (3) : 229–31. [李建璜, 李斌, 蒋海荣, 等. 紫杉醇脂质体联合顺铂及5-氟尿嘧啶治疗晚期胃癌的临床观察[J]. 中华肿瘤杂志,2011, 33 (3) : 229–31. ] |
| [5] | Ma QQ, Qu YL, Tang Y. Clinical outcomes of advanced gastric cancer patients treated with chemotherapy of paclitaxel liposome combined with S-1 or oxaliplatin[J]. Zhongguo Zhong Liu Lin Chuang, 2014, 41 (3) : 200–3. [马晴晴, 曲颜丽, 唐勇. 替吉奥或奥沙利铂联合紫杉醇脂质体治疗进展期胃癌的临床分析[J]. 中国肿瘤临床,2014, 41 (3) : 200–3. ] |
| [6] | Jiang H, Qian J, Zhao P, et al. A phaseⅡstudy of biweekly S-1 and paclitaxel (SPA) as first-line chemotherapy in patients with metastatic or advanced gastric cancer[J]. Cancer Chemother Pharmacol, 2015, 76 (1) : 197–203. |
| [7] | Zhong DT, Wu RP, Wang XL, et al. Combination Chemotherapy with S-1 and Oxaliplatin (SOX) as First-Line Treatment in Elderly Patients with Advanced Gastric Cancer[J]. Pathol Oncol Res, 2015, 21 (4) : 867–73. |
| [8] | Zhang L, Li YH, Wang CX, et al. Preparation of liposomal paclitaxel and its toxicity and antitumor effect[J]. Zhongguo Yao Xue Za Zhi, 2013, 48 (6) : 446–9. [张兰, 李彦辉, 王彩霞, 等. 紫杉醇脂质体的制备及初步毒性、药效学研究[J]. 中国药学杂志,2013, 48 (6) : 446–9. ] |
| [9] | Wu NZ, Da D, Rudoll TL, et al. Increased microvascular permeability contributes to preferential accumulation of Stealth liposomes in tumor tissue[J]. Cancer Res, 1993, 53 (16) : 3765–70. |
| [10] | Xu X, Wang L, Xu HQ, et al. Clinical comparison between paclitaxel liposome (Lipusu®) and paclitaxel for treatment of patients with metastatic gastric cancer[J]. Asian Pac J Cancer Prev, 2013, 14 (4) : 2591–4. |
| [11] | Chen L, Chen Q, Zhuang Z, et al. Effect of the weekly administration of liposome-paclitaxel combined with S-1 on advanced gastric cancer[J]. Jpn J Clin Oncol, 2014, 44 (3) : 208–13. |
| [12] | Kim YS, Sym SJ, Park SH, et al. A randomized phaseⅡstudy of weekly docetaxel/cisplatin versus weekly docetaxel/oxaliplatin as first-line therapy for patients with advanced gastric cancer[J]. Cancer Chemother Pharmacol, 2014, 73 (1) : 163–9. |
| [13] | Hamada C, Yamada Y, Azuma M, et al. Meta-analysis supporting noninferiority of oxaliplatin plus S-1 to cisplatin plus S-1 in first-line treatment of advanced gastric cancer (G-SOX study): indirect comparison with S-1 alone[J]. Int J Clin Oncol, 2016 . |
| [14] | Bando H, Yarnada Y, Tanabe S, et al. Efficacy and safety of S-1 and oxaliplatin combination therapy in elderly patients with advanced gastric cancer[J]. Gastric Cancer, 2015 . |
 2016, Vol. 43
2016, Vol. 43