文章信息
- 人类免疫缺陷病毒阳性和阴性弥漫大B细胞淋巴瘤的临床特点及近期疗效分析
- Differences of Clinical Features and Short-term Efficacy Between Diffuse Large B-cell Lymphomas of HIV-infected and Non-HIV-infected Patients
- 肿瘤防治研究, 2016, 43(5): 387-391
- Cancer Research on Prevention and Treatment, 2016, 43(5): 387-391
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.05.014
- 收稿日期: 2015-11-29
- 修回日期: 2016-01-06
2. 999106 弗朗西斯敦市,博茨瓦纳弗朗西斯敦市仰加奎医院肿瘤内科
2. Department of Oncology,Nyangabgwe Hospital,Francistown 999106,Botswana
艾滋病又称获得性免疫缺陷综合症,是一种由人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染后引起的机体细胞免疫功能受损,从而发生各种机会感染及恶性肿瘤等多种临床症状,统称为综合征。艾滋病相关淋巴瘤(acquired immunodeficiency syndrome-related lymphoma,ARL)是常见的艾滋病相关肿瘤之一,虽然相关机制仍在研究当中,但HIV感染患者发生非霍奇金淋巴瘤的风险比非HIV感染者明显增高[1-2]。ARL包含很多种类,其中B细胞来源占95%以上,最常见病理类型为弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL),占ARL的40%~60%[3-4]。随着我国艾滋病感染人数逐年上升[5],艾滋病相关弥漫大B细胞淋巴瘤也日益受到重视,然而我国关于该病的相关报道和资料较少,诊治经验相对缺乏。博茨瓦纳是世界上艾滋病感染率最高的国家之一[6],艾滋病相关DLBCL是博茨瓦纳医院肿瘤内科的常见病。本文就博茨瓦纳弗朗西斯敦市仰加奎医院肿瘤内科2012年3月至2015年3月诊治及收集随访的DLBCL患者71例,按HIV阳性与阴性分为两组,就其临床特点、治疗效果及不良反应进行分析,希望对今后的临床工作有一定的指导。
1 资料与方法 1.1 一般资料2012年3月至2015年3月就诊及随访于博茨瓦纳弗朗西斯敦市仰加奎医院肿瘤内科的DLBCL病例71例,均为博茨瓦纳人,其中男47例,女24例;年龄14~67岁,平均年龄(39.3±12.4)岁。入组标准:病理确诊弥漫大B细胞淋巴瘤,并接受CHOP方案化疗。分组标准:实验室检查HIV,按阳性阴性分为两组。收集患者一般情况、血清乳酸脱氢酶(lactate dehydrogenase,LDH),Ann Arbor临床分期、B症状、结外浸润部位、血白细胞计数(white blood cell,WBC)、血红蛋白(haematoglobin,Hb)等资料,对两组资料进行统 计学分析。HIV阳性组监测CD4+细胞计数。
1.2 治疗方案CHOP方案:环磷酰胺750 mg/m2,静脉滴注第1天;阿霉素50 mg/m2;静脉滴注,第1天;长春新碱1.4 mg/m2,静脉推注,第1天;泼尼松,100 mg,口服,第1~5天。化疗中常规给予5-羟色胺阻滞剂格拉司琼(kytril)止吐,3周为1疗程,疗程中观察不良反应,化疗后评价疗效。所有HIV阳性患者均给予高效价抗逆转录病毒治疗(highly active antiretroviral therapy,HAART)。
1.3 疗效及不良反应观察采用世界卫生组织(World Health Organization,WHO)疗效评价通用标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。以CR+PR为客观有效。客观有效率(objective response rate,ORR)=(CR+PR/n×100%,不良反应评价根据WHO毒性分级标准判定。
1.4 统计学方法对本研究的数据采用SPSS18.0进行分析,对计数资料进行卡方检验,当样本例数较少时采用Fisher确切概率法,对计量资料进行t检验。P<0.05为差异有统计学意义。
2 结果 2.1 临床特征比较在71例DLBCL患者中,HIV阳性组37例,男性29例,女性8例,中位年龄40岁(16~67岁);HIV阴性组34例,男性18例,女性16例,中位年龄38岁(21~64岁)。HIV阳性组男性比例高于HIV阴性组(P<0.05)。与HIV阴性DLBCL相比,HIV阳性DLBCL诊断时表现出更强的侵袭性,临床分期较晚(Ⅲ~Ⅳ),患者更容易出现发热、消瘦、盗汗B症状,国际预后指数(international prognostic index,IPI)高于HIV阴性组,差异有统计学意义(P<0.05)。HIV阳性组患者更容易出现结外受累,胃肠道、肝、肺浸润高于HIV阴性组(P均<0.05)。HIV阳性组就诊时,WBC及Hb低于HIV阴性组(P<0.05),临床特点分析见表 1。
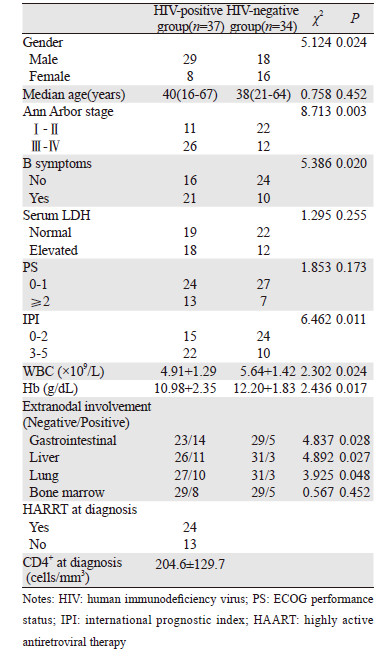
|
2.2 近期疗效及影响因素分析
化疗近期效果比较:HIV阳性组中7例患者达CR,占18.9%(7/37),ORR为48.6%(18/37)。HIV阴性组中14例患者达CR,占41.2%(14/34),ORR为70.6%(24/34)。经χ2检验,两组CR率比较差异有统计学意义(P<0.05),但ORR差异无统计学意义(P=0.06),见表 2。
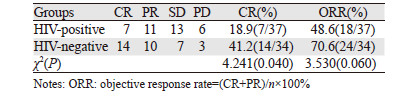
|
结果显示在HIV阳性和阴性组中,IPI低危(0~2)的患者其ORR均高于IPI中高/高危组(3~5)患者(P<0.05)。由于IPI中结外病变的评分只分为结外病变<1和结外浸润比为≥2,并没有对具体结外部位进行分析,因此本研究观察不同部位对近期疗效的影响。HIV阳性组胃肠道、肝、肺、骨髓浸润均对近期疗效产生影响,而HIV阴性组只发现骨髓侵润对近期疗效产生影响(P<0.05)。HIV阳性组中就诊时CD4+细胞数>200/mm3的患者ORR高于CD4+细胞数≤200/mm3患者(P<0.05),而就诊时是否处于HARRT治疗对近期疗效无影响(P>0.05),见表 3。本研究还进一步观察CD4+细胞数治疗前后变化与客观疗效关系:达到客观有效的患者,CD4+细胞数治疗前(241.8±146.5)/mm3,治疗后(347.7±151.4 )/mm3,其治疗后的CD4+细胞数有明显的上升(t=2.261,P=0.037);而未达到客观有效的患者,治疗前(169.5±103.5)/mm3,治疗后(185.4±52.0)/mm3 (t=0.7291,P=0.475),治疗前后CD4+细胞数差异无统计学意义。

|
2.3 不良反应比较
71例患者均未出现治疗相关死亡,结果显示:HIV阳性组更容易出现贫血、白细胞下降及合并感染(P<0.05)。HIV阳性组化疗中/化疗后发生感染10例(27.0%),而HIV阴性组只有3例(8.8%),见表 4。
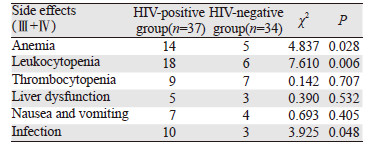
|
3 讨论
由于人类免疫缺陷病毒特异性地破坏辅助性T淋巴细胞,造成艾滋病(acquired immunodeficiency syndrome,AIDS)患者机体免疫功能低下,常常合并各种机会性感染和恶性肿瘤,在欧美国家的艾滋病相关肿瘤中,恶性淋巴瘤的发病率位居第二,仅次于卡波氏肉瘤[7-8]。而在亚洲国家,恶性淋巴瘤的发生率最高[9-10]。有效的HAART治疗能显著降低艾滋病患者恶性淋巴瘤的发生率,但仍高于普通人群[11-12]。Shiels等对1992—2009年中115 643名NHL患者观察发现:HIV阳性患者的主要病理类型为DLBCL(45.5%);HIV阴性的患者主要病理类型为DLBCL(33.6%)[4]。可见,DLBCL在HIV阳性和阴性患者中均为常见的病理类型,对比分析其临床特征、治疗效果及不良反应,具有重要的临床意义。
DLBCL临床表现复杂,主要为无痛性、进行性周围淋巴组织增生,临床上还可伴B症状及多系统、多器官受累等表现[13]。一般认为HIV阳性DLBCL主要体现在分期较晚,容易出现B症状,临床具有更强的侵袭性,结外受累常见[14-15]。但也有学者观察发现自HARRT应用于临床以来,其HIV阳性患者结外病变较前减少,接近于HIV阴性患者[16]。本研究结果显示HIV阳性组Ⅲ~Ⅳ期比例高,更容易出现B症状,IPI高于HIV阴性组,结外病变如胃肠道、肝、肺侵犯高于HIV阴性组,和既往观点一致。
艾滋病患者淋巴瘤化疗的最大问题是,严重的免疫抑制会导致化疗产生比平常更多的风险,常常导致患者治疗的终止甚至死亡。目前化疗+HAART已成为艾滋病淋巴瘤治疗的标准方案。其机制是接受HAART治疗的患者CD4+细胞计数可以在化疗结束后较快恢复,使得足量、规范化化疗成为可能[17-18]。利妥昔单抗(rituximab,R)用于HIV感染者仍存在争议。Kaplan等比较了CHOP方案和CHOP+R方案用于AIDS-DLBCL 患者治疗的疗效和安全性,完全应答率分别为47%和57.6%,其差异无统计学意义,而治疗相关性感染死亡率分别2%和14%,差异有统计学意义,据此他们认为R的加入虽然在一定程度上提高肿瘤对药物治疗的应答,但却会显著增加治疗相关性死亡[19]。而Diez-Martin等进一步研究则发现,CD4+细胞计数>100/mm3的AIDS-DLBCL患者加用R安全且增效[20]。因此目前含有R的治疗方案主要用在CD4+细胞数较高的患者。此外,也有学者认为如果患者对HARRT治疗存在病毒学应答(virological response),那么含有R的治疗方案可以明显增加疗效,改善预后[21]。由于当地卫生条件限制,本组资料统一采用CHOP方案治疗。结果显示两组客观有效率未见明显差异,支持化疗+HAART已使HIV阳性DLBCL疗效接近HIV阴性患者的结论。研究还发现HIV阴性组的CR率明显高于HIV阳性组,这可能和HIV阳性患者就诊时一般状态较差、分期较晚(Ⅲ~Ⅳ)、IPI更高有关。
目前对于HARRT治疗的时间仍存在争议,一般认为HARRT可以和化疗同时应用,安全有效[16, 22]。本研究中13例诊断时还未行HAART治疗的HIV阳性的DLBCL患者,先给予HARRT治疗,2周内再根据患者个体情况给予化疗,从而观察患者是否出现免疫重建炎症综合征(immune reconstitution inflammatory syndrome,IRIS)。IRIS是指HIV阳性患者在开始HAART后,尽管血浆HIV载量及CD4+细胞计数均有所改善,免疫重建过程中却出现HIV特征的机会性感染的病症,临床症状恶化,应避免在IRIS基础上进行化疗。本组13例患者和24例在诊断前已给予HARRT治疗的患者,在近期治疗效果上差异无统计学意义(P<0.05)。可见给予HARRT治疗后2周内开始化疗的方案并不影响患者近期疗效。
HIV阳性组更容易出现贫血、白细胞下降及继发感染,本研究HIV阳性组继发感染病例10例(27%),高于HIV阴性组3例(8.9%)。HIV阳性患者感染主要以呼吸系统、口腔和皮肤感染为主,10例感染均发生于CD4+细胞数≤200/mm3的患者,HIV患者本身免疫力低下,加上化疗药物引起的骨髓抑制是患者容易导致继发感染的重要原因。继发感染严重影响疗效,甚至可直接导致患者死亡,如何在化疗的同时,预防骨髓抑制及免疫力低下而引起的感染,是HIV阳性DLBCL治疗的重点。及时有效的抗感染及支持治疗是关键,对于CD4+细胞数低的患者,应预防性联合应用粒细胞-巨噬细胞集落刺激因子(GM-CSF),预防继发感染,保证化疗的顺利进行。
综上所述,DLBCL是艾滋病患者较常见的恶性肿瘤,与HIV阴性患者相比,其临床表现出更强的侵袭性,更易出现结外病变,患者就诊时往往已至中晚期。配合规范化的HARRT治疗,CHOP方案化疗可以使HIV阳性患者达到类似于HIV阴性患者的客观有效率,对改善患者的预后有积极的意义。HIV阳性DLBCL化疗继发感染仍是临床治疗重点。
| [1] | Achenbach CJ, Buchanan AL, Cole SR, et al. HIV viremia and incidence of non-Hodgkin lymphoma in patients successfully treated with antiretroviral therapy[J]. Clin Infect Dis, 2014, 58 (11) : 1599–606. |
| [2] | Vendrame E, Hussain SK, Breen EC, et al. Serum levels of cytokines and biomarkers for inflammation and immune activation, and HIV-associated non-Hodgkin B-Cell lymphoma risk[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23 (2) : 343–9. |
| [3] | Gopal S, Patel MR, Yanik EL, et al. Temporal Trends in presentation and survival for HIV-associated lymphoma in the antiretroviral therapy Era[J]. J Natl Cancer Inst, 2013, 105 (16) : 1221–9. |
| [4] | Shiels MS, Engels EA, Linet MS, et al. The epidemic of non– Hodgkin lymphoma in the United States:disentangling the effect of HIV, 1992-2009[J]. Cancer Epidemiol Biomarkers Prev, 2013, 22 (6) : 1069–78. |
| [5] | Ministry of health PRC, UNAIDS: The United Nations Joint Programme on HIV/AIDS, World Health Organization. AIDS epidemic Report 2011: HIV & AIDS in China[J]. Zhongguo Ai Zi Bing Xing Bing, 2012, 18 (1) : 1–5. [中华人民共和国卫生部, 联合国艾滋病规划署, 世界卫生组织. 2011年中国艾滋病疫情估计[J]. 中国艾滋病性病,2012, 18 (1) : 1–5. ] |
| [6] | Kandala NB, Campbell EK, Rakgoasi SD, et al. The geography of HIV/AIDS prevalence rates in Botswana[J]. HIV AIDS (Auckl), 2012, 4 : 95–102. |
| [7] | Ambinder RF, Bhatia K, Martinez-Maza O, et al. Cancer Biomarkers in HIV patients[J]. Curr Opin HIV AIDS, 2010, 5 (6) : 531–7. |
| [8] | Biggar RJ, Chaturvedi AK, Goedert JJ, et al. AIDS-related cancer and severity of immunosuppression in persons with AIDS[J]. J Natl Cancer Inst, 2007, 99 (12) : 962–72. |
| [9] | Dhir AA, Sawant S, Dikshit RP, et al. Spectrum of HIV/ AIDS related cancers in India[J]. Cancer Causes Control, 2008, 19 (2) : 147–53. |
| [10] | Zhang YX, Gui XE, Zhong YH, et al. Spectrum and survival of cancer of HIV-infected population[J]. Zhong Liu Yan Jiu Yu Lin Chuang, 2010, 22 (11) : 764. [张永喜, 桂希恩, 钟亚华, 等. 艾滋病病毒感染人群中恶性肿瘤的常见类型及生存分析[J]. 肿瘤研究与临床,2010, 22 (11) : 764. ] |
| [11] | Polesel J, Clifford GM, Rickenbach M, et al. Non-Hodgkin lymphoma incidence in the Swiss HIV Cohort Study before and after highly active antiretroviral therapy[J]. AIDS, 2008, 22 (2) : 301–6. |
| [12] | Chen CH, Chung CY, Wang LH, et al. Risk of cancer among HIVinfected patients from a population-based nested case-control study: implications for cancer prevention[J]. BMC Cancer, 2015, 15 : 133. |
| [13] | Zhao Q, Hou J. New prognostic factors of diffuse large B-cell lymphoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2013, 40 (6) : 514–6. [赵茜, 侯健. 弥漫大B细胞淋巴瘤预后相关因素研究进展[J]. 肿瘤防治研究,2013, 40 (6) : 514–6. ] |
| [14] | Baptista MJ, Garcia O, Morgades M, et al. HIV-infection impact on clinical-biological features and outcome of diffuse large B-cell lymphoma treated with R-CHOP in the combination antiretroviral therapy era[J]. AIDS, 2015, 29 (7) : 811–8. |
| [15] | Raffetti E, Donato F, Castelli F, et al. The prognostic role of systemic inflammatory markers on HIV-infected patients with non-Hodgkin lymphoma, a multicenter cohort study[J]. J Transl Med, 2015, 13 : 89. |
| [16] | Navarro JT, Vall-Llovera F, Mate JL, et al. Decrease in the frequency of meningeal involvement in AIDS-related systemic lymphoma in patients receiving HAART[J]. Haematologica, 2008, 93 (1) : 149–50. |
| [17] | Barta SK, Xue X, Wang D, et al. Treatment factors affecting outcomes in HIV-associated non-Hodgkin lymphomas: a pooled analysis of 1546 patients[J]. Blood, 2013, 122 (19) : 3251–62. |
| [18] | Antinori A, Cingolani A, Alba L, et al. Better response to chemotherapy and prolonged survival in AIDS-related lymphomas responding to highly active antiretroviral therapy[J]. AIDS, 2001, 15 (12) : 1483–91. |
| [19] | Kaplan LD, Lee JY, Ambinder RF, et al. Rituximab does not improve clinical outcome in a randomized phase 3 trial of CHOP with or without rituximab in patients with HIV-associated non- Hodgkin lymphoma: AIDS-Malignancies Consortium Trial 010[J]. Blood, 2005, 106 (5) : 1538–43. |
| [20] | Diez-Martin JL, Balsalobre P, Re A, et al. Comparable survival between HIV+ and HIV- non-Hodgkin and Hodgkin lymphoma patients undergoing autologous peripheral blood stem cell transplantation[J]. Blood, 2009, 113 (23) : 6011–4. |
| [21] | Ribera JM, Oriol A, Morgades M, et al. Safety and efficacy of cyclophosphamide, adriamycin, vincristine, prednisone and rituximab in patients with human immunodeficiency virusassociated diffuse large B-cell lymphoma: results of a phaseⅡ trial[J]. Br J Haematol, 2008, 140 (4) : 411–9. |
| [22] | Weiss R, Mitrou P, Arasteh K, et al. Acquired immunodeficiency syndrome-related lymphoma: simultaneous treatment with combined cyclophosphamide, doxorubicin, vincristine, and prednisone chemotherapy and highly active antiretroviral therapy is safe and improves survival-results of the German Multicenter Trial[J]. Cancer, 2006, 106 (7) : 1560–8. |
 2016, Vol. 43
2016, Vol. 43
