文章信息
- 系统生物学方法研究金龙胶囊逆转A549细胞对紫杉醇耐药的机制
- Mechanism of Jinlong Capsule Reversing Paclitaxel Resistance of A549 Cells Investigated by System Biology Technology
- 肿瘤防治研究, 2016, 43(5): 360-365
- Cancer Research on Prevention and Treatment, 2016, 43(5): 360-365
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.05.009
- 收稿日期: 2016-01-02
- 修回日期: 2016-02-22
2. 100050 北京,中国医学科学院/北京协和医学院药物研究所
2. Institute of Material Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
目前,恶性肿瘤的治疗以手术、放疗和化疗为主,其中放化疗已成为当前治疗肿瘤并防止肿瘤术后复发的主要手段。化疗后残存的肿瘤细胞耐药性形成,常导致对某些药物治疗敏感度的降低,并引起肿瘤复发甚至转移,成为肿瘤治疗的一大障碍。体外实验证实耐药性逆转剂多具有依赖性毒副作用[1],而且作用靶点单一,临床应用受到限制。近年来,部分中药的活性成分被证实具有逆转肿瘤细胞耐药性的作用。研究[2]证明金龙胶囊可有效抑制肿瘤复发转移,增加化疗药物效果,减轻不良反应。前期基础研究表明,金龙胶囊可有效逆转人肺腺癌A549耐紫杉醇耐药细胞对紫杉醇的耐药作用,以增加紫杉醇对癌细胞的杀伤作用,但其作用机制尚不清楚[3]。
中药成分复杂,具有多靶点、多环节、多通路的特点,其药效发生机制一直是研究者长期从事的热点课题之一。传统的研究手段具有一定的局限性和片面性[4]。基因组学技术可一次性获取大量基因信息,但对结果的分析却受到很大限制[5]。系统生物学[6]是一种整合型大科学,它将系统内不同性质的构成要素(基因、mRNA、蛋白质、生物小分子等)整合在一起进行研究。其以系统性和整体性为指导理念,研究细胞信号转导和基因调控网络、生物系统组成之间相互关系的结构和系统功能。本研究利用系统生物学技术对金龙胶囊干预后的基因组学结果进行分析,以推测其逆转耐药的分子机制。
1 材料与方法 1.1 实验材料金龙胶囊(北京建生药业有限公司,批号120527);细胞培养液溶解,0.22 μm滤膜过滤,现用现配;多烯紫杉醇(paclitaxel,北京协和药厂馈赠,白色粉末,纯度>99%);维拉帕米(VRP,美国Sigma产品,白色粉末,纯度>99%);人肺腺癌耐紫杉醇耐药细胞A549/Paclitaxel及其亲本细胞A549(中国医学科学院药物研究所购买培养);Human Genome U133 Plus 2.0基因芯片(Affymetrix公司,美国);MetaCore系统生物学分析平台(汤森路透科技集团,美国)。
1.2 方法 1.2.1 逆转倍数测定取对数生长期A549细胞和耐紫杉醇药株肿瘤细胞A549/Paclitaxel接种于96孔细胞培养板中。24 h后,加入不同浓度的金龙胶囊和(或)抗肿瘤药物,以VRP为阳性对照药,每个浓度设3个平行孔。培养72 h,弃原培养液,每孔加入0.5 mg/ml MTT液100 μl。继续培养4 h,弃去MTT液,每孔加入DMSO 150 μl,混合振荡,于酶标仪570 nm波长处测定吸光度值。上述实验重复3次。细胞存活率(%)=OD给药组/OD对照组×100%。利用Graphpad Prism6.0软件计算IC50值。逆转倍数(reversal fold,RF)=IC50抗肿瘤药物/IC50抗肿瘤药物+金龙胶囊,实验重复3~5次。
1.2.2 基因芯片检测取耐药细胞株A549/Paclitaxel、400 μg/ml金龙胶囊干预A549/Paclitaxel后的细胞样本,提取总RNA,使用RT-PCR方法反转录合成cDNA,体外转录合成生物素标记的cRNA,并进行cRNA纯化。后续检测方法参考文献[18]中2.1基因芯片检测。
1.2.3 差异基因分析运用鲁棒的多芯片平均(Robust Multichip Average,RMA)算法对取得的基因表达原始数据信息进行归一化处理[7]。将400 μg/ml金龙胶囊干预后的耐药细胞A549/Paclitaxel基因表达信息与无药物干预的耐药细胞A549/Paclitaxel基因表达信息进行比对,取得差异基因表达谱,同时计算每个差异表达基因的差异倍数。
1.2.4 拓扑基因分析采用网络拓扑评分算法:一步过连通测算和多步骤隐藏节点测算,挖掘对差异基因直接发挥调控作用的因子和间接发挥调控作用的重要远端因子,即“拓扑重要基因”(topologically significant genes),每个拓扑基因均进行统计学显著性水平评价。
1.2.5 通路及生物学功能分析采用富集分析方法,探讨差异基因和拓扑基因在GeneGo数据库和公共数据库中所涉及的各项生物功能,包括范式通路(GeneGo Canonical Pathway map)、生物学过程网络(GeneGo Process Networks)、疾病表面标志物(GeneGo Disease Biomarkers)、毒理网络(Toxicity Networks)、生物学过程(Gene Ontology processes)、分子功能(Gene Ontology molecular functions)和细胞定位(Gene Ontology localizations)。每个项目的基因富集程度用以下公式进行计算(富集水平与p-value值成反比)。N为检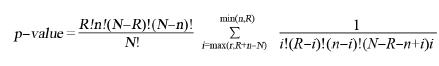
以细胞或组织的特定响应为依据,将以上差异基因、拓扑基因、通路和生物学功能的分析内容进行整合,借助使用MetaCore平台[8]上的人工注释系统(蛋白、蛋白间相互作用关系、通路)、运算工具包和滤器来构建一个涵盖疾病、毒理、药物响应、分子过程等信息的可视化模型,即药物机制网络图。机制网络图的构建主要涉及以下两个方面:(1)对多个信号通路综合进行构建,来揭示组织或细胞对药物的特定响应是怎样产生的;(2)将与产生这种特定响应相关的关键条目整合入通路中,来构建一个系统的机制模型图。
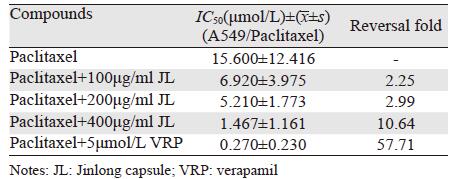
2 结果 2.1 逆转倍数的测定金龙胶囊在100、200、400 μg/ml无毒浓度对A549/Paclitaxel对紫杉醇的获得性耐药有一定的逆转活性,逆转倍数(RF)分别为2.25、2.99和10.64,见表 1。
 |
2.2 差异基因分析结果
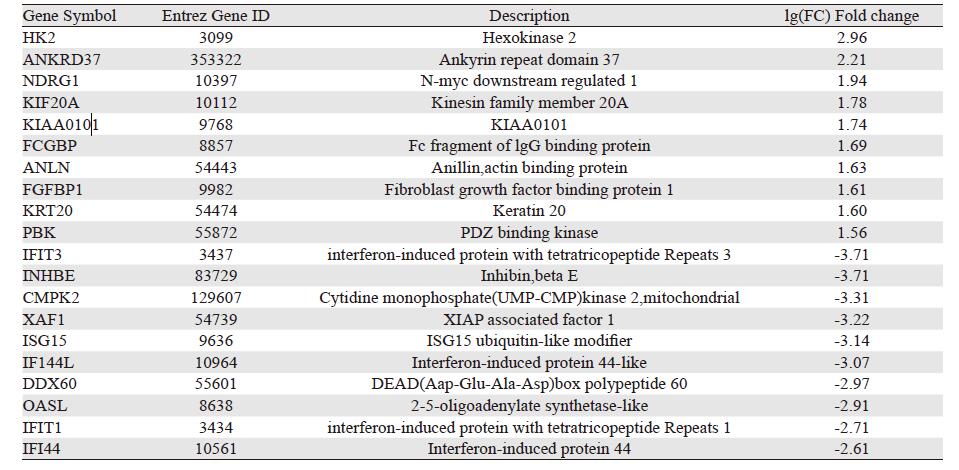
将高剂量(400 μg/ml)金龙胶囊干预后的耐药细胞A549/Paclitaxel基因表达信息与无药物干预的耐药细胞A549/Paclitaxel基因表达信息进行比对,选取差异倍数大于2的差异基因,共有203个,其中上调基因86个,下调基因117个,见表 2。
2.3 拓扑基因分析结果
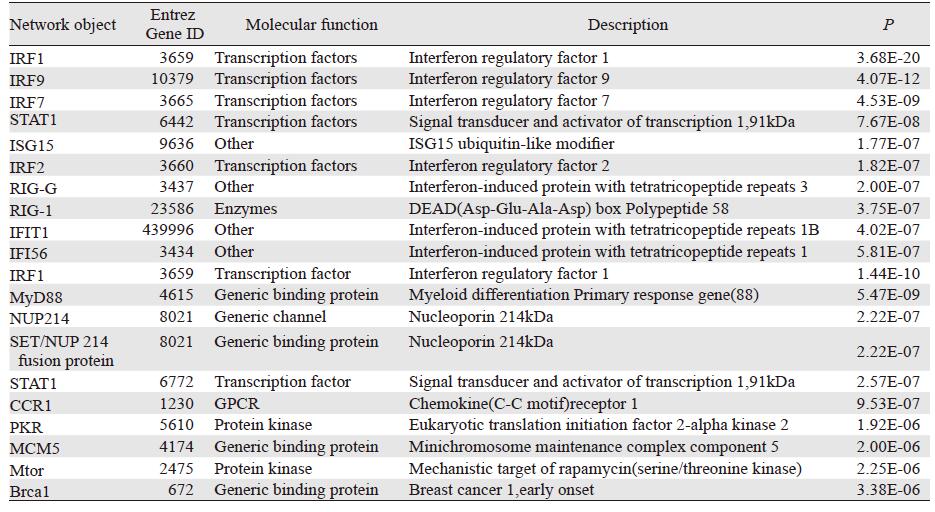
对以上差异基因进行一步过连通测算和多步骤隐藏节点分析,得到132个一步过连通拓扑基因和284个多步骤拓扑基因,见表 3。
 |
2.4 通路及生物学功能分析
差异基因和拓扑基因在7个项目中的富集分析结果中,选取显著性高的条目(P < 0.05),最终得到6条范式通路和7个关键生物学网络,见表 4。
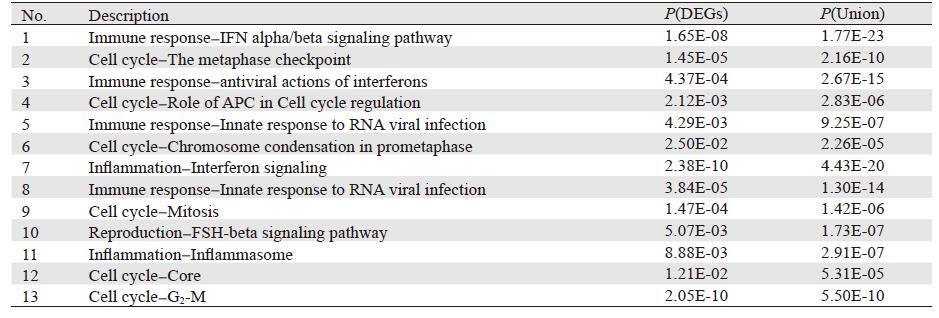 |
2.5 机制网路图的构建
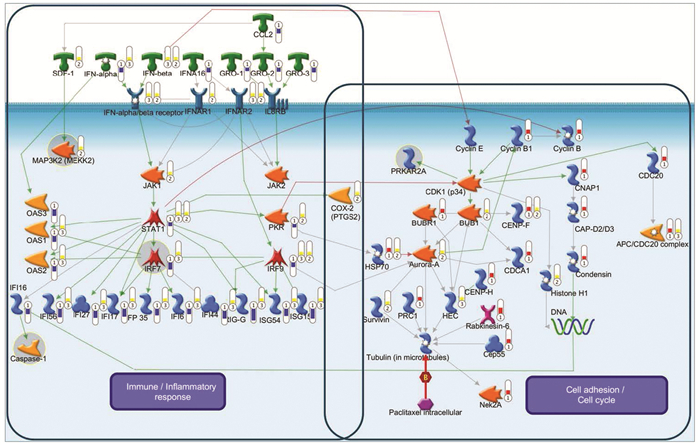
对信号通路综合分析,并将关键生物功能进行整合,从而构建金龙胶囊逆转A549耐紫杉醇耐药细胞系的机制网络图,见图 1。网络图提示金龙胶囊的作用主要集中在对细胞周期相关基因的上调(CyclinB、HSP70、Aurora-A、Survivin等)和免疫应答相关基因的下调(IFN-α、IFN-β、STAT1、IRF7、IFI16等)。系统生物学结果提示A549/Paclitaxel耐药细胞系中的细胞周期相关基因及免疫应答基因的表达量较A549亲本细胞系中分别有明显下调趋势和上调趋势,见图 2,而金龙胶囊通过上调细胞周期相关基因,在细胞面对紫杉醇与微管结合所引发的阻断T细胞正常分裂的情况时,使微管保持稳定状态的作用。而这种细胞周期基因的上调效应可能是由IFN的低表达而触发,而它也同样触发了免疫应答的下调。以上结果与之前研究中所报道的某些蛋白通过调控微管从而影响细胞凋亡及有丝分裂监测点的蛋白表达相吻合[9]。
|
| ①: Differentially expressed proteins between A549/Paclitaxel+Jinlong capsule and A549/Paclitaxel cell lines; ②,③: corresponding topologically significant proteins 图 1 金龙胶囊逆转A549耐紫杉醇耐药细胞系的机制网络图 Figure 1 Causal network model of mechanism of Jinlong capsule reverse resistance of A549 cell lines to Paclitaxel |

|
| ①: Differentially expressed proteins between A549/Paclitaxel and A549 cell lines; ②,③: corresponding topologically significant proteins 图 2 A549耐紫杉醇耐药细胞系的机制网络图 Figure 2 Causal network model of mechanism of resistance of A549 cell lines to Paclitaxel |
3 讨论
紫杉醇是一种抗微管药物,它可以特异性地结合到小管的β位上,使微管聚合成团块或束状并保持稳定,从而影响微管网的正常重组,导致细胞凋亡[10]。研究发现,一些人类肿瘤组织或肿瘤细胞系对紫杉醇的耐药机制中,即包括微管动力学的改变[11, 12]和细胞周期的紊乱[13]。金龙胶囊逆转紫杉醇耐药的机制网络图显示,金龙胶囊可调控细胞周期相关基因,这些基因相互影响并最终作用于微管蛋白,这可能是A549耐紫杉醇耐药细胞的耐药性被逆转的机制之一。既往的研究结果显示,金龙胶囊对高转移肝癌细胞系MHCC97H[14]、人胰腺癌细胞BXPC-3[15]、脑肿瘤细胞U87[16]细胞周期均有不同程度影响,与上述结果相符。金龙胶囊逆转紫杉醇耐药的机制网络图提示,金龙胶囊的另一作用集中在对免疫/炎性应答、IFN信号通路相关基因的调控,推测是其逆转紫杉醇耐药的另一重要机制。干扰素(Interferon,IFN)是一种可发挥抗病毒、抗增殖、抗肿瘤以及免疫调节作用等多种生物功能的细胞因子[17, 18],但其抑制DNA合成的作用建立在未受损伤的微管网上。研究表明,IFN可使微管蛋白-α和-βmRNA表达量上调[19],IFN-α和IFN-γ可以促进微管重组[20],而微管蛋白的过表达会导致肺癌耐药及预后不佳,推测IFN和抗微管药物在微管重组中发挥着相反的作用[21]。因此,如何下调免疫应答相关基因的表达即为关键。同时,干扰素调控通路蛋白,如干扰素调控蛋白16(interferon-inducible 16,IFI16),的高表达与肿瘤细胞对紫杉醇的耐药有关[22, 23]。紫杉醇影响微管装配和微管蛋白的表达,虽然IFN信号通路在这方面作用仍不甚清楚,并且不能只从表达量上简单推理,但是,IFN信号通路的作用强烈而明显,其在细胞分裂晚期对于紫杉醇耐药的作用极为关键。既往研究表明,金龙胶囊可增强荷瘤小鼠T、B淋巴细胞的转化,改善抗体效应B细胞的功能,提高免疫受抑小鼠淋巴细胞亚群含量等,在一定程度上验证了上述分析结果。以上结果为今后进一步探讨金龙胶囊的作用机制提供了重要参考。
本研究采用一步过连通测算和多步骤隐藏节点分析,分析与差异基因中有一步连通性的调控因子,同时可挖掘出通过多个步骤测算得到的与输入文件某特定化合物中有高水平连通的隐藏节点,找到对差异基因直接发挥调控作用的节点和间接发挥调控作用的重要远端因子。机制网络图的构建是整个机制分析中重要的一环。本项目借助MetaCore平台上的人工注释系统,以关键通路图作为搭建网络图的主要框架,并基于真核生物的信号通路来完成分析,即由配体和受体的结合而触发,通过细胞内级联反应激活转录因子和调控效应基因,最终决定细胞的表型。这些方法和技术也为其他中药复方分子机制研究提供了一种崭新的符合中药研究特点的借鉴。
致谢
感谢博奥生物有限公司在基因芯片检测上及汤森路透科技信息服务(北京)有限公司在系统生物学分析上给予的帮助!
| [1] | Sun XL, Ge XD. Research progress of tumor multidrug resistance reversal agents[J]. Guangzhou Yi Xue Yuan Xue Bao, 2008, 34 (6) : 60–3. [孙秀玲, 盖晓东. 肿瘤多药耐药逆转剂的研究进展[J]. 广州医学院学报,2008, 34 (6) : 60–3. ] |
| [2] | Liu YQ, Gao J, Zhao XM, et al. The experimental observation of the inhibition of tumor cell metastasis and recurrence by JLC[J]. Zhongguo Zhong Liu Sheng Wu Zhi Liao Za Zhi, 2001, 8 (1) : 65–6. [刘玉琴, 高进, 赵雪梅, 等. 金龙胶囊(JLC)抑制癌细胞转移及复发的实验观察[J]. 中国肿瘤生物治疗杂志,2001, 8 (1) : 65–6. ] |
| [3] | Qu YY, Yue GJ, Li JS, et al. Effect of Jinlong Capsules on Reversing Paclitaxel-resistance Vincritine-resistance and Enhancing Sensitivity in Human Cancer Cell Lines[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41 (8) : 884–7. [曲育莹, 岳贵娟, 李建生, 等. 金龙胶囊对耐紫杉醇及长春新碱肿瘤细胞株的逆转及增敏作用[J]. 肿瘤防治研究,2014, 41 (8) : 884–7. ] |
| [4] | Liu WT, Li LH, Dai J. Thinking Way and Methods of the Biochip Technology and Chinese Herbs Action Mechanisms[J]. Zhongguo Zhong Yi Ji Chu Yi Xue Za Zhi, 2008, 14 (11) : 845–7. [刘文泰, 李丽华, 戴军. 生物芯片技术与中药作用机制研究的思路与方法[J]. 中国中医基础医学杂志,2008, 14 (11) : 845–7. ] |
| [5] | Li W, Yin LP. Concept and research advance on genomics[J]. Sheng Wu Xue Tong Bao, 2000, 35 (11) : 1–3. [李伟, 印莉萍. 基因组学相关概念及其研究进展[J]. 生物学通报,2000, 35 (11) : 1–3. ] |
| [6] | Li SW. Application of system biology in cancer research[J]. Shi Jie Ke Xue, 2011, 2 (10) : 41–6. [李升伟. 癌症研究中的系统生物学应用[J]. 世界科学,2011, 2 (10) : 41–6. ] |
| [7] | Dezso Z, Nikolsky Y, Nikolskaya T, et al. Identifying disease-specific genes based on their topological significance in protein networks[J]. BMC Syst Biol, 2009, 3 : 36. |
| [8] | Nikolsky Y, Kirillow E, Zuev R, et al. Functional analysis of OMICs data and small molecule compounds in an integrated “knowledge-based” platform[J]. Methods Mol Biol, 2009, 563 : 177–96. |
| [9] | Yusuf RZ, Duan Z, Lamendola DE, et al. Paclitaxel resistance: molecular mechanisms and pharmacologic manipulation[J]. Curr Cancer Drug Targets, 2003, 3 (1) : 1–19. |
| [10] | Zaffaroni N, Silvestrini R, Orlandi L, et al. Induction of apoptosis by taxol and cisplatin and effect on cell cycle-related proteins in cisplatin-sensitive and -resistant human ovarian cells[J]. Br J Cancer, 1998, 77 (9) : 1378–85. |
| [11] | Dumontet C, Sikic BI. Mechanisms of action of and resistance to antitubulin agents: microtubule dynamics, drug transport, and cell death[J]. J Clin Oncol, 1999, 17 (3) : 1061–70. |
| [12] | Drukman S, Kavallaris M. Microtubule alterations and resistance to tubulin-binding agents (review)[J]. Int J Oncol, 2002, 21 (3) : 621–8. |
| [13] | Tan M, Jing T, Lan KH, et al. Phosphorylation on tyrosine-15 of p34(Cdc2) by ErbB2 inhibits p34(Cdc2) activation and is involved in resistance to taxol-induced apoptosis[J]. Mol Cell, 2002, 9 (5) : 993–1004. |
| [14] | Li LX, Ye SL, Wang YH, et al. Jinlong Capsule high metastasis inhibitory effect on human hepatocellular carcinoma cell line metastasis[J]. Gan Zang, 2011, 16 (3) : 240–1. [李立新, 叶胜龙, 王艳红, 等. 金龙胶囊对人肝癌高转移细胞系转移的抑制作用[J]. 肝脏,2011, 16 (3) : 240–1. ] |
| [15] | Li YY. Studying the impact of proliferation and apoptosis of Jinlong Capsule on human pancreatic cancer BXPC-3 cells[D].Beijing: Beijing Zhong Yi Yao Da Xue, 2012. [李要远. 金龙胶囊对人胰腺癌细胞BXPC-3增殖和凋亡的影响[D]. 北京:北京中医药大学, 2012.] |
| [16] | Huang H, Cui XW, Yue GJ, et al. Treatment of gliomatosis cerebri growth with Jinlong Capsules[J]. Zhong Cheng Yao, 2013, 35 (9) : 39–43. [黄卉, 崔向微, 岳贵娟, 等. 金龙胶囊治疗脑肿瘤药理机制研究[J]. 中成药,2013, 35 (9) : 39–43. ] |
| [17] | Parmar S, Platanias LC. Interferons: mechanisms of action and clinical applications[J]. Curr Opin Oncol, 2003, 15 (6) : 431–9. |
| [18] | Platanias LC. Mechanisms of type-Ⅰ- and type-Ⅱ-interferon-mediated signalling[J]. Nat Rev Immunol, 2005, 5 (5) : 375–86. |
| [19] | Fellous A, Ginzburg I, Littauer UZ. Modulation of tubulin mRNA levels by interferon in human lymphoblastoid cells[J]. EMBO J, 1982, 1 (7) : 835–9. |
| [20] | Ward LD, Arakawa T. Stimulation of microtubule assembly by recombinant human interferon-alpha and interferon-gamma[J]. Biochim Biophys Acta, 1989, 1012 (3) : 317–9. |
| [21] | Ebsworth N, Rozengurt E, Taylor-Papadimitriou J. Microtubule-disrupting agents reverse the inhibitory effect of interferon on mitogenesis in 3T3 cells[J]. Exp Cell Res, 1986, 165 (1) : 255–9. |
| [22] | Bani MR, Nicoletti MI, Alkharouf NW, et al. Gene expression correlating with response to paclitaxel in ovarian carcinoma xenografts[J]. Mol Cancer Ther, 2004, 3 (2) : 111–21. |
| [23] | Luker KE, Pica CM, Schreiber RD, et al. Overexpression of IRF9 confers resistance to antimicrotubule agents in breast cancer cells[J]. Cancer Res, 2001, 61 (17) : 6540–7. |
 2016, Vol. 43
2016, Vol. 43