文章信息
- miR-138靶向调控PDK1基因抑制人结肠癌SW620细胞侵袭
- Role of miR-138 in Invasion of Human Colon Cancer Cells SW620 by Regulating PDK1 Expression
- 肿瘤防治研究, 2016, 43(5): 340-344
- Cancer Research on Prevention and Treatment, 2016, 43(5): 340-344
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.05.005
- 收稿日期: 2015-07-31
- 修回日期: 2015-12-10
结直肠癌是临床最常见的恶性肿瘤之一,由于生活习惯和饮食结构的改变,其发病率和死亡率逐年升高。手术和化疗是结直肠癌的常规治疗手段,但是对于中晚期结直肠癌患者,手术效果差,化疗面临耐药问题,因此,探寻治疗结直肠癌的新方法探索其发病机制在当前是迫切的。丙酮酸脱氢酶激酶-1(pyruvate dehydrogenase kinase-1,PDK1)是细胞糖酵解关键限速酶丙酮酸脱氢酶的调节酶,在其磷酸化过程中发挥重要的功能。研究发现PDK1除具有糖代谢酶的催化活性,对拮抗细胞凋亡还有一定的影响,药物抑制PDK1可诱导肿瘤细胞凋亡[1]。体外细胞培养显示PDK1在头颈部癌、非小细胞肺癌、乳腺癌等细胞中表达增高[2-4]。MicroRNA(miRNA)是一类非编码RNA,长度大约为21~25 nt,通过与靶基因mRNA 3'端非翻译区(3'UTR)互补,降解目的基因并下调其表达[5],以此参与疾病发生过程中基因表达的调控。
本研究应用生物信息学对miR-138-5p(简称:miR-138)和PDK1基因的靶向匹配关系进行预测并通过双荧光素酶报告基因系统鉴定;转染miR-138模拟物进入人结肠癌SW620细胞后,qRT-PCR和Western blot检测转染后miR-138和PDK1的表达,阐明miR-138对PDK1基因表达的调控作用;Transwell小室检测癌细胞体外的侵袭性,拟从分子水平上揭示miRNA对肿瘤生物学行为的影响。
1 材料与方法 1.1 材料HG-DMEM和RPMI 1640培养液、胎牛血清(FBS)和胰蛋白酶购于美国Hyclone公司,兔抗人PDK1抗体购于美国Santa Cruz公司,人结肠癌SW620细胞购于上海生物细胞研究所。
1.2 SW620细胞培养及免疫荧光检测PDK1表达SW620细胞在25 cm2培养瓶内,于37℃、5%CO2培养箱中培养,每2~3 d换一次液,待细胞达到80%融合后,用0.25%胰酶和0.02%EDTA消化并传代。取适量细胞涂片,10%甲醛固定后,0.1%BSA封闭1 h,加兔抗人PDK1抗体,室温孵育1 h,PBS冲洗3次,每次5 min,二抗加TRITC标记山羊抗兔IgG抗体(1:200),DAPI复染细胞核。
1.3 生物信息学预测应用靶基因预测软件miRanda和TargetScan对miR-138和PDK1基因的靶向匹配关系进行预测。
1.4 miR-138靶基因PDK1的鉴定 1.4.1 PDK1 3’UTR的克隆向SW620细胞加入TRIzol提取总RNA,利用反转录试剂盒(TaKaRa)反转录为cDNA,应用正向引物5' ccgagctcatttgtccaccagcatta 3’和反向引物5' gctctagaaagccagccagtatttta 3’扩增PDK1 3’UTR,电泳检测PCR产物,并克隆到pMD 18-T 载体(TaKaRa)上,测序。PDK1 3’UTR突变体(3’UTRmu)的构建严格按照定点突变试剂盒(QuickChange site-directed mutagenesis kit,Stratagene)要求完成。
1.4.2 PDK1 3’UTR-pmirGLO载体的构建应用XbaⅠ和SacⅠ双酶切pmirGLO质粒(Promega)、PDK1 3’UTR以及3’UTRmu片段,应用DNA 连接试剂盒(TaKaRa)连接酶切片段,构建荧光素酶报告载体,转化入大肠杆菌DH5α感受态细胞(TaKaRa)中扩增,应用质粒提取试剂盒(Axygen)从菌液中提取重组质粒。
1.4.3 荧光素酶检测BMSCs细胞培养在含10% FBS的DMEM培养液中,胰酶消化细胞并铺板,密度达到90%~95%进行转染。对于每孔细胞,应用脂质体2000(Invitrogen)转染PDK1 3’UTR-pmirGLO或3’UTRmu-pmirGLO 200 ng以及miR-138模拟物(GenePharma)或对照miRNA 30 nM,24 h后根据Dual-Luciferase®报告基因检测系统(Promega)说明检测荧光强度。
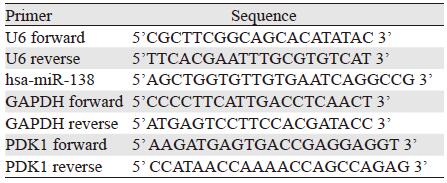
1.5 qRT-PCR检测miR-138及PDK1的表达取转染miR-138模拟物的SW620细胞以及空白对照组细胞,分别加入TRIzol或RNAiso for small RNA(TaKaRa)提取总mRNA或总miRNA,反转录得到cDNA,稀释4倍后加入SYBRR Premix Ex TaqTM Ⅱ(TaKaRa)和引物,见表 1。在实时定量PCR仪上进行40个循环的PCR反应,应用软件对反应结果进行定量分析。
1.6 Western blot检测PDK1蛋白表达量
取转染miR-138模拟物的SW620细胞以及空白对照组细胞,分别加入RIPA裂解液超声破碎,4℃离心25 min,用BCA法测定蛋白含量。SDS-PAGE分离样品并转膜,4%BSA封闭1 h后加入兔抗人PDK1抗体(1:200),4℃过夜后,滴加二抗(1:1 000),4℃摇床1 h,应用凝胶成像系统ECL发光显影。
1.7 Transwell检测SW620细胞体外侵袭将转染miR-138模拟物的SW620细胞以及空白对照组细胞加入无血清培养液置入Transwell上室中,下室加入含10%FBS的RPMI 1640培养液,24 h后取出小室,用甲醇固定小室反面细胞20 min,于结晶紫染液中染色15 min。光学显微镜下取3个随机视野计算穿膜细胞数。
1.8 统计学方法应用SPSS 13.0统计软件处理数据,以均数±标准差(x± s)表示,组间比较进行t检验,以P<0.05为差异有统计学意义。
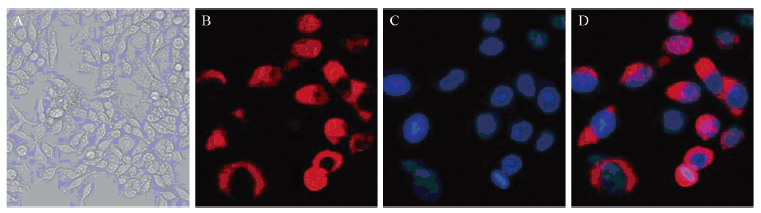
2 结果 2.1 SW620细胞形态学观察倒置相差显微镜下可见人结肠癌SW620细胞均匀分布,形态规则均一,见图 1A;细胞免疫荧光显示细胞内有PDK1蛋白的表达,显示红色荧光,见图 1B~1D。
|
| A: light microscope observation of SW620 cells (×200); B: immunofluorescent staining of PDK1 (×400); C: DAPI staining of cell nuclei (×400);D: merge (×400); DAPI: 4'6-cliamidino-2-phenylindde 图 1 SW620细胞光学显微镜和免疫荧光观察 Figure 1 Light microscope observation and immunofluorescent staining of SW620 cells |
2.2 miR-138和PDK1的匹配关系
为寻找miR-138和PDK1(NM_002610 )基因的靶向匹配关系,分别运用TargetScan和miRanda进行预测,TargetScan显示miR-138在PDK1 mRNA 3’UTR上有一个保守的靶位点,其类型为8 mer,匹配得分为93。miRanda结果表明,miR-138与靶位点的mirSVR得分为-0.7625,二者均表明miR-138与PDK1匹配良好,见表 2。
2.3 miR-138可下调PDK1的表达
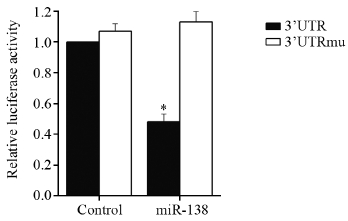
双荧光素酶报告基因系统检测结果显示如果将对照组(control)PDK1 3’UTR-pmirGLO的荧光素酶表达水平设定为1,miR-138能使其荧光素酶表达水平下降为(48.31±4.97)%,差异有统计学意义(t=2.467,P=0.013),见图 2。而control组3’UTRmu-pmirGLO的荧光素酶表达水平是3’UTR 的(1.07±0.05)倍,转染miR-138模拟物后,其表达水平为(1.13±0.07)倍,两者与control组相比差异均无统计学意义。由此可见,miR-138通过靶向作用于PDK1 mRNA 3’UTR能够负性调控PDK1基因的表达。
|
| The luciferase activity of 3’UTR in control group was used as control and arbitrarily defined as 1; *: P<0.05, compared with control group 图 2 miR-138组和对照组荧光素酶相对活性 Figure 2 Relative luciferase activity of miR-138 group and control group |
2.4 转染后miR-138和PDK1基因的相对表达
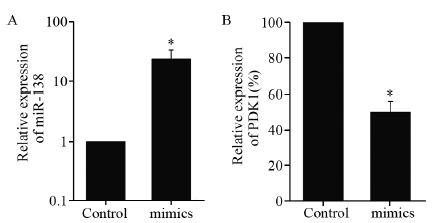
应用qRT-PCR对转染miR-138模拟物的SW620细胞进行检测,发现如果将空白对照组(control)SW620细胞miR-138的表达量设定为1,则转染组(mimics)细胞是control组的(23.89±9.62)倍,差异有统计学意义,见图 3A。如果将control组PDK1 mRNA的表达量设定为100%,转染后发现PDK1 mRNA的表达量下降至(49.93±6.09)%,差异有统计学意义,见图 3B。结果表明过表达miR-138能够导致PDK1 mRNA表达的下降,与荧光素酶报告系统检测结果相符。
|
| The expression of miR-138 and PDK1 mRNA were normalized to U6 and Gapdh respectively. The gene expression of control group was arbitrarily defined as 1 or 100%; *: P<0.05, compared with control group 图 3 转染后miR-138和PDK1 mRNA的相对表达 Figure 3 Relative expression level of miR-138 and PDK1 mRNA after transfection |
2.5 转染后PDK1蛋白的表达量
应用Western blot对转染miR-138模拟物的SW620细胞进行检测,条带结果显示转染组(mimics)PDK1蛋白表达量较空白对照组(control)明显降低,见图 4,表明miR-138的过表达能够抑制SW620细胞PDK1蛋白的生成,提示miR-138通过靶向作用于PDK1 mRNA 3’UTR能够负性调控PDK1基因的表达。
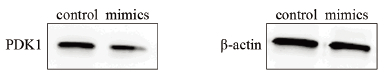
|
| 图 4 转染miR-138模拟物后PDK1蛋白的表达 Figure 4 Expression level of PDK1 protein after transfection of miR-138 mimics |
2.6 miR-138抑制SW620细胞的侵袭
Transwell小室检测SW620细胞的体外侵袭能力,发现转染组(mimics)的穿膜细胞数(58.41±9.92)较空白对照组(171.23±15.87)明显降低,差异有统计学意义(t=2.120,P=0.025),见图 5。结果表明miR-138的过表达能够抑制SW620 细胞的体外侵袭能力。由此可见,miR-138通过靶向作用于PDK1基因能够抑制SW620细胞的侵袭。
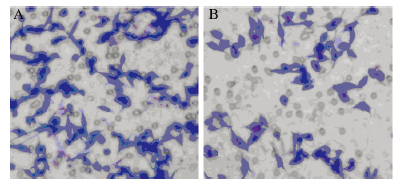
|
| A: control; B: mimics 图 5 Transwell检测SW620细胞的侵袭力 Figure 5 Invasion of SW620 cells detected by Transwell assay |
3 讨论
PDK1与细胞的代谢、增殖和凋亡有关,在细胞信号转导通路中起关键作用。有研究证明结直肠癌、乳腺癌、胶质母细胞瘤和甲状腺癌等恶性肿瘤与PDK1介导的信号通路异常有关[6-8]。Carón等[9]研究发现PDK1在结直肠癌HCT116细胞系中的活性较高,通过阻断PI3K/PDK1/Akt信号通路,不仅能够抑制癌细胞增殖,并能增加细胞对放疗的敏感度。Arico等[10]研究发现通过抑制结直肠癌HT-29细胞系中PDK1基因的表达,能够诱导肿瘤细胞发生凋亡。以上两个研究均表明,结直肠癌细胞的增殖和药物诱导的癌细胞凋亡与PDK1及其介导的信号转导通路有关。本研究发现光学显微镜下可见人结肠癌SW620细胞均匀分布,形态规则均一;细胞免疫荧光显示细胞内有PDK1蛋白的表达,显示红色荧光。
MicroRNA已被证实与结肠癌密切相关,且能够靶向调控癌症相关转录因子影响癌细胞的生物学行为。Akao等[11]发现let-7在结肠癌组织中表达降低,阻断RAS和C-myc信号通路,能够抑制癌细胞生长。Tazawa等[12]发现miR-34a通过调节E2F和p53信号通路抑制癌细胞增殖,表明miR-34a与结肠癌关系密切。Nagel等[13]发现miR-135通过抑制APC基因表达,进而调控Wnt/β-catenin信号通路,促进结肠癌细胞侵袭。最近,Wang等[14]研究发现黄曲霉素B1能够诱导气道上皮BEAS-2B细胞发生恶性转化,在此过程中,miR-138-1表达异常,miR-138-1的过表达能够抑制BEAS-2B细胞的增殖、侵袭和迁移,进一步通过荧光素酶实验发现miR-138-1的靶基因为PDK1,提示miR-138-1通过负性调控PDK1的表达对黄曲霉素B1诱导的BEAS-2B细胞的恶性转化有重要作用。
本研究运用生物信息学方法对miR-138和PDK1基因的靶向匹配关系进行预测,发现二者匹配良好,进一步通过双荧光素酶报告系统鉴定,发现miR-138能够靶向作用于PDK1 3’UTR抑制PDK1的表达。转染miR-138模拟物后,qRT-PCR和Western blot结果表明过表达miR-138能够导致PDK1 mRNA和蛋白表达的下降,进一步应用Transwell小室检测SW620 细胞的体外侵袭能力,发现miR-138的过表达能够抑制SW620 细胞的侵袭能力,提示miR-138通过靶向作用于PDK1基因能够抑制SW620细胞的侵袭。
| [1] | Bär S, Rommelaere J, Nüesch JP. PKCη/Rdx-driven phosphorylation of PDK1: a novel mechanism promoting cancer cell survival and permissiveness for parvovirus- induced lysis[J]. PLoS Pathog, 2015, 11 (3) : e1004703. |
| [2] | Wada M, Horinaka M, Yasuda S, et al. PDK1 is a potential therapeutic target against angiosarcoma cells[J]. J Dermatol Sci, 2015, 78 (1) : 44–50. |
| [3] | Lucero-Acuña A, Jeffery JJ, Abril ER, et al. Nanoparticle delivery of an AKT/ PDK1 inhibitor improves the therapeutic effect in pancreatic cancer[J]. Int J Nanomedicine, 2014, 9 : 5653–65. |
| [4] | Yang Z, Wu Z, Liu T, et al. Upregulation of PDK1 associates with poor prognosis in esophageal squamous cell carcinoma with facilitating tumorigenicity in vitro[J]. Med Oncol, 2014, 31 (12) : 337. |
| [5] | Chua JH, Armugam A, Jeyaseelan K. MicroRNAs: biogenesis,function and applications[J]. Curr Opin Mol Ther, 2009, 11 (2) : 189–99. |
| [6] | Xu Z, Liao B, Zhang R, et al. Expression of 3-phosphoinositide-dependent protein kinase 1 in colorectal cancer as a potential therapeutic target[J]. Med Oncol, 2015, 32 (7) : 198. |
| [7] | Scortegagna M, Lau E, Zhang T, et al. PDK1 and SGK3 Contribute to the Growth of BRAF-Mutant Melanomas and Are Potential Therapeutic Targets[J]. Cancer Res, 2015, 75 (7) : 1399–412. |
| [8] | Ma X, Li C, Sun L, et al. Lin28/let-7 axis regulates aerobic glycolysis and cancer progression via PDK1[J]. Nat Commun, 2014, 5 : 5212. |
| [9] | Carón RW, Yacoub A, Li M, et al. Activated forms of H-RAS and K-RAS differentially regulate membrane association of PI3K, PDK-1, and AKT and the effect of therapeutic kinase inhibitors on cell survival[J]. Mol Cancer Ther, 2005, 4 (2) : 257–70. |
| [10] | Arico S, Pattingre S, Bauvy C, et al. Celecoxib induces apoptosis by inhibiting 3-phosphoinositide-dependent protein kinase-1 activity in the human colon cancer HT-29 cell line[J]. J Biol Chem, 2002, 277 (31) : 27613–21. |
| [11] | Akao Y, Nakagawa Y, Naoe T. let-7 microRNA functions as a potential growth suppressor in human colon cancer cells[J]. Biol Pharm Bull, 2006, 29 (5) : 903–6. |
| [12] | Tazawa H, Tsuchiya N, Izumiya M, et al. Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells[J]. Proc Natl Sci U S A, 2007, 104 (39) : 15472–7. |
| [13] | Nagel R, le Sage C, Diosdado B, et al. Regulation of the adenomatous polyposis coli gene by the miR-135 family in colorectal cancer[J]. Cancer Res, 2008, 68 (14) : 5795–802. |
| [14] | Wang Y, Zhang Z, Wang H, et al. miR-138-1* regulates aflatoxin B1-induced malignant transformation of BEAS-2B cells by targeting PDK1[J]. Arch Toxicol, 2016, 90 (5) : 1239–49. |
 2016, Vol. 43
2016, Vol. 43