文章信息
- miR-143/145基因簇调控小细胞肺癌耐药性的
- miR-143/145 Cluster Regulate Multi-drug Resistance of Small Cell Lung Cancer
- 肿瘤防治研究, 2016, 43(5): 326-330
- Cancer Research on Prevention and Treatment, 2016, 43(5): 326-330
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.05.002
- 收稿日期: 2015-05-13
- 修回日期: 2015-10-27
最新统计资料显示肺癌在我国城市恶性肿瘤的发病中已高居首位,且其发病率仍呈明显上升趋势,每年增长率高达26.9%,预计到2025年中国将成为世界第一肺癌大国[1]。小细胞肺癌的发病率约占全部肺癌患者的20%,发病人数也将达到相当数量。目前对小细胞肺癌的临床治疗主要以化疗为主,尽管患者对化疗药物反应较敏感,但由于极易出现抗药性,化疗效果常不理想,临床预后差。阐明小细胞肺癌化疗抗药性的分子机制,已成为当今肺癌临床治疗学的重要研究课题之一。
1 材料和方法 1.1 材料人小细胞肺癌敏感细胞株(H69)和其阿霉素耐药株(H69AR)均购自美国ATCC公司,新生胎牛血清、RPMI 1640培养液购自美国Gibco公司;顺铂、阿霉素和依托泊苷购自辉瑞公司;CCK8、细胞周期及凋亡检测试剂盒购自上海碧云天公司,microRNA检测试剂盒、聚合酶链反应(PCR)试剂盒、miR-143/145模似体(mimic)和抑制物(antagomir)购自上海吉玛公司;LipofectamineTM 2000和Opti-MEM I购自美国Invitrogen公司。
1.2 方法 1.2.1 miR-143/145 mimic和antagomir转染H69AR细胞H69AR细胞消化、离心,转至6孔板中培养,待细胞生长到60%融合时,在50 µl的Opti-MEM无血清培养液中加入100 pmol miRNA mimic或antagomir柔和混匀;轻柔混匀Lipofectamine 2000试剂,用50 µl Opti-MEM I稀释1 µl Lipofectamine 2000试剂,轻轻混匀,室温放置5 min;将稀释好的miRNA mimic或antagomir和Lipofectamine 2000试剂混合;轻柔混匀,室温放置20 min,以便形成miRNA/Lipofectamine 2000复合物;再加入400 µl细胞悬浮液(浓度为2×105个每毫升),细胞在CO2培养箱中37℃温育,4~6 h后,除去复合物,更换培养液;24~48 h后,提取细胞RNA和总蛋白备用。
1.2.2 实时荧光定量PCR检测miRNA表达水平取上述准备的RNA,反转录反应参照AMV反转录试剂盒说明,在20 μl体系中加2 μg总RNA进行cDNA的合成。实时荧光定量PCR采用2×SYBR Green PCR Master Mix,取适量cDNA作为摸板,引物浓度0.4 μmol/L,15 μl体系进行扩增,每个待测样本设置3个平行样。合成用于特异扩增miRNA引物,直接使用目标miRNA的成熟序列,参照Sanger miRBase数据库。以U6 snRNA作为内参,PCR反应在实时定量PCR反应仪上进行。三次独立实验后得到的数据运用公式RQ=2-∆∆Ct的方法进行分析。
1.2.3 miR-143/145 mimic和antagomir对细胞增殖和周期的影响(1)流式细胞仪分析细胞周期变化。取生长状态良好细胞,接种于6孔板,无血清培养16 h,用Lipofectamine 2000和Opti-MEM I (Invitrogen)分别将miR-143/145 mimic和antagomir及阴性对照(100 pmol)转入细胞。转染24 h后,用0.25%胰蛋白酶和0.02% EDTA消化细胞,PBS洗2次,用75%乙醇冰浴固定24 h,然后用含1%BSA的PBS充分混匀洗涤2次,PI染色后进行流式细胞仪测定并用Cell Quest软件分析各组细胞群体在细胞周期各个时相的分布比例。(2)流式细胞仪分析细胞凋亡变化。Annexin Ⅴ/PI染色法。对数生长期的H69AR细胞以4×105个每孔接种于6孔板中;用Lipofectamine 2000和Opti-MEM I (Invitrogen)分别将miR-143/145 mimic和antagomir及阴性对照(100 pmol)转染入H69AR细胞,37℃培养48 h;收集细胞,PBS洗涤2次;细胞重悬于100 μl含Annexin Ⅴ-FITC和0.5 μg PI的结合缓冲液(10 mM HEPES、pH7.4、0.15M NaCl、5 mM KCl、1 mM MgCl2、1.8 mM CaCl2)中;避光室温孵育15 min; 加入400 μl结合缓冲液;流式细胞仪分析,按下列公式计算细胞的凋亡指数:细胞凋亡指数=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.2.4 CCK8法检测细胞对化疗药物的敏感度收集对数生长期细胞,用0.25%胰酶消化后重悬,计数后按5×103 个每孔接种于96孔培养板中,每孔总体积100 µl。置于37℃、5%CO2细胞培养箱中培养24 h后,转染miR-143/145 mimic和antagomir及阴性对照(100 pmol)入细胞,每孔总体积为100 µl。置于37℃、5%CO2细胞培养箱中培养24 h后,分别将阿霉素(ADM)、顺铂(DDP)和依托泊苷(VP-16)化疗药物加入培养液中,并进行倍比稀释,按不同浓度ADM(12.5、25、50、75、100 µg/ml)、DDP(50、100、200、300和400 µg/ml)和VP-16(100、200、400、600和800 µg/ml)分别加入指定的孔中,并设不加药物的为阳性对照孔,设5个复孔。置于37℃、5%CO2细胞培养箱中培养24 h,加入CCK8反应液,在37℃、5%CO2环境下培养4 h,应用酶标仪测得450 nm吸光度(A)值。计算存活率,存活率=(不同药物浓度的A值平均值-空白孔A值平均值)/不含药物的阳性对照组A值平均值。根据不同药物浓度的细胞存活率,绘制对数曲线,计算细胞生存率50%时的药物浓度(IC50)。参照3种化疗药物的血浆高峰浓度在各种转染细胞中分别加入0.01、0.1、1和10倍血浆高峰浓度的化疗药物,每种药物的每一浓度设4个重复孔;阴性对照组:仅加细胞不加药物,设4个重复孔;空白调零组:仅加细胞培养液,设4个重复孔。以3×103个每孔细胞接种于96孔培养板中,每孔加入200 μl培养液;细胞贴壁后,将3种化疗药物按不同浓度加入各孔细胞,继续常规培养72 h;每孔加新鲜配制的CCK8溶液(5 μg/μl)20 μl,37℃、5%CO2下继续培养0.5~4 h后,终止培养。选择450 nm波长,在酶联免疫检测仪上测定各孔光吸收值,取每4个重复孔的光吸收值(A值)的平均值,计算各种转染细胞在3种化疗药物不同浓度下的存活率;细胞存活率=(实验组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)×100%。重复实验三次,取平均值,以细胞存活率为纵轴,药物浓度对数为横轴作半对数图,并按作图法求出3种药物的IC50值。
1.3 统计学方法采用SPSS13.0统计软件分析,计量资料采用t检验或One-way ANOVA检验,P<0.05为差异有统计学意义。
2 结果 2.1 miR-143/145基因簇在敏感株(H69)和耐药株(H69AR)中的表达qRT-PCR结果显示H69AR细胞株中miR-143和miR-145的miRNA表达较H69细胞明显升高,差异有统计学意义(P=0.000),见图 1。
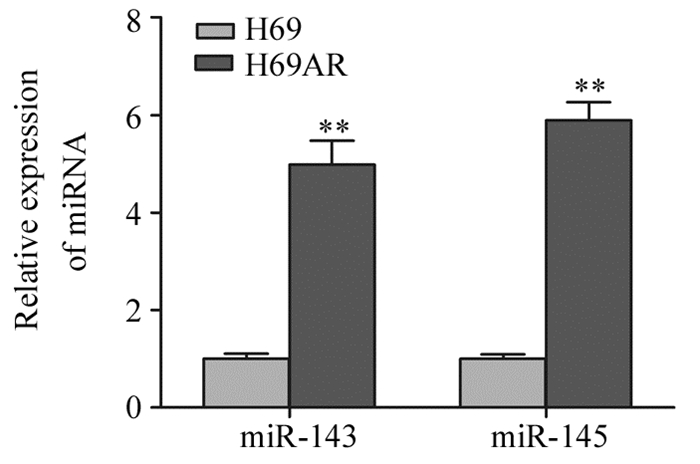
|
| **: P<0.001, compared with H69 cells 图 1 qRT-PCR检测miR-143和miR-145在H69及H69AR细胞中的表达 Figure 1 Expression of miR-143 and miR-145 in H69 and H69AR cells assessed by qRT-PCR |
2.2 miR-143/145 mimic和antagomir对细胞miR-143和miR-145表达的影响
通过转染miR-143/145 mimic和antagomir分别上调H69细胞和下调H69AR细胞株中miR-143和miR-145的表达,见图 2,与对照组H69细胞比较,转染miR-143/145 mimic后miR-143和miR-145的表达分别增加了3.9和4.6倍,见图 2A,而H69AR细胞转染miR-143/145 antagomir后miR-143和miR-145的表达分别较对照组H69AR降低了59%和61%,差异有统计学意义(P=0.000),见图 2B。
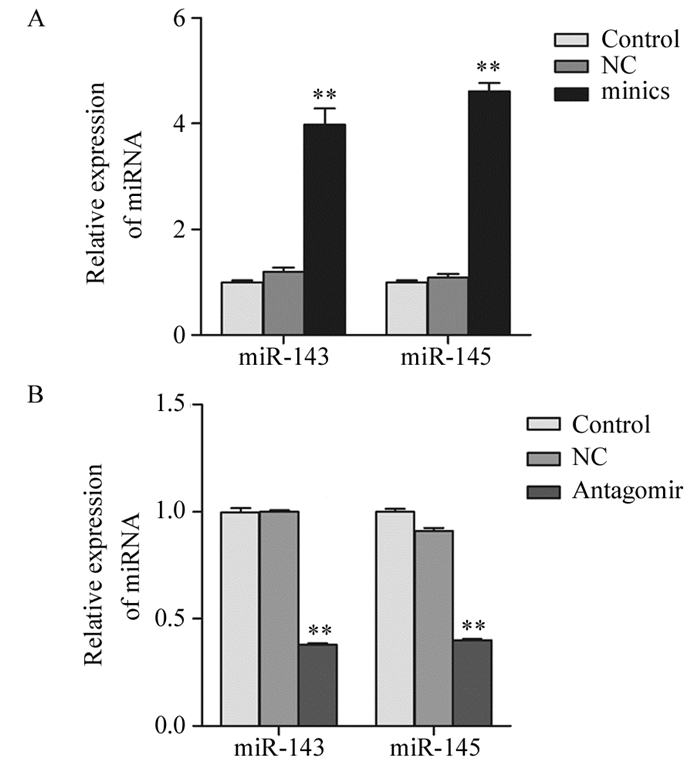
|
| A: miR-143/145 mimic, Control: H69 cell line; B: antagomir, Control:H69AR cell line; **: P<0.001 compared with control group 图 2 qRT-PCR检测细胞转染miR-143/145 mimic和antagomir后miR-143和miR-145的表达 Figure 2 Expression of miR-143 and miR-145 in H69 and H69AR cells after transfected with miR-143/145mimic and antagomir detected by qRT-PCR |
2.3 miR-143/145基因簇对细胞周期的影响
流式细胞技术检测示:与对照组相比,H69细胞转染miR-143/145 mimic后,细胞周期出现G2/M期明显增加,差异有统计学意义(P=0.002)。而H69AR细胞转染miR-143/145 antagomir后细胞周期出现G0/G1期阻滞,与H69AR比较差异有统计学意义(P=0.001),见表 1。
 |
2.4 miR-143/145 mimic和antagomir对细胞凋亡的影响
流式细胞仪分析细胞凋亡变化:H69组细胞的凋亡率为(18.9±1.43)%,H69细胞转染miR-143/145 mimic后凋亡率分别为(9.3±1.09)%和(8.6±0.94)% (P=0.006),H69AR组凋亡率为(5.62±0.43)%,H69AR细胞转染miR-143/145 antagomir后凋亡率分别为(19.92±2.43)%和(16.98±1.943)%(P=0.008),miR-143/145 mimics能抑制细胞的凋亡,miR-143/145 antagomir则促进细胞凋亡,见图 3。H69细胞转染miR-143/145 mimic后,抗凋亡蛋白BCL2无论是mRNA水平(图 4A)还是蛋白水平(图 4B)均明显增加,差异有统计学意义(P=0.001),而H69AR细胞转染miR-143/145 antagomir后抗凋亡蛋白BCL2无论是mRNA水平(图 4C)还是蛋白水平(图 4D)均明显降低,差异有统计学意义(P=0.007),进一步证实了miR-143/145的表达与小细胞肺癌的增殖和凋亡密切相关。
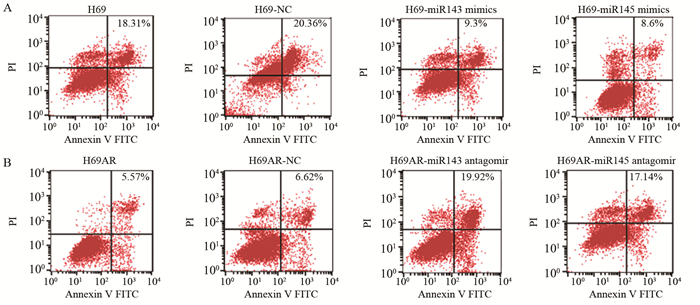
|
| A: miR-143/145mimic; B: antagomir 图 3 流式细胞术分析转染miR-143/145 mimic和antagomir后细胞H69和H69AR细胞凋亡率的变化 Figure 3 Apoptosis rates of H69 and H69AR cell lines after transfected with miR-143/145 mimic and antagomir assayed by flow cytometry |
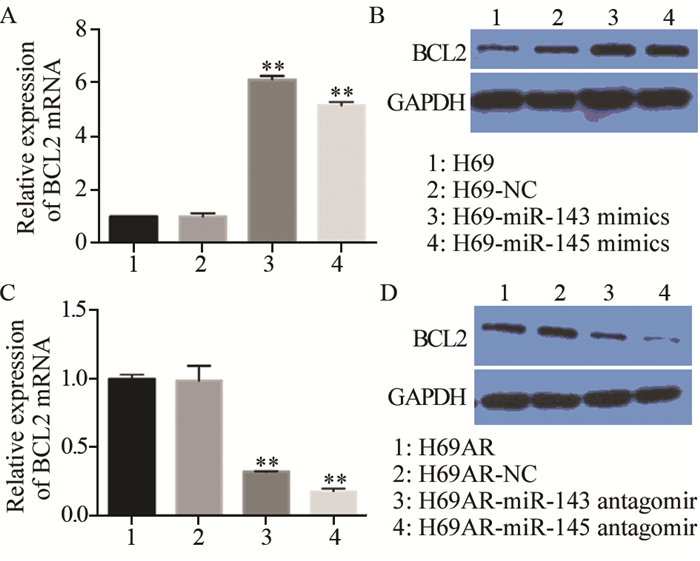
|
| A: the expression of BCL2 mRNA in cells transfected with miR-143/145 mimic detected by qRT-PCR; B: the expression of BCL2 protein in cells transfected with miR-143/145 mimic detected by Western blot; C: the expression of BCL2 mRNA in cells transfected with miR-143/145 antagomir detected by qRT-PCR; D: the expression of BCL2 protein in cells transfected with miR-143/145 antagomir detected by Western blot; **: P <0.001, compared with H69 and H69AR group, respectively 图 4 qRT-PCR和Western blot检测转染miR-143/145 mimic和antagomir后BCL2基因和蛋白的表达 Figure 4 Expression of BCL2 mRNA and protein in cells transfected with miR-143/145 mimic and antagomir detected by qRT-PCR and Western blot |
2.5 miR-143/145 mimic和antagomir对化疗药物敏感度的影响
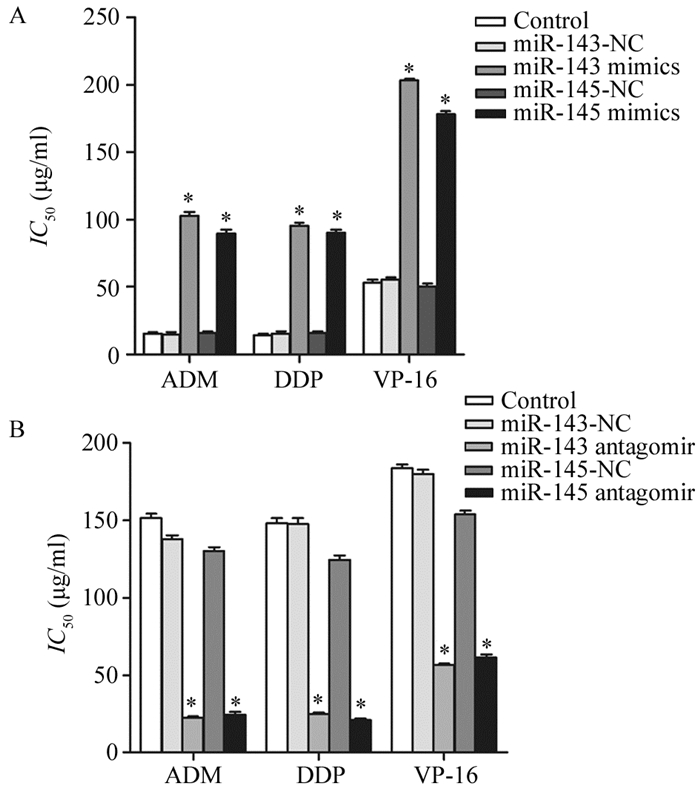
CCK8检测示H69细胞转染miR-143/145 mimic后对顺铂(DDP),阿霉素(ADM)及依托泊苷(VP-16)的敏感度较H69明显降低(P=0.000),见图 5A,而转染了miR-143/145 antagomir的H69AR细胞对DDP、ADM及VP-16的敏感度较H69AR明显增加(P=0.000),见图 5B。
|
| A: miR-143/145 mimic; B: antagomir; *: P<0.05, compared with control group; DDP: cisplatin; ADM: adriamycin; VP-16: etoposide 图 5 CCK8检测转染miR-143/145 mimic和antagomir后细胞对化疗药物敏感度的变化 Figure 5 Chemosensitivity of H69 and H69AR cells to drugs after transfected with miR-143/145 mimic and antagomir detected by CCK8 assay |
3 讨论
miRNAs是近年来在真核生物中发现的一类由19~25个核苷酸组成的非编码RNA,越来越多的研究结果显示miRNAs代表了一个新层次的基因表达调控方式,目前人类基因组中已经鉴定的miRNA有1 048个[2]。研究发现大约50%得到注解的miRNA在基因组上定位于与肿瘤发生相关的区域和脆性位点[3],单个miRNA可调控200多个靶基因,约1/3的蛋白编码基因受miRNA调控。miRNA能够控制特定基因是否进行表达,参与基因转录后水平的调控,可能作为某些基因表达的重要调节分子,参与细胞增殖、分化、凋亡、周期调控和信号转导等生物学过程,在生物发育和肿瘤发生中发挥着重要的调控作用[4-5]。已报道miRNA在各种肿瘤中表达失常,可能发挥着癌基因和抑癌基因的双重作用。同时越来越多的研究表明miRNA在调节肿瘤细胞对抗肿瘤药物耐药方面发挥着重要作用。miR-143/145基因簇同位于染色体5q32位点上,是目前发现的一对具有重要生物学功能的miRNAs基因簇[6]。许多研究发现miR-143和(或)miR-145在多种肿瘤中发挥着肿瘤抑制的功能[7-13]。目前还有一些研究发现miR-143/145簇的下调与直肠癌的发生有关,并且在疾病的早期就出现了表达下调,而经化学修饰的miR-143可能作为一种潜在的RNA药物用于直肠肿瘤的治疗[14];在对前列腺癌的研究中发现miR-143通过靶向作用于EGFR/RAS/MAPK信号通路,能够抑制前列腺癌细胞的增殖、迁移,同时增加对多西紫杉醇的敏感度[15]。
我们通过基因芯片检测小细胞肺癌耐药细胞株(H69AR)和敏感细胞株(H69)中microRNA的表达发现,miR-143/145簇的表达在H69AR细胞株中较H69明显增高。为了进一步验证芯片结果,我们通过qRT-PCR检测了H69AR和H69细胞株中miR-143/145簇的差异表达,与芯片的结果一致。同时利用miR-143/145模拟体(mimics)或抑制物(antagomir)增加或阻断细胞内miR-143/145的水平,发现miR-143/145簇mimic能够引起细胞周期的G2/M期阻滞,抑制细胞的凋亡从而引起细胞对化疗药物的耐药;而本结果与Liu等[16]研究发现miR-145通过靶向作用于DNA损伤相关基因RAD18的表达逆转结直肠癌药物抵抗的研究相反,这可能与microRNA表达的时序性和组织特异性相关。然而影响小细胞肺癌耐药的因素很多,关于miR-143/145在小细胞耐药中的具体作用机制尚需进一步研究。
| [1] | Sun T, Kalionis B, Lv G, et al. Role of Exosomal Noncoding RNAs in Lung Carcinogenesis[J]. Biomed Res Int, 2015, 2015 : 125807. |
| [2] | Ebert MS, Sharp PA. Roles for microRNAs in conferring robustness to biological processes[J]. Cell, 2012, 149 (3) : 515–24. |
| [3] | Calin GA, Sevignani C, Dan Dumitru CD, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proc Natl Acad Sci U S A, 2004, 101 (9) : 2999–3004. |
| [4] | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116 (2) : 281–97. |
| [5] | Alvarez-Garcia I, Miska EA. MicroRNA functions in animal development and human disease[J]. Development, 2005, 132 (21) : 4653–62. |
| [6] | Liu R, Liao J, Yang M, et al. The cluster of miR-143 and miR-145 affects the risk for esophageal squamous cell carcinoma through co-regulating fascin homolog 1[J]. PLoS One, 2012, 7 (3) : e33987. |
| [7] | Slaby O, Svoboda M, Fabian P, et al. Altered expression of miR-21, miR-31, miR-143 and miR-145 is related to clinicopathologic features of colorectal cancer[J]. Oncology, 2007, 72 (5-6) : 397–402. |
| [8] | Fuse M, Nohata N, Kojima S, et al. Restoration of miR-145 expression suppresses cell proliferation, migration and invasion in prostate cancer by targeting FSCN1[J]. Int J Oncol, 2011, 38 (4) : 1093–101. |
| [9] | Kano M, Seki N, Kikkawa N, et al. miR-145, miR-133a and miR-133b: Tumor-suppressive miRNAs target FSCN1 in esophageal squamous cell carcinoma[J]. Int J Cancer, 2010, 127 (12) : 2804–14. |
| [10] | Chiyomaru T, Tatarano S, Kawakami K, et al. SWAP70, actin-binding protein, function as an oncogene targeting tumor-suppressive miR-145 in prostate cancer[J]. Prostate, 2011, 71 (14) : 1559–67. |
| [11] | Chiyomaru T, Enokida H, Tatarano S, et al. miR-145 and miR-133a function as tumour suppressors and directly regulate FSCN1 expression in bladder cancer[J]. Br J Cancer, 2010, 102 (5) : 883–91. |
| [12] | Spizzo R, Nicoloso MS, Lupini L, et al. miR-145 participates with TP53 in a death-promoting regulatory loop and targets estrogen receptor-alpha in human breast cancer cells[J]. Cell Death Differ, 2010, 17 (2) : 246–54. |
| [13] | Zhu H, Dougherty U, Robinson V, et al. EGFR signals downregulate tumor suppressors miR-143 and miR-145 in Western diet-promoted murine colon cancer: role of G1 regulators[J]. Mol Cancer Res, 2011, 9 (7) : 960–75. |
| [14] | Kitade Y, Akao Y. MicroRNAs and their therapeutic potential for human diseases: microRNAs, miR-143 and -145, function as anti-oncomirs and the application of chemically modified miR-143 as an anti-cancer drug[J]. J Pharmacol Sci, 2010, 114 (3) : 276–80. |
| [15] | Xu B, Niu X, Zhang X, et al. miR-143 decreases prostate cancer cells proliferation and migration and enhances their sensitivity to docetaxel through suppression of KRAS[J]. Mol Cell Biochem, 2011, 350 (1-2) : 207–13. |
| [16] | Liu RL, Dong Y, Deng YZ, et al. Tumor suppressor miR-145 reverses drug resistance by directly targeting DNA damage-related gene RAD18 in colorectal cancer[J]. Tumour Biol, 2015, 36 (7) : 5011–9. |
 2016, Vol. 43
2016, Vol. 43
