文章信息
- 安国,李勇,刘彤,郭榕. 2015.
- AN Guo, LI Yong, LIU Tong, GUO Rong. 2015.
- 通用引物SPF1/GP6++与SPF1/GP6+聚合酶链式反应检测多型别人乳头瘤病毒敏感度的比较
- Comparison Between Universal Primer SPF1/GP6++ and SPF1/GP6+ Polymerase Chain Reaction in Detection of Various Genotypes of Human Papillomavirus
- 肿瘤防治研究, 2015, 42(09): 882-886
- Cancer Research on Prevention and Treatment, 2015, 42(09): 882-886
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.09.005
-
文章历史
- 收稿日期:2015-03-05
- 修回日期:2015-05-28
2.100034北京,北京大学第一医院老年科
2.Department of Geriatrics,Peking University First Hospital,Beijing 100034,China
人乳头瘤病毒(human papillomavirus, HPV)属于小双链DNA病毒,主要感染皮肤和黏膜上皮细胞,导致上皮增生甚至恶性转化[1, 2, 3, 4]。目前共发现约150多种型别HPV病毒,其中40多种能够感染生殖道[1]。针对HPV L1保守区序列设计的通用引物进行PCR扩增,是目前最常用的大样本检测方法。Huang等结合两种经典通用引物GP5+/GP6+[5]和SPF1/SPF2[6],建立了SPF1/GP6+[7]方法,该方法因具有较高的检测敏感度已得到广泛的应用[8, 9, 10],但由于GP6+引物序列单一而且鸟嘌呤(Guanine, G)和胞嘧啶(Cytosine, C)含量过低(20%),在检测敏感度和特异性方面依然有缺陷[11]。本研究重新设计并调整了GP6+引物序列,改用4条GP6++简并引物,在提高引物GC含量的同时兼顾了引物与多型别HPV序列的匹配,并以自行构建的包含15种型别HPV L1模拟靶基因序列的重组质粒为模板,对比SPF1/GP6+与SPF1/GP6++两组通用引物的检测敏感度,并进一步在68例人宫颈癌组织DNA样本中进行对比验证。
1 材料和方法 1.1 材料TransTaq DNA Polymerase High Fidelity(HiFi),pEASY-T1克隆载体和Trans10感受态细胞购自北京全式金生物技术公司。引物由北京奥科生物技术公司合成。质粒测序由华大基因公司完成。健康者血细胞基因组DNA提取应用外周血基因组DNA提取试剂盒(Universal Genomic DNA Extraction Kit, 日本TaKaRa公司)。包含HPV16全长DNA序列的质粒由德国肿瘤研究中心Zur Hausen博士惠赠。选取2005年9月—2006年2月汕头大学医学院附属肿瘤医院宫颈癌手术和活检石蜡包埋组织68例,组织DNA提取应用固定组织基因组DNA提取试剂盒(北京康为世纪生物科技有限公司)。
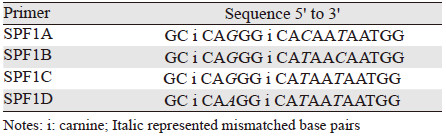
1.2 方法 1.2.1 SPF1/GP6++通用引物的设计SPF1通用引物序列参考文献[6],由4条简并引物(SPF1A,1B,1C,1D)组成,见表 1。引物间有3处碱基存在差异,在另外2处差异较大的序列位点引入肌苷来替代常规碱基。GP6+和GP6++引物序列见图 1。GP6++由4条简并引物组成,在GP6+引物的3′端增加了TTC或CTC序列,提高了引物的GC含量。GP6++的4条引物序列之间有4处碱基存在差异,增加了引物与多型别HPV靶基因序列的结合能力。图 1显示了GP6+和GP6++引物与宫颈癌和头颈部等肿瘤的15种常见感染型别HPV模板序列的碱基配对情况。

|
| Dots represented identical bases and italic represented mismatched base pairs; *: GP6++ comprised of 4 consensus primers 图 1 GP6+与GP6++引物序列以及引物与15种型别HPV L1 读码区序列的碱基配对情况 Figure 1Alignment of GP6+ and GP6++ sequences with the corresponding regions in L1 open reading frame of 15 HPV genotypes |
1.2.2 多种型别HPV L1区模拟靶基因序列的扩增和重组质粒的构建
为比较SPF1/GP6+和SPF1/GP6++通用引物对多种型别HPV的检测敏感度,我们以包含HPV16全长DNA序列的质粒为模板,以对应于SPF1/GP6+和SPF1/GP6++通用引物结合区的型别特异性引物进行PCR扩增,见表 2,获得了HPV11, 16, 18, 31, 33, 34, 35, 39, 51, 52, 53, 56, 58, 61和66共15种模拟靶基因序列。这些序列中与SPF1/GP6+和SPF1/GP6++通用引物结合的区域为上述各型HPV的特异序列,而位于通用引物结合区之间的序列均为HPV16型相应的序列。
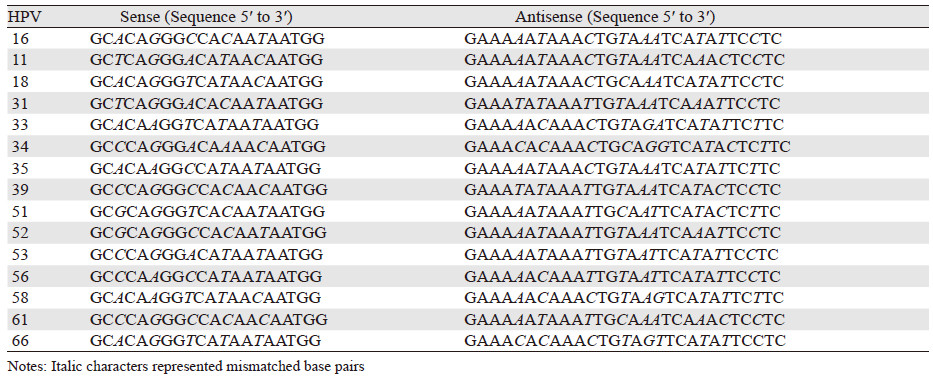 |
PCR反应条件:94℃预变性2 min后,94℃ 30 s,56℃ 40 s,72℃ 40 s,循环34次,72℃延伸10 min。将3 μl PCR产物与1 μl pEASY-T1克隆载体混合,室温放置10 min,连接产物转化Trans10感受态细胞,蓝白斑筛选,挑克隆培养,小提质粒并测序验证。
1.2.3 应用SPF1/GP6+与SPF1/GP6++通用引物对15种型别HPV L1的模拟靶基因序列进行PCR扩增将包含15种型别HPV L1模拟靶基因序列的重组质粒进行梯度稀释,分别将100,101,102,103,104,105拷贝的重组质粒与50 ng无HPV感染的人血细胞基因组DNA混合作为PCR模板,模拟15种型别HPV病毒感染的待测样本。使用SPF1/GP6+与SPF1/GP6++引物进行PCR扩增,50 μl反应体系,反应条件:94℃预变性2 min后,94℃ 30 s,50℃ 40 s,72℃ 38 s循环36次,72℃ 10 min延伸。5 μl扩增产物行2%琼脂糖凝胶电泳并成像。
1.2.4 应用SPF1/GP6+与SPF1/GP6++通用引物检测人宫颈癌组织HPV感染情况应用固定组织基因组DNA提取试剂盒并按照操作说明提取宫颈癌石蜡包埋组织DNA,应用GAPDH引物行PCR扩增以检测组织DNA的质量[8]。针对GAPDH扩增阳性样本,取50 ng DNA做模板,进一步应用SPF1/GP6+和SPF1/GP6++通用引物开展HPV型别的检测(PCR扩增条件同前述,均设立严格的阴性和阳性对照)。将获得扩增产物克隆入pEASY-T1载体并转化感受态细菌后铺盘,针对每例组织样本分别挑取15个克隆进行测序,测序结果与GenBank数据库比对,分析组织HPV感染型别。
2 结果 2.1 模拟靶基因序列重组质粒的构建及测序验证以包含HPV16全长DNA序列的质粒为模板,以15种HPV L1基因型别特异性引物进行PCR扩增,获得各自的模拟靶基因序列,进一步克隆入pEASY-T1载体获得重组质粒。使用T7引物测定插入序列,测序结果与GenBank数据库比对,结果显示模拟靶基因序列中与SPF1/GP6+和SPF1/GP6++通用引物结合的区域为上述各型别HPV的特异序列,测序图略。
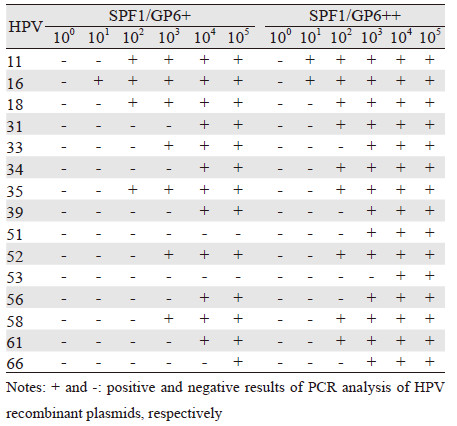
2.2 SPF1/GP6+与SPF1/GP6++通用引物PCR扩增结果SPF1/GP6+与SPF1/GP6++两组通用引物对不同拷贝数HPV重组质粒的扩增结果见图 2和表 3,扩增产物长度均为184 bp。与SPF1/GP6+ PCR比较,SPF1/GP6++ PCR对HPV31,34,61,66的检测敏感度提高了2个数量级;对HPV11,39,52,56,58的检测敏感度提高了1个数量级;应用SPF1/GP6+引物检测不到105拷贝的HPV51 和53重组质粒,而应用SPF1/GP6++引物,103拷贝的HPV 51和104拷贝的HPV53重组质粒均有明显的扩增产物;对于HPV16,18,33和35四种常见高危型别,两组通用引物的检测敏感度相似。

|
| 0, 1, 2, 3, 4, 5: 50 ng human genome DNA mixed with 100, 101, 102, 103, 104, 105 copy of HPV recombinant plasmids, respectively; M: DNA marker 图 2 应用SPF1/GP6+与SPF1/GP6++通用引物对15种型别HPV的PCR扩增结果 Figure 2Amplification results of 15 HPV genotypes using SPF1/GP6+ and SPF1/GP6++ general primers |
 |
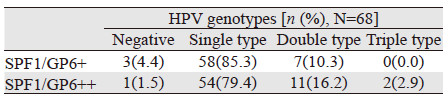
应用GAPDH引物对宫颈癌组织DNA行PCR扩增,68例样本均有扩增产物(结果略)。进一步应用SPF1/GP6+和SPF1/GP6++通用引物对组织DNA进行扩增,产物构建入pEASY-T1克隆载体并行测序和数据库序列比对分析,见表 4。应用SPF1/GP6++检测样本HPV感染的总阳性率为98.5%(67/68),检测到11例双重感染和2例三重感染(分别为HPV 16/18/58和HPV 16/58/39);而应用SPF1/GP6+引物检测的总阳性率为95.6%(65/68),仅检测到7例双重感染。
 |
据文献报道,在世界范围内HPV病毒感染与15%的人类肿瘤发病相关[1, 2, 3, 4],中国生殖器疣患者HPV总感染率为84.2%,宫颈癌患者HPV总感染率超过80%[12]。因此,建立和改进HPV病毒检测的有效方法具有重要的基础研究与临床应用价值。HPV型别众多,而通用引物可以在一次PCR反应中同时检测多种型别的HPV感染,与序列特异PCR相比,可以大大减少工作量和检测成本,并可发现新的病毒类型、亚型及变异体。因此,通用引物PCR是目前最常用的高通量HPV病毒检测方法。但是,通用引物仅能与少数型别HPV引物结合区完全匹配,而与多数型别HPV序列存在或多或少的碱基错配,使得通用引物对不同型别HPV的扩增效率不同,从而影响了对多型别HPV病毒检测的灵敏性[13]。因此,对通用引物检测的灵敏度和特异性的改进一直是研究的热点。
目前针对HPV L1基因保守区设计的通用引物主要包括GP5+/GP6+[5],SPF1/SPF2[6],SPF1/GP6+[7]等。GP5+/GP6+扩增片段长度适中(约140 bp),可通过PCR产物直接测序进一步判断HPV的型别,是目前最常用的通用引物。但该引物组合只有两条序列,GC含量均偏低(GP5+为35%,GP6+为20%),而且与多型别HPV序列错配严重,降低了检测的敏感度和特异性。SPF1通用引物由4条简并引物混合而成,通过不同碱基的组合以及在不同型别HPV序列差异较大的位点处引入肌苷来替代常规碱基,明显增强了引物与多型别HPV序列的匹配能力,可以采用较严格的PCR条件,其检测敏感性和特异性也得到明显提高。但是SPF1/SPF2扩增片段偏短(约60 bp),其产物只能通过探针杂交检测,方法复杂,而且产物提供的病毒序列信息也十分有限。SPF1/GP6+方法结合了SPF1简并引物与多型别HPV序列良好匹配的特点,扩增片段长度约180 bp,也可通过产物直接测序来判断HPV的型别。但是GP6+引物仍存在序列单一和GC含量过低的问题,在检测灵敏度和特异性方面仍然有较大改进空间。
在SPF1/GP6+通用引物基础上,本研究进一步调整了GP6+引物序列,改用4条GP6++简并引物。这些引物在GP6+引物的3′ 端增加了TTC或CTC序列,提高了引物的总体GC含量(24%),增强了引物与模板的结合能力。GP6++的4条引物序列之间有4处位点引入差异碱基,充分考虑了宫颈癌和头颈部等肿瘤常见的高危型HPV在这些位点的碱基序列,从而进一步增加了简并引物与多型别HPV靶基因序列的结合能力。为比较SPF1/GP6+和SPF1/GP6++通用引物对多种型别HPV的检测灵敏度,我们以包含HPV16全长DNA序列的质粒为模板,以型别特异性引物进行PCR扩增,获得了宫颈癌和头颈部等肿瘤常见的15种型别HPV L1区的模拟靶基因序列。这些序列中的引物结合区模拟了型别特异HPV序列与SPF1/GP6+和SPF1/GP6++通用引物的碱基配对的真实情况。将模拟靶基因序列构建入pEASY-T1载体并获得重组质粒。将梯度稀释的HPV L1重组质粒掺入50 ng无HPV病毒感染的健康者基因组DNA,模拟各种型别HPV病毒感染的待测样本,对比SPF1/GP6+与SPF1/GP6++通用引物的检测敏感度。检测结果显示,与SPF1/GP6+相比,SPF1/GP6++对HPV 11,31,34,39,51,52,53,56,58,61 ,66等11种型别HPV的扩增敏感度提高了1到2个数量级。进一步在68例宫颈癌组织DNA样本中的检测结果显示,应用SPF1/GP6++通用引物检测样本HPV感染的总阳性率(98.5%)高于SPF1/GP6+引物(95.6%),尤其是检测到的HPV多重感染(包括双重感染和三重感染)的样本例数(13例)明显多于应用SPF1/GP6+ PCR检测到的阳性样本例数(7例)。
在本研究中,兼顾通用引物与多型别HPV序列的匹配,通过增加通用引物的数量和提高引物GC含量,在SPF1/GP6+ PCR基础上建立了SPF1/GP6++ PCR方法,并应用质粒DNA模板和组织DNA模板证实了SPF1/GP6++ PCR具有更高的检测灵敏度和更广的HPV型别检测范围,为基础研究和临床工作中准确鉴定组织样本的HPV感染型别提供了更为敏感有效的检测手段。
| [1] | Bernard E, Pons-Salort M, Favre M, et al. Comparing human papillomavirus prevalences in women with normal cytology or invasive cervical cancer to rank genotypes according to their oncogenic potential:a meta-analysis of observational studies[J]. BMC Infect Dis, 2013, 13: 373. |
| [2] | Boscolo-Rizzo P, Del Mistro A, Bussu F, et al. New insights into human papillomavirus-associated head and neck squamous cell carcinoma[J]. Acta Otorhinolaryngol Ital, 2013, 33(2): 77-87. |
| [3] | Loeb KR, Asgari MM, Hawes SE, et al. Analysis of Tp53 codon 72 polymorphisms, Tp53 mutations, and HPV infection in cutaneous squamous cell carcinomas[J]. PLoS One, 2012, 7(4): e34422. |
| [4] | Antonsson A, Cornford M, Perry S, et al. Prevalence and risk factors for oral HPV infection in young Australians[J]. PLoS One, 2014, 9(3): e91761. |
| [5] | de Roda Husman AM, Walboomers JM, van den Brule AJ, et al. The use of general primers GP5 and GP6 elongated at their 3' ends with adjacent highly conserved sequences improves human papillomavirus detection by PCR[J]. J Gen Virol, 1995, 76(Pt4): 1057-62. |
| [6] | Kleter B, van Doorn LJ, ter Schegget J, et al. Novel short-fragment PCR assay for highly sensitive broad-spectrum detection of anogenital human papillomaviruses[J]. Am J Pathol, 1998, 153(6): 1731-9. |
| [7] | Huang HJ, Huang SL, Lin CY, et al. Human papillomavirus genotyping by a polymerase chain reaction-based genechip method in cervical carcinoma treated with neoadjuvant chemotherapy plus radical surgery[J]. Int J Gynecol Cancer, 2004, 14(4): 639-49. |
| [8] | Lai CH, Huang HJ, Hsueh S, et al. Human papillomavirus genotype in cervical cancer: a population-based study[J]. Int J Cancer, 2007, 120(9): 1999-2006. |
| [9] | Tsao KC, Huang CG, Kuo YB, et al. Prevalence of human papillomavirus genotypes in northern Taiwanese women[J]. J Med Virol, 2010, 82(10): 1739-45. |
| [10] | Hang D, Liu F, Liu M, et al. Oral human papillomavirus infection and its risk factors among 5410 healthy adults in China, 2009- 2011[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(10): 2101-10. |
| [11] | Chao A, Hsu KH, Lai CH, et al. Cervical cancer screening program integrating Pap smear and HPV DNA testing: a population-based study[J]. Int J Cancer, 2008, 122(12): 2835-41. |
| [12] | Shi JF, Qiao YL, Smith JS, et al. Epidemiology and prevention of human papillomavirus and cervical cancer in China and Mongolia[J]. Vaccine, 2008, 26 suppl 12: M53-9. |
| [13] | Castle PE, Porras C, Quint WG, et al. Comparison of two PCRbased human papillomavirus genotyping methods[J]. J Clin Microbiol, 2008, 46(10): 3437-45. |
 2015, Vol. 42
2015, Vol. 42