文章信息
- 治疗前PLR和NLR对鼻咽癌患者预后的影响
- Effect of NLR and PLR from Pre-treatment on Prognosis of Nasopharyngeal Carcinoma Patients
- 肿瘤防治研究, 2017, 44(7): 476-480
- Cancer Research on Prevention and Treatment, 2017, 44(7): 476-480
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.16.1536
- 收稿日期: 2016-12-12
- 修回日期: 2017-03-24
2. 710061 西安,西安交通大学第一附属医院放疗科
2. Department of Radiation Oncology, The First Affiliated Hospital of Xi'an Jiao Tong University, Xi'an 710061, China
鼻咽癌是最常见的头颈部肿瘤之一。我国为鼻咽癌高发地区,每年的发病率约为20/10万[1],由于鼻咽解剖结构及生物学行为的特殊性,很难行手术治疗,目前鼻咽癌公认和有效的治疗手段为放射治疗或以放疗为主的综合治疗。虽然放疗技术不断进步与放疗设备的不断更新,鼻咽癌的生存率有了较大的提高,但5年生存率仍为60%~80%[2],部分患者仍未能获得长期生存。TNM分期系统是鼻咽癌预后判断和指导治疗的重要依据,但临床发现同一分期患者即使接受相同的治疗方案,预后却不同[3-4],这提示鼻咽癌生物学差异的存在,仅基于解剖学信息的TNM临床分期系统还不能准确地预测鼻咽癌患者的预后。虽然EB病毒滴度、表皮生长因子受体、microRNA也可提示鼻咽癌的预后[5-7],但检测成本高,需要多中心合作,临床上可行性差。所以,亟需检测方便、价格低廉可预测鼻咽癌预后的标志物。
流行病学研究证实,约25%的肿瘤由炎性反应发展而来,其与肿瘤的发生发展密切相关并且影响肿瘤患者的预后[8]。炎性反应指标,如白细胞计数[9]、血小板计数[10-11]、中性粒淋巴细胞比(neutrophil-lymphocyte ratio, NLR)[12-13]、血小板淋巴细胞比(platelet-lymphocyte ratio, PLR)[14-15]被发现可作为肿瘤的独立预后因素。这些血液指标检测方便,价格低廉,可广泛应用于临床,评估患者预后。本研究通过对91例鼻咽癌患者临床资料进行回顾性分析,评价治疗前PLR和NLR与鼻咽癌患者预后的相关性,为评估预后提供客观依据。
1 资料与方法 1.1 临床资料回顾性收集2009年1月至2013年9月期间于西安交通大学第一附属医院和陕西省人民医院初治的91例鼻咽癌患者,所有病例均经病理证实。临床资料完整。排除标准:(1)合并有免疫性疾病以及其他恶性肿瘤的患者;(2)治疗前合并有急性或慢性感染;(3)合并有血液系统疾病、血栓或出血性疾病;(4)合并有严重的肝、肾疾病;(5)治疗前曾接受过放疗或化疗;(6)无远处转移。记录患者治疗前的中性粒细胞计数、淋巴细胞计数及血小板计数结果。
1.2 治疗及随访方法入选患者采用3D-CRT或IMRT根治性放疗(有或无化疗),Ⅰ期患者仅接受单纯放射治疗,Ⅱ、Ⅲ、Ⅳ期患者接受以顺铂和5-氟尿嘧啶为主的辅助或同步放化疗。鼻咽原发灶和颈部转移淋巴结剂量为(70~76)Gy/(7~8)w/(35~38)f,颈部预防区域剂量为(50~60)Gy/(5~6)w/(25~30)f。根据患者的临床分期及不良反应给予2~6周期的全身化疗,化疗方案为:顺铂25 mg/m2,第1~3天静脉滴注;5-氟尿嘧啶500 mg/m2,第1~5天静脉滴注,每21天重复1周期。患者治疗结束后均定期随访,治疗后前2年,每3月检查一次,2年后半年复查一次,5年后1年复查1次。随访截止时间为2016年9月。
1.3 统计学方法采用SPSS19.0软件对数据进行统计学分析。绘制ROC曲线确定PLR和NLR与总生存期(overall survival, OS)及无进展生存期(progression-free survival, PFS)的相关性,选取截断值。应用Kaplan-Meier法进行生存分析并采用Log rank检验来检验。采用Cox比例风险回归模型分析多种因素对生存时间的影响。以P < 0.05为差异有统计学意义。
2 结果 2.1 鼻咽癌患者临床病理资料91例患者的基本特征资料见表 1,中位年龄53岁(12~72)岁,女30例,男61例,男女比例2:1,Ⅰ、Ⅱ、Ⅲ、Ⅳ期患者分别为2、27、42、20例。单纯放疗患者9例,82例患者接受辅助或同步放化疗,所有患者均按期完成放化疗。中位随访时间为44月(6~87)月,其中44例出现复发或转移,39例患者死亡。患者的1、3、5年总生存率分别为92.3%、72.1%、56.8%,1、3、5年无进展生存率分别为82.4%、60.9%、53.3%。
|
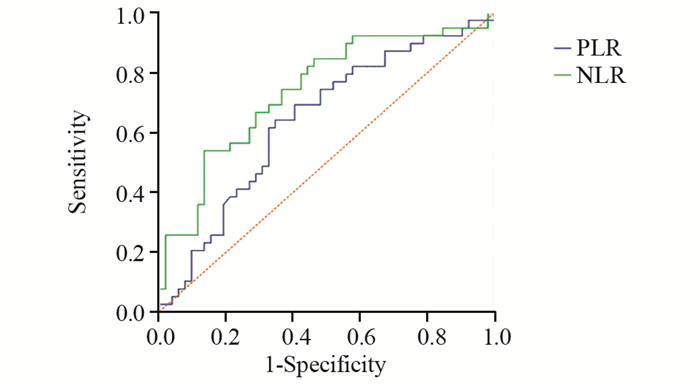
以OS作为终点,PLR、NLR为检测变量,绘制ROC曲线选取截断值分别为143.3、2.6,两者的曲线下面积分别为0.640、0.739,见图 1。
|
| PLR: platelet-lymphocyte ratio; NLR: neutrophil-lymphocyte ratio 图 1 治疗前PLR、NLR与OS关系的ROC曲线图 Figure 1 ROC curves of relationship between OS and PLR, NLR before treatment |
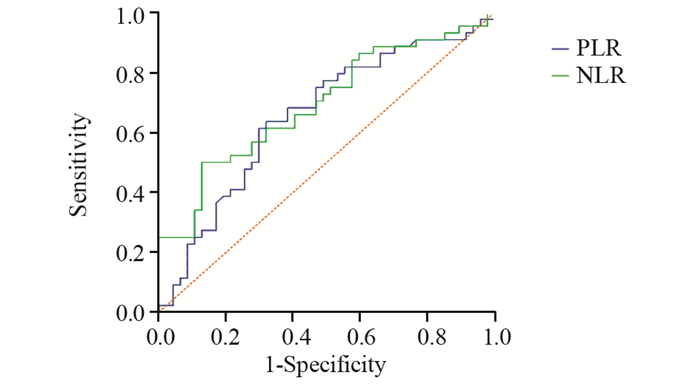
以PFS作为终点,PLR、NLR为检测变量,绘制ROC曲线选取截断值分别为143.3、2.6,两者的曲线下面积分别为0.657、0.694,见图 2。说明治疗前PLR、NLR与患者的预后存在相关性,利用ROC曲线选取的截断值进行进一步生存分析。
|
| 图 2 治疗前PLR、NLR与PFS关系的ROC曲线图 Figure 2 ROC curves of relationship between PFS and PLR, NLR before treatment |
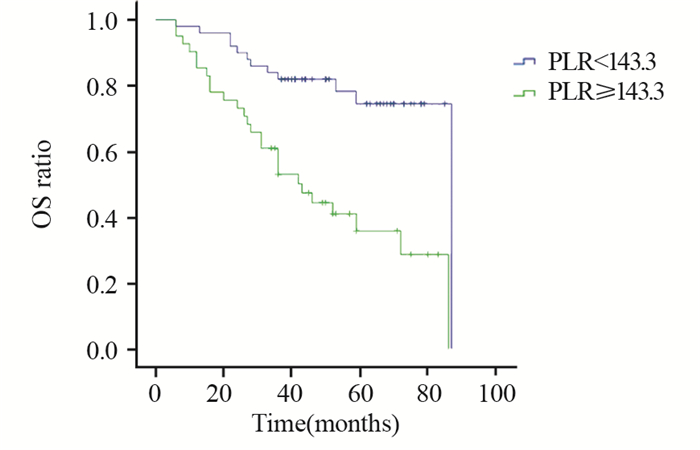
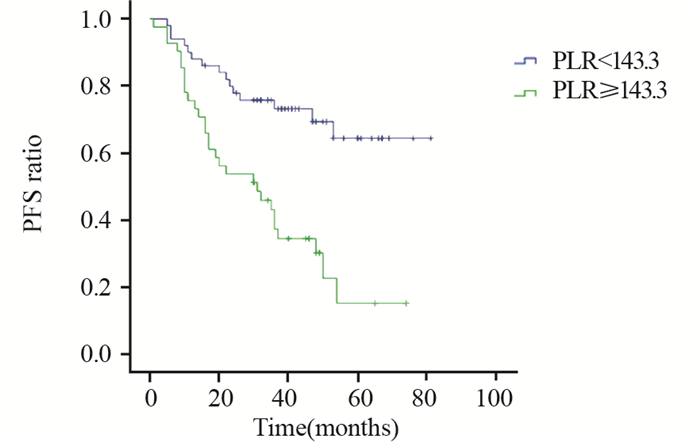
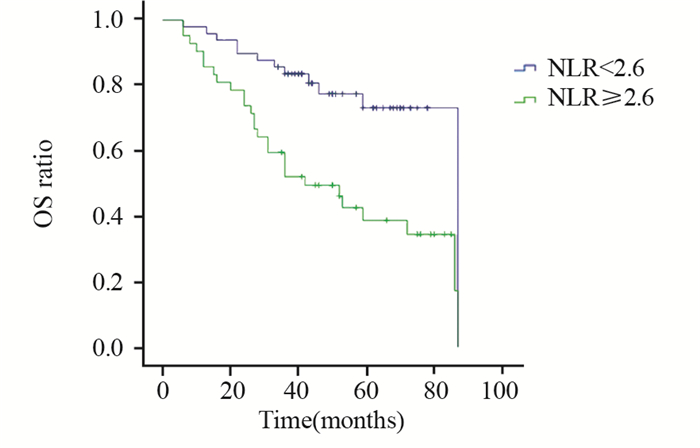
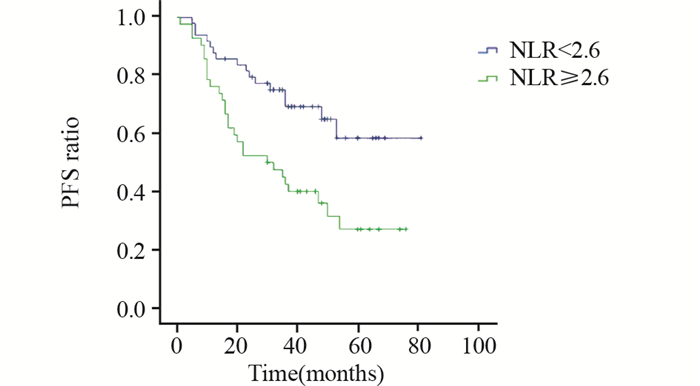
PLR≥143.3组和PLR < 143.3组患者生存曲线比较,差异有统计学意义(P=0.022),见图 3~4。NLR≥2.6组和NLR < 2.6组患者生存曲线比较,差异有统计学意义(P=0.044),见图 5~6。
|
| OS: overall survival 图 3 治疗前PLR<143.3和PLR≥143.3组OS曲线的比较 Figure 3 Comparison of OS between PLR < 143.3 and PLR≥143.3 groups before treatment |
|
| PFS: progression-free survival 图 4 治疗前PLR<143.3组和PLR≥143.3组PFS曲线的比较 Figure 4 Comparison of PFS between PLR < 143.3 and PLR≥143.3 groups before treatment |
|
| 图 5 治疗前NLR<2.6组和NLR≥2.6组OS曲线的比较 Figure 5 Comparison of OS between NLR < 2.6 and NLR≥2.6 groups before treatment |
|
| 图 6 治疗前NLR<2.6组和NLR≥2.6组PFS曲线的比较 Figure 6 Comparison of PFS between NLR < 2.6 and NLR≥2.6 groups before treatment |
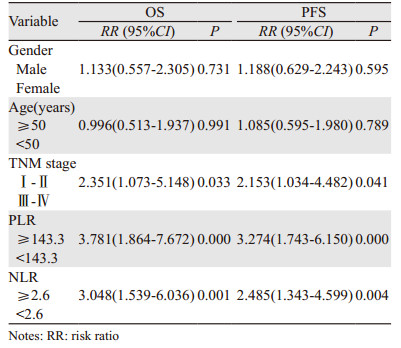
Cox单因素分析显示除性别、年龄以外,TNM分期、治疗前PLR≥143.3、NLR≥2.6均是影响鼻咽癌患者OS和PFS的不良预后因素(P < 0.05),见表 2。Cox多因素分析显示治疗前PLR≥143.3(RR=2.491, 95%CI=1.139~5.451, P=0.022)、NLR≥2.6(RR=2.186, 95%CI=1.021~4.682,P=0.044)是鼻咽癌患者OS的独立危险因素,而治疗前PLR≥143.3(RR=2.461,95%CI=1.242~4.874, P=0.010)是鼻咽癌患者PFS的独立危险因素,见表 3。
|

|
鼻咽癌对放射线高度敏感,因此放疗成为主要治疗手段。随着三维适形放疗和调强放射治疗的临床应用,鼻咽癌的生存率较前明显提高,但5年生存率仍仅为60%~80%。多项研究表明鼻咽癌患者预后与众多因素有关,包括患者年龄、临床分期、EB病毒感染及贫血等。此外,肿瘤的预后还与机体本身的炎性反应有关。炎性反应包含中性粒细胞、淋巴细胞、血小板、C反应蛋白等多种指标,其中PLR、NLR已受到越来越多专家的关注。本研究发现治疗前PLR和NLR可能成为鼻咽癌的独立预后因素。
恶性肿瘤患者常伴随血小板的升高,实验研究表明血小板参与肿瘤细胞生长、转移及血管生成[16]。临床研究表明血小板数目升高与肿瘤患者较差预后相关[11, 17]。此外研究表明中性粒细胞可促使机体产生多种促肿瘤生长因子和蛋白酶,促进肿瘤的发生、发展[18]。而淋巴细胞参与机体的免疫反应是抗肿瘤免疫的重要组成部分,淋巴细胞减少说明机体免疫机制异常,抗肿瘤免疫力下降,为肿瘤生长、浸润和转移提供条件。随着肿瘤进展,机体内炎性反应与肿瘤失去平衡,体内淋巴细胞降低,而血小板、中性粒细胞升高,相应的PLR和NLR比值也增高,机体内促进肿瘤炎性反应与抗肿瘤炎性反应的平衡状态被打破。因此PLR和NLR是反应机体免疫情况的重要指标,两者的升高能促进肿瘤进展,导致肿瘤患者预后不良。既往研究结果显示高PLR和NLR可影响宫颈癌、乳腺癌、结直肠癌等恶性肿瘤的预后[19-21]。而目前关于PLR、NLR与鼻咽癌患者预后相关性的研究较少,Sun等[21]分析了251例鼻咽癌患者治疗前PLR和NLR,结果证明治疗前两者水平是影响鼻咽癌患者生存独立预后因素。本研究结果显示治疗前PLR、NLR与鼻咽癌患者的总生存期和无进展生存期具有相关性。Cox多因素分析提示PLR≥143.3、NLR≥2.6和TNM分期是影响鼻咽癌患者治疗后的独立危险因素。PLR≥143.3组患者有较短OS和PFS,而NLR≥2.6组患者有较差的OS,和本研究结果相一致。因此,高PLR、NLR的鼻咽癌患者总生存率要低于低PLR、NLR的患者,且高PLR的患者复发或转移风险明显增加。据此,临床上或许可以通过提高鼻咽癌患者免疫功能及降低机体炎性反应,改善患者的预后。
但由于本研究是一个相对小样本的回顾性研究,不能代表大部分的鼻咽癌患者,且随访时间较短,存在一定的局限性,因此需要进行多中心、大样本的前瞻性研究来进一步证实。
本研究结果表明,治疗前PLR和NLR水平与鼻咽癌患者预后具有相关性,可能是影响鼻咽癌患者预后的独立危险因素,NLR和PLR的获取具有简便、经济的优点,可以作为鼻咽癌患者病情评估的一个有益补充,值得推广。目前鼻咽癌相关有效预后指标较多,笔者将在今后的临床研究工作中继续探索,将本研究指标与已有的有效预后指标进行比较,从而提高治疗前PLR和NLR水平这一预后指标应用于临床的合理性及可靠性。
| [1] | Chen W. Cancer statistics: updated cancer burden in China[J]. Chin J Cancer Res, 2015, 27(1): 1. |
| [2] | Xu T, Zhu G, He X, et al. A phase Ⅲ randomized study comparing neoadjuvant chemotherapy with concurrent chemotherapy combined with radiotherapy for locoregionally advanced nasopharyngeal carcinoma: updated long-term survival outcomes[J]. Oral Oncol, 2014, 50(2): 71–6. DOI:10.1016/j.oraloncology.2013.11.002 |
| [3] | Wang HY, Sun BY, Zhu ZH, et al. Eight-signature classifier for prediction of nasopharyngeal[J]. J Clin Oncol, 2011, 29(34): 4516–25. DOI:10.1200/JCO.2010.33.7741 |
| [4] | Lin JC, Wang WY, Chen KY, et al. Quantification of plasma Epstein-Barr virus DNA in patients with advanced nasopharyngeal carcinoma[J]. N Engl J Med, 2004, 350(24): 2461–70. DOI:10.1056/NEJMoa032260 |
| [5] | Liu N, Chen NY, Cui RX, et al. Prognostic value of a microRNA signature in nasopharyngeal carcinoma: a microRNA expression analysis[J]. Lancet Oncol, 2012, 13(6): 633–41. DOI:10.1016/S1470-2045(12)70102-X |
| [6] | Sun W, Long G, Wang J, et al. Prognostic role of epidermal growth factor receptor in nasopharyngeal carcinoma: a meta-analysis[J]. Head Neck, 2014, 36(10): 1508–16. |
| [7] | Grivennikov SI, Greten FR, Karin M. Immunity, Inflammation, and cancer[J]. Cell, 2010, 140(6): 883–99. DOI:10.1016/j.cell.2010.01.025 |
| [8] | Pei D, Zhu F, Chen X, et al. Pre-adjuvant chemotherapy leukocyte count may predict the outcome for advanced gastric cancer after radical resection[J]. Biomed Pharmacother, 2014, 68(2): 213–7. DOI:10.1016/j.biopha.2014.01.008 |
| [9] | Ishizuka M, Nagata H, Takagi K, et al. Combination of platelet count and neutrophil to lymphocyte ratio is a useful predictor of postoperative survival in patients with colorectal cancer[J]. Br J Cancer, 2013, 109(2): 401–7. DOI:10.1038/bjc.2013.350 |
| [10] | Rachidi S. Lower circulating platelet counts and antiplatelet therapy independently predict better outcomes in patients with head and neck squamous cell carcinoma[J]. J Hematol Oncol, 2014, 7: 65. DOI:10.1186/s13045-014-0065-5 |
| [11] | Absenger G, Szkandera J, Pichler M, et al. A derived neutrophil to lymphocyte ratio predicts clinical outcome in stage Ⅱ and Ⅲ colon cancer patients[J]. Br J Cancer, 2013, 109(2): 395–400. DOI:10.1038/bjc.2013.346 |
| [12] | Pinato DJ, Shiner RJ, Seckl MJ, et al. Prognostic performance of inflammation-based prognostic indices in primary operable non-small cell lung cancer[J]. Br J Cancer, 2014, 110(8): 1930–5. DOI:10.1038/bjc.2014.145 |
| [13] | Krenn-Pilko S, Langsenlehner U, Thurner EM, et al. The elevated preoperative platelet-to-lymphocyte ratio predicts poor prognosis in breast cancer patients[J]. Br J Cancer, 2014, 110(10): 2524–30. DOI:10.1038/bjc.2014.163 |
| [14] | Racz JM, Cleghorn MC, Jimenez MC, et al. Predictive Ability of Blood Neutrophil-to-Lymphocyte and Platelet-to-Lymphocyte Ratios in Gastrointestinal Stromal Tumors[J]. Ann Surg Oncol, 2015, 22(7): 2343–50. DOI:10.1245/s10434-014-4265-6 |
| [15] | Sharma D, Brummel-Ziedins KE, Bouchard BA, et al. Platelets in tumor progression: a host factor that offers multiple potential targets in the treatment of cancer[J]. J Cell Physiol, 2014, 229(8): 1005–15. DOI:10.1002/jcp.v229.8 |
| [16] | Gakis G, Fritsche HM, Hassan F, et al. Prognostic relevance of postoperative platelet count in upper tract urothelial carcinoma after radical nephroureterectomy[J]. Eur J Cancer, 2014, 50(15): 2583–91. DOI:10.1016/j.ejca.2014.07.003 |
| [17] | Strieter RM, Burdick MD, Mestas J, et al. Cancer CXC chemokine networks and tumour angiogenesis[J]. Eur J Cancer, 2006, 42(6): 768–78. DOI:10.1016/j.ejca.2006.01.006 |
| [18] | 郭煦, 谢洪哲, 柯尊富. 治疗前NLR和PLR对宫颈鳞癌患者预后的影响[J]. 分子诊断与治疗杂志, 2015, 7(6): 372–82. [ Guo X, Xie HZ, Ke ZF. Effect of NLR and PLR from pre-treatment on the prognosis of patients with cervical squamous cell carcinoma[J]. Fen Zi Zhen Duan Yu Zhi Liao Za Zhi, 2015, 7(6): 372–82. ] |
| [19] | 朴美慈, 金仁顺. 术前NLR、PLR与乳腺癌预后的相关性[J]. 中国肿瘤临床, 2015, 42(23): 1128–31. [ Piao MC, Jin RS. Correlation of preoperative neutrophil to lymphocyte ratio and platelet to lymphocyte ratio with prognosis of breast cancer[J]. Zhongguo Zhong Liu Lin Chuang, 2015, 42(23): 1128–31. DOI:10.3969/j.issn.1000-8179.2015.23.936 ] |
| [20] | 李小兵, 熊勇, 邹瑜斌, 等. 术前血小板与淋巴细胞比值对结直肠癌预后的影响[J]. 中国医学创新, 2014, 33(28): 7–10. [ Li XB, Xiong Y, Zou YB, et al. The Effect of Platelet and Lymphocyte Ratio on the Prognosis of Colorectal Cancer[J]. Zhongguo Yi Xue Chuang Xin, 2014, 33(28): 7–10. ] |
| [21] | Sun M, Zhang L, Luo M, et al. Pretreatment hematologic markers as prognostic factors in patients with nasopharyngeal carcinoma: Neutrophil-lymphocyte ratio and platelet-lymphocyte ratio[J]. Head Neck, 2016, 38(Suppl 1): E1332–40. |
 2017, Vol. 44
2017, Vol. 44
