文章信息
- 鼻咽鳞状细胞癌中PLAC8的表达及临床意义
- Expressions of PLAC8 Protein in Nasopharyngeal Carcinoma Cells and Related Clinical Significance
- 肿瘤防治研究, 2017, 44(7): 472-475
- Cancer Research on Prevention and Treatment, 2017, 44(7): 472-475
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0029
- 收稿日期: 2017-01-11
- 修回日期: 2017-02-13
胎盘特异蛋白8(protein placenta-specific 8, PLAC8, 曾被称为ONZIN),是一个有115个氨基酸且富含半胱氨酸的蛋白质,最早发现于人类树突状细胞[1]。Rogulski等第一个发现PLAC8在调控细胞生存中起重要作用的证据。随后不断有研究发现其在调控恶性肿瘤生长增殖及侵袭转移方面起重要作用[1]。迄今为止,研究已证实PLAC8信号的异常表达可能导致多种实体瘤的发生,如胰腺癌[2]、结肠直肠癌[3]、肝癌[4]、肺癌[5]、溶骨性骨肿瘤[6]、前列腺癌[6]及白血病[7]等。
目前尚未见PLAC8在鼻咽癌组织中的表达及其与鼻咽癌发病关系的报道。本研究通过检测PLAC8在鼻咽癌组织、鼻咽部炎性组织及体外培养的鼻咽癌细胞中的表达,分析PLAC8与鼻咽癌临床病理参数之间的关系,从而探讨PLAC8在鼻咽癌发生、发展中的作用及其可能机制。
1 资料与方法 1.1 研究对象和细胞系51例鼻咽癌组织中男38例、女13例;年龄24~72岁,中位年龄50岁。其中T1~T2 25例,T3~T4 26例;Ⅰ~Ⅱ期9例,Ⅲ~Ⅳ期42例;有淋巴结转移47例、无淋巴结转移4例;有远处转移5例、无远处转移46例;所有病例经病理诊断为鼻咽低分化鳞状细胞癌。另外纳入32例鼻咽慢性炎性反应组织作为对照组。51例鼻咽癌与32例鼻咽部慢性炎性反应组织的组织芯片(NPC131)购买于桂林泛普生物科技有限公司。
常规培养NP69(永生化鼻咽上皮细胞系)、鼻咽癌细胞系CNE1、CNE2、C666-1、5-8F、6-10B备用。各细胞系均由武汉大学人民医院中心实验室保存。
1.2 实验方法 1.2.1 免疫组织化学染色组织切片经二甲苯在室温下脱蜡3次,每次15 min,梯度酒精脱水,PBS清洗后,用pH=6.0的柠檬酸钠缓冲液作为抗原修复液在微波炉里进行高温高压法抗原修复15 min。待组织切片温度降至室温,PBS清洗3次(每次5 min),0.3%的H2O2阻断内源性过氧化物酶活性并PBS再次清洗后,用一抗PLAC8(购自英国Abcam公司)4℃孵育过夜(1:200),第二天用二抗孵育30 min,DAB显色,苏木精对比染色并脱水、封片后,应用Olympus BX40正置显微镜和CC-12软件成像系统采集图像。
1.2.2 免疫印迹(Western blot)法检测PLAC8蛋白的表达取常规培养的NP69、CNE1、CNE2、C666-1、5-8F、6-10B细胞分别加入适量含1%蛋白酶抑制剂的细胞裂解液后置冰上裂解20 min,每10 min涡旋一次,裂解液转移至1.5 ml EP管中,4℃、12 000 r/min离心20 min后提取上清液,记录上清量。BCA法测定总蛋白浓度,最后将待测样品蛋白浓度调至合适浓度。100℃ 5 min,使蛋白充分变性,每组上样总蛋白为50 µg,采用12% SDS-PAGE凝胶电泳分离蛋白并电转至硝酸纤维膜上后,用5%的脱脂奶粉液封闭1 h,切取相关蛋白条带后加入1:200稀释的PLAC8一抗,4℃孵育过夜。第二天用TBST漂洗10 min×3次后加入二抗,37℃孵育1 h,同法漂洗3次后,Odyssey双色红外激光成像系统(美国LI-COR公司)扫描,Gel-Pro Analyzer图像处理软件半定量分析显影带。
1.3 结果判定PLAC8在鼻咽癌组织和鼻咽慢性炎性反应组织中表达结果的判读,以细胞质中出现红色或棕黄色染色为阳性细胞[5]。随机观察4个高倍视野,通过计数阳性细胞在视野中的平均百分数和评价细胞染色强弱程度进行评分(IHC指标)。其中阴性染色为0分,阳性细胞百分数1%~25%为1分,> 25%~50%为2分,> 50%~75%为3分,> 75%为4分;根据细胞染色强弱分为:阴性(染色与背景无明显差别)为0分,弱阳性(浅棕黄色)为1分,阳性(棕黄色)为2分,强阳性(红色或深棕黄色)为3分。两者分值的乘积作为最终评分结果,根据评分结果分为阴性(-)、弱阳性(+)、阳性(++)、强阳性(+++)。
凝胶成像系统分析各组PLAC8蛋白电泳条带及其GAPDH电泳条带,重复三遍,测得各样本PLAC8电泳条带的平均灰度值分别与其相对应的GAPDH电泳条带的平均灰度值相比。
1.4 统计学方法实验数据采用SPSS20.0系统软件进行统计分析。对PLAC8在鼻咽癌组织及鼻咽慢性炎性反应组织中的表达差异进行Mann-Whitney U检验,双侧检验水准均为P=0.05,P < 0.05为差异有统计学意义。
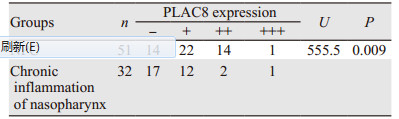
2 结果 2.1 PLAC8在鼻咽癌组织和鼻咽部慢性炎性反应组织中的表达情况PLAC8在鼻咽癌组织中阳性表达率为72.5%(37/51),其表达主要定位于细胞质。在鼻咽慢性炎性反应组织中阳性表达率为46.9%(15/32),两者阳性表达差异有统计学意义(P < 0.01),见图 1、表 1。
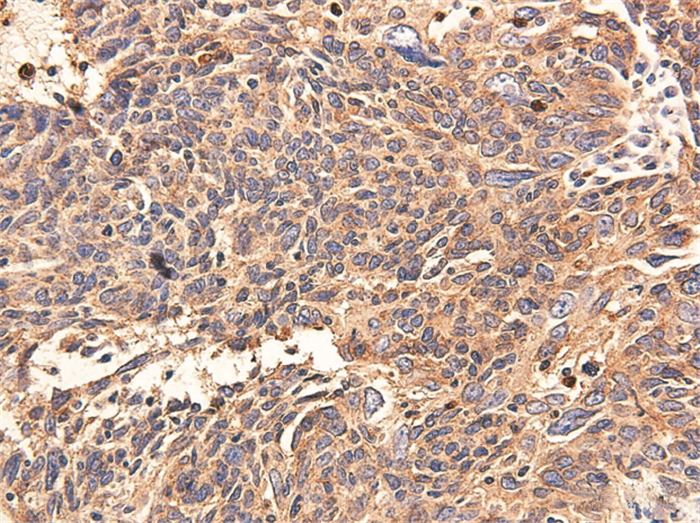
|
| 图 1 PLAC8在部分鼻咽癌组织中阳性表达结果(×400) Figure 1 Expression of PLAC8 protein in part of nasopharyngeal carcinoma(NPC) tissues (×400) |
|
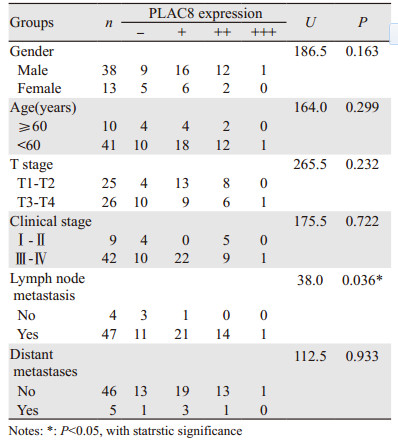
统计分析发现,PLAC8在鼻咽癌组织中表达与鼻咽癌患者的性别、年龄、T分期、临床分期及远处转移无关,与淋巴结转移有关,见图 2。PLAC8在有淋巴结转移病例中的表达高于无淋巴结转移病例,两组病例数据差异具有统计学意义(P < 0.05)。而在性别、年龄、T分期、临床分期及远处转移病例组差异没有统计学意义(P > 0.05),见表 2。
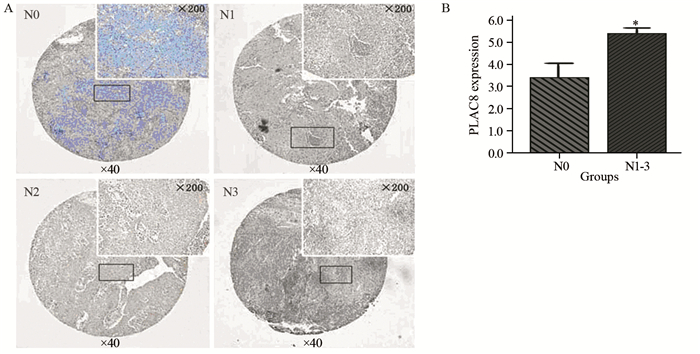
|
| A: images of IHC staining in N stages; B: *: P < 0.05, compared with N0 group 图 2 免疫组织化学染色检测鼻咽癌组织N分期中PLAC8蛋白的表达情况 Figure 2 Expression of PLAC8 protein in N stages of NPC tissues detected by IHC staining |
|
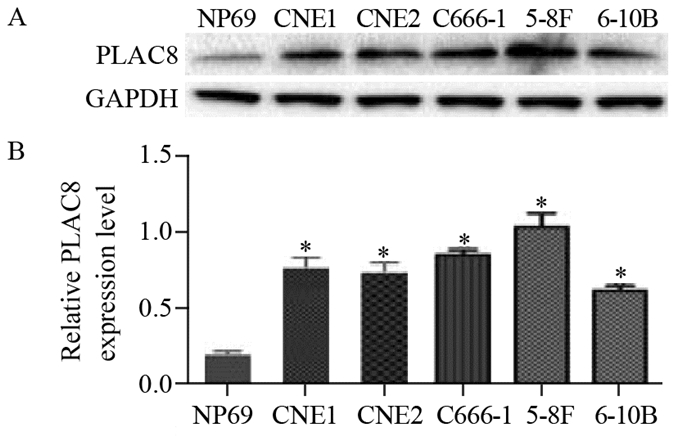
蛋白印迹检测发现,与对照细胞NP69比较,本实验所测的5株鼻咽癌细胞PLAC8表达均呈阳性,见图 3。
|
| The expression of PLAC8 in nasopharyngeal carcinoma cell lines CNE1, CNE2, C666-1, 5-8F and 6-10B were higher then those in immortalized nasopharyngeal epithelial cell line NP69; *: P < 0.05, compared with NP69 图 3 蛋白印记法检测PLAC8蛋白在不同鼻咽癌细胞系中的表达结果 Figure 3 PLAC8 expression in different nasopharyngeal carcinoma cell lines detected by Western blot |
鼻咽癌主要位于鼻腔后部,周围有许多重要组织,通过手术完整切除肿瘤具有很大的挑战性。同时,它又是一个富含淋巴组织的恶性新生物,放射治疗能有效减小一些患者的肿瘤体积并获得良好的治疗效果[8],因此目前仍将放疗作为鼻咽癌治疗的首选方案。然而,鼻咽癌的5年生存率约75%[9],了解其详尽的发病机制并寻找出一些新的特异性治疗方法仍然是研究的热点。
PLAC8基因表达的是一种富含半胱氨酸的蛋白,其中半胱氨酸约有15种[10-12],与其他蛋白几乎没有序列相似性[13-14]。研究发现PLAC8可以通过参与细胞自噬[15]、调节细胞凋亡[5]及导致基因突变[3, 16]等多种方式参与肿瘤的发生发展。同时PLAC8还被证明是一个联合反应基因,是恶性肿瘤表型下基因网的一个重要节点,与p53突变和Ras活性密切相关[3, 15-16],也是c-Myc的目的基因[17]。
本研究结果发现:PLAC8在鼻咽癌组织中表达显著高于鼻咽慢性炎性反应组织,证实PLAC8在鼻咽癌的发生发展中可能起了重要作用。统计学分析发现PLAC8在鼻咽癌组织中的异常表达与鼻咽癌病例的年龄、性别、T分期、临床分期、远处转移无关,而与淋巴结转移有关。提示PLAC8在鼻咽癌组织中的异常表达可能促进了鼻咽癌的淋巴结转移。
此外,本实验结果还显示,PLAC8蛋白在五株鼻咽癌细胞系(CNE1、CNE2、C666-1、5-8F、6-10B)中的表达水平明显高于永生化的鼻咽上皮细胞系NP69,从细胞水平上直接提示PLAC8在鼻咽癌的发生、发展中可能起着重要作用,其具体机制待后续进行深入研究。
因为本实验所有鼻咽癌组织均为低分化鳞癌,所以PLAC8蛋白表达对中高分化的鼻咽癌作用情况目前仍不明确。就低分化鼻咽癌来说,本研究共分析51例临床标本,样本量尚不够大,因此PLAC8表达与鼻咽癌临床病例指标之间的关系有待更大样本进一步证实。
Li等通过免疫荧光发现,PLAC8表达于结肠癌细胞的细胞质[1],Kinsey等也发现PLAC8表达于胰腺癌的溶酶体中,参与细胞自噬[15]。本研究亦发现PLAC8表达定位于鼻咽癌组织的细胞质中,提示PLAC8的作用部位可能发生于细胞质中,但其作用具体在哪些细胞器中还不明了。
Kaistha等[18]研究结果发现PLAC8在慢性胰腺炎性反应组织及正常胰腺黏膜组织中均为低表达且差异无统计学意义。由于完全正常的人体鼻咽黏膜组织比较难以获取,因此本研究选用的对照组织为鼻咽慢性炎性反应组织。严格来讲,鼻咽慢性炎性反应组织不同于完全正常的鼻咽上皮组织,因此,在正常的鼻咽黏膜上皮组织中PLAC8表达如何尚不清楚。
总之,本研究发现PLAC8在鼻咽癌组织中的表达主要定位于鼻咽癌细胞的细胞质中,且与鼻咽癌病例的年龄、性别、T分期、临床分期与远处转移无关,与是否有淋巴结转移有关;同时PLAC8蛋白在多个鼻咽癌细胞株中的表达相对正常人永生化鼻咽上皮细胞系NP69明显上调,证实PLAC8在鼻咽癌的发生发展中可能起了重要作用,可能成为鼻咽癌治疗的一个新靶点。
| [1] | Li C, Ma H, Wang Y, et al. Excess PLAC8 promotes an unconventional ERK2-dependent EMT in colon cancer[J]. J Clin Invest, 2014, 124(5): 2172–87. DOI:10.1172/JCI71103 |
| [2] | Buchholz M, Braun M, Heidenblut A, et al. Transcriptome analysis of microdissected pancreatic intraepithelial neoplastic lesions[J]. Oncogene, 2005, 24(44): 6626–36. DOI:10.1038/sj.onc.1208804 |
| [3] | McMurray HR, Sampson ER, Compitello G, et al. Synergistic response to oncogenic mutations defines gene class critical to cancer phenotype[J]. Nature, 2008, 453(7198): 1112–6. DOI:10.1038/nature06973 |
| [4] | Grate LR. Many accurate small-discriminatory feature subsets exist in microarray transcript data: biomarker discovery[J]. BMC Bioinformatics, 2005, 6: 97. DOI:10.1186/1471-2105-6-97 |
| [5] | Uehara H, Takahashi T, Izumi K. Induction of retinol-binding protein 4 and placenta-specific 8 expression in human prostate cancer cells remaining in bone following osteolytic tumor growth inhibition by osteoprotegerin[J]. Int J Oncol, 2013, 43(2): 365–74. |
| [6] | Ledford JG, Kovarova M, Koller BH. Impaired host defense in mice lacking ONZIN[J]. J Immunol, 2007, 178(8): 5132–43. DOI:10.4049/jimmunol.178.8.5132 |
| [7] | Wu SF, Huang Y, Hou JK, et al. The downregulation of onzin expression by PKCepsilon-ERK2 signaling and itspotential role in AML cell differentiation[J]. Leukemia, 2010, 24(3): 544–51. DOI:10.1038/leu.2009.280 |
| [8] | Hou WH, Wang CW, Tsai CL, et al. The ratio of weight loss to planning target volume significantly impacts setup errors in nasopharyngeal cancer patients undergoing helical tomotherapy with daily megavoltage computed tomograghy[J]. Radiol Oncol, 2016, 50(4): 427–32. |
| [9] | Zhao W, Lei H, Zhu X, et al. Investigation of long-term survival outcomes and failure patterns of patients with nasopharyngeal carcinoma receiving intensity-modulated radiotherapy: a retrospective analysis[J]. Oncotarget, 2016, 7(52): 86914–25. |
| [10] | Libault M, Stacey G. Evolution of FW2.2-like (FWL) and PLAC8 genes in eukaryotes[J]. Plant Signal Behav, 2010, 5(10): 1226–8. DOI:10.4161/psb.5.10.12808 |
| [11] | Song WY, Hörtensteiner S, Tomioka R, et al. Common functions or only phylogenetically related? The large family of PLAC8 motif-containing/PCR genes[J]. Mol Cells, 2011, 31(1): 1–7. |
| [12] | Guo M, Rupe MA, Dieter JA, et al. Cell Number Regulator1 affects plant and organ size in maize: implications for crop yield enhancement and heterosis[J]. Plant Cell, 2010, 22(4): 1057–73. DOI:10.1105/tpc.109.073676 |
| [13] | Tanaka TS, Jaradat SA, Lim MK, et al. Genome-wide expression profiling of mid-gestation placenta and embryo using a 15, 000 mouse developmental cDNA microarray[J]. Proc Natl Acad Sci U S A, 2000, 97(16): 9127–32. DOI:10.1073/pnas.97.16.9127 |
| [14] | Galaviz-Hernandez C, Stagg C, de Ridder G, et al. Plac8 and Plac9, novel placental-enriched genes identified through microarray analysis[J]. Gene, 2003, 309(2): 81–9. DOI:10.1016/S0378-1119(03)00508-0 |
| [15] | Kinsey C, Balakrishnan V, O'Dell MR, et al. Plac8 links oncogenic mutations to regulation of autophagy and is critical to pancreatic cancer progression[J]. Cell Rep, 2014, 7(4): 1143–55. DOI:10.1016/j.celrep.2014.03.061 |
| [16] | Smith B, Land H. Anticancer activity of the cholesterol exporter ABCA1 gene[J]. Cell Rep, 2012, 2(3): 580–90. DOI:10.1016/j.celrep.2012.08.011 |
| [17] | Rogulski K, Li Y, Rothermund K, et al. Onzin, a c-Myc-repressed target, promotes survival and transformation by modulating the Akt-Mdm2-p53 pathway[J]. Oncogene, 2005, 24(51): 7524–41. DOI:10.1038/sj.onc.1208897 |
| [18] | Kaistha BP, Lorenz H, Schmidt H, et al. Plac8 localizes to the lnner plasma membrane of pancreatic cancer cells and regulates cell growth and disease progression through critical cell-cycle regulatory pathways[J]. Cancer Res, 2016, 76(1): 96–107. DOI:10.1158/0008-5472.CAN-15-0216 |
 2017, Vol. 44
2017, Vol. 44


