文章信息
- 醌茜素对人肝癌Huh7细胞的凋亡诱导作用及其抗肿瘤机制
- Apoptotic Effect of Quinalizarin on Human Hepatoma Huh7 Cells and Its Antitumor Mechanism
- 肿瘤防治研究, 2017, 44(7): 454-459
- Cancer Research on Prevention and Treatment, 2017, 44(7): 454-459
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.16.1523
- 收稿日期: 2016-12-07
- 修回日期: 2017-03-17
2. 163316 大庆,哈尔滨医科大学第五医院妇产科
2. Department of Gynaecology and Obstetrics, The Fifth Affiliated Hospital of Harbin Medical University, Daqing 163316, China
肝癌是最常见的恶性肿瘤之一,其致死率仅次于胃癌、食管癌,在世界范围内排第三位[1-2]。现今有效治疗肝癌的方法是进行手术切除或肝移植,但临床上能得到有效治疗的患者仅占30%~40%,因此,寻找有效治疗肝癌的药物极为重要[2-4]。醌茜素(quinalizarin,化学名1, 2, 5, 8-四羟基蒽醌)是鼠李科植物翼核果等许多中草药的主要成分之一。国内外研究表明,醌茜素具有多种抗肿瘤活性,如醌茜素通过抑制SHP-1的活性,增强鼻咽癌CNE-1、CNE-2及5-8F细胞的辐射敏感程度诱导细胞凋亡;同时醌茜素能够调节p38、JNK及ERK的活性诱导肺癌A549细胞凋亡[5-7]。然而,对醌茜素抗肝癌的药效及药理机制知之甚少。本实验旨在探究醌茜素对人肝癌细胞Huh7的增殖抑制和诱导凋亡作用及其可能的机制。
1 材料与方法 1.1 材料 1.1.1 细胞HepG2、Hep3B和Huh7细胞(中国科学院细胞研究所)。
1.1.2 主要试剂及仪器醌茜素(德国MERCK公司),Akt抑制剂HY10249(美国MedChemExpress公司),胰蛋白酶、胎牛血清(美国Gibco公司),细胞凋亡检测试剂盒(中国碧云天公司),DMEM高糖液体培养液、PBS、青/链霉素(美国HyClone公司),MTT(美国Amresco公司)AKT、p-AKT(Thr473兔抗人多克隆抗体)、Bad、Bcl-2、cleaved-caspases-3、β-actin(鼠抗人多克隆抗体)、Pro-caspase-3(兔抗人多克隆抗体)、HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG(美国Santa Cruz公司),ECL化学发光试剂盒(美国Thermo公司),DCFH-DA(美国Invitrogen公司);CO2培养箱(日本SanYo公司),倒置显微镜(德国Leica公司,型号:390302),电泳仪、半干转印仪(美国伯乐公司),MicroChemi4.0型化学发光型凝胶成像系统(以色列DNR公司),Cytoflex流式细胞仪(美国贝克曼库尔特公司)。
1.2 方法 1.2.1 细胞培养人肝癌HepG2、Hep3B和Huh7细胞用含有10%胎牛血清、100 u/ml的青霉素及100 µg/ml的链霉素的DMEM高糖培养液,在5%CO2、37℃的培养箱中培养。每隔2~3天更换一次培养液,细胞贴壁率达到70%~80%进行细胞传代。
1.2.2 MTT法检测细胞存活率收集处于对数增长期的人肝癌HepG2、Hep3B和Huh7细胞,调整细胞悬液浓度,以1×104个/孔接种至96孔板,5% CO2、37℃培养箱里孵育24 h,将原有培养液吸除,每孔加入199 µl含有1% FBS的培养液,进行血清饥饿处理2 h。实验分三组:(1)药物组:每孔加入1 μl不同浓度醌茜素(1、3、10、30及100 μmol/L);(2)对照组:在有细胞的培养孔中加入1 μl DMSO;(3)空白调零孔:在无细胞无培养液的孔中加入100 μl DMSO,每实验组设置8个复孔。培养箱孵育24 h,每孔加入15 µl MTT(5 mg/ml,即0.5% MTT),继续孵育2 h,弃去培养液,加入100 µl DMSO,摇床混匀15 min,用酶联免疫检测仪检测490 nm波长的OD值,计算细胞存活率。实验重复3次。
细胞存活率=(实验组A490值-空白调零组A490值)/(对照组A490值-空白调零组A490值)×100%。
1.2.3 细胞形态学观察收集处于对数增长期的肝癌Huh7细胞,调整细胞悬液浓度,以1×105个/孔接种至6孔板。用不同浓度的醌茜素(1、3、10、30及100 μmol/L)处理细胞24 h,通过倒置显微镜观察细胞的生长情况及形态变化,并照相。
1.2.4 Annexin V-FITC/PI双染法检测细胞凋亡收集处于对数增长期的肝癌Huh7细胞,调整细胞悬液浓度,以1×105个/孔接种至6孔板。30 μmol/L醌茜素处理肝癌Huh7细胞3、6、12及24 h,每孔加入1 ml PBS洗涤一次,每孔先后加入195 µl Annexin V结合液、3 µl Annexin V-FITC试剂及2 µl PI(轻轻摇晃6孔板使加入的染色液与细胞充分接触),荧光倒置显微镜观察并照相,重复3次实验。
1.2.5 流式细胞术检测细胞凋亡收集处于对数增长期的肝癌Huh7细胞,调整细胞悬液浓度,以1×105个/孔接种至6孔板。30 μmol/L醌茜素处理细胞3、6、12及24 h,按照试剂盒说明进行操作,经流式细胞仪上机检测。并计算细胞凋亡率。
1.2.6 流式细胞术检测细胞中活性氧水平收集处于对数期增长的肝癌Huh7细胞,经细胞计数后,调整细胞悬液的浓度,将细胞种于6孔板中,细胞数量约为1×105个/孔。30 μmol/L醌茜素处理肝癌Huh7细胞3、6、12及24 h后,加入终浓度为10 μmol/L的2’7’-二氯二氢荧光素二酯(2’7’-dichlorofluorescein diacetate, DCFH-DA),37℃孵育30 min,细胞经胰酶消化,收至离心管中,5 000 r/min离心5 min,弃上清液,加入PBS吹洗细胞,再次离心,弃上清液。每管加入500 μl PBS将细胞重悬,通过流式细胞术检测10 000个细胞内的平均荧光强度。
1.2.7 Western blot法检测细胞凋亡相关蛋白表达的变化收集上述处理后的细胞置于1.5 ml离心管中,冰上裂解30 min,12 000 r/min、4℃离心30 min,取上清液,通过考马斯亮蓝法测定蛋白质浓度。取总蛋白30 µg用5×buffer上样12% SDS-PAGE电泳分离,然后将蛋白质转至硝酸纤维膜上,脱脂乳封闭1 h,TBST洗涤5次,每次5 min,再分别用稀释好的p-Akt(Thr473)、Akt、Bad、Bcl-2、Pro-capase-3、cleaved-caspase-3(为1:2 500)和β-actin(稀释比例为1:4 000)等一抗于4℃孵育过夜。经TBST洗涤5次,每次5 min,用HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG的二抗(稀释比例为1:2 000)室温孵育2 h,TBST洗涤5次,每次5 min,使用ECL化学发光试剂显色。内参采用β-actin。通过化学发光型凝胶成像系统MicroChemi 4.0照相,进行分析。
1.3 统计学方法采用SPSS19.0软件进行统计分析,计量资料数据以均数±标准差(x±s)表示,两组间比较采用t检验,以P < 0.05为差异有统计学意义。
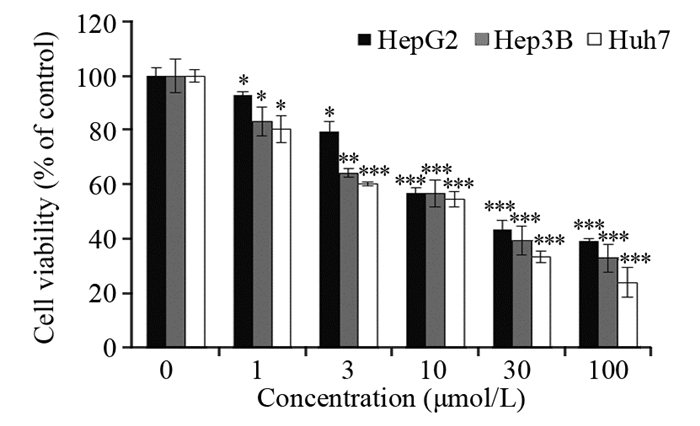
2 结果 2.1 醌茜素对三种人肝癌细胞的杀伤作用随着醌茜素浓度的不断增加,三种人肝癌细胞的存活率明显降低,与对照组(0 μmol/L)相比差异有统计学意义(P=0.0204),说明醌茜素对三种人肝癌细胞均具有杀伤作用且呈现浓度依赖性。经计算,三种肝癌细胞HepG2、Hep3B和Huh7细胞的半数抑制浓度(IC50)分别为20.53、17.89和13.82 μmol/L,见图 1。由于Huh7细胞对醌茜素的敏感度最高,因此后续实验将以人肝癌Huh7细胞为主要研究对象。
|
| *: P < 0.05, **: P < 0.01; ***: P < 0.001 compared with control group 图 1 不同浓度醌茜素处理人肝癌细胞24 h的存活率 Figure 1 Viabilities of human hepatoma cells after different concentrations of quinalizarin treatment for 24h |
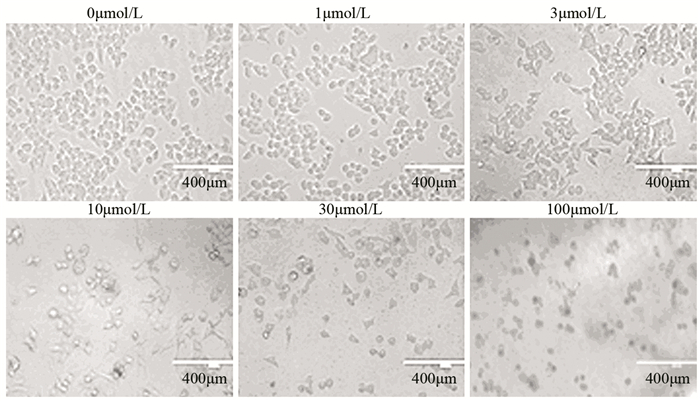
人肝癌Huh7细胞经不同浓度(1、3、10、30及100 μmol/L)的醌茜素处理细胞24 h后,通过倒置显微镜观察其形态的变化。未经药物处理的Huh7细胞(0 μmol/L)生长良好,呈单层聚集性生长,细胞呈多角多边型,细胞大小形态一致;而实验组的细胞,随着醌茜素浓度的增加,细胞形态发生明显改变,细胞多数皱缩变圆,颗粒感增强,尤其是醌茜素浓度达到100 μmol/L时细胞形态变化最为明显,见图 2。
|
| 图 2 倒置显微镜下观察不同浓度醌茜素处理24 h Huh7细胞的形态变化(×200) Figure 2 Morphological changes of Huh7 cells after different concentrations of quinalizarin treatment for 24h (×200) |
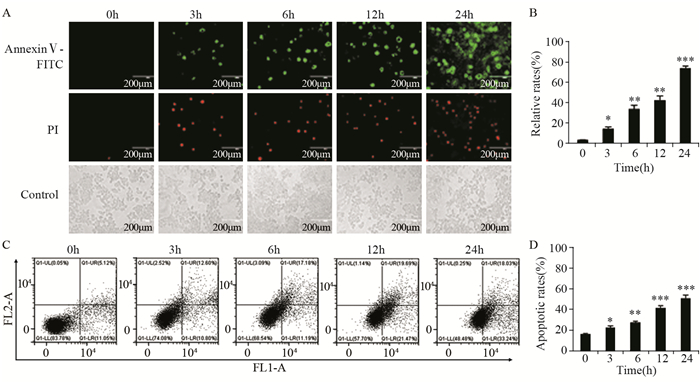
为了验证醌茜素是否诱导肝癌Huh7细胞发生细胞凋亡,分别用30 μmol/L[8-9]醌茜素处理Huh7细胞不同时间(3、6、12及24 h)后,进行Annexin V-FITC/PI双染实验。随着醌茜素处理时间的不断增加,Annexin V-FITC(绿色)荧光强度逐渐增强,细胞发生凋亡的数量显著增加。当醌茜素处理时间为24 h时,细胞的荧光强度最高,细胞凋亡的数量最多;同时通过流式细胞术检测细胞凋亡,发现随着醌茜素处理细胞时间的延长,细胞凋亡率明显增加,尤其24 h时,其凋亡率达到51.27%,且与对照组(0 h)相比差异有统计学意义(P=0.0001),见图 3。
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with control group; A: the apoptotic fluorescence intensity was detected by Annexin V-FITC/PI double staining (×200); B: the quantification of Huh7 cells fluorescence intensity shown in A; C: the apoptotic rates were detected by flow cytometry; D: the percentage of apoptotic cells in the treatment groups was calculated 图 3 醌茜素对肝癌Huh7细胞的诱导凋亡作用(×400) Figure 3 Apoptotic effect of quinalizarin on Huh7 cells (×400) |
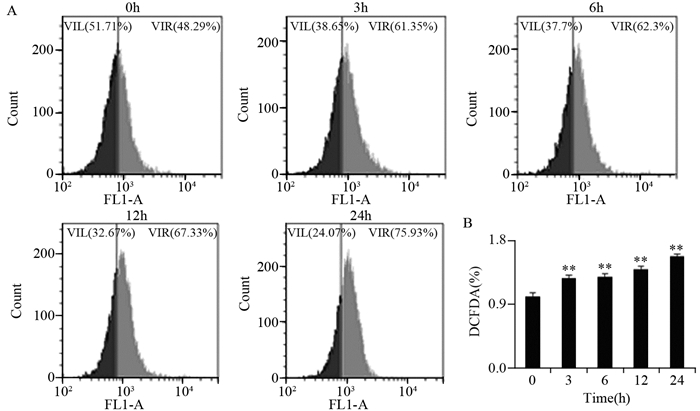
用30 μmol/L的醌茜素处理细胞不同时间(3、6、12及24 h)后,经流式细胞仪以DCFH-DA作为荧光探针测定细胞内ROS水平。随着醌茜素处理时间的增加,ROS的生成量增加,峰值右移,尤其当处理24 h时与对照组(0 h)相比明显升高,差异有统计学意义(P=0.0011),见图 4。
|
| **: P < 0.01, compared with control group; A: The intracellular ROS levels were detected by flow cytometry; B: The quantification of intracellular ROS levels shown in A 图 4 不同时间醌茜素处理后对Huh7细胞内ROS水平的影响 Figure 4 ROS levels in Huh7 cells treated with quinalizarin at different time points |
用30 μmol/L醌茜素处理Huh7细胞3、6、12及24 h后,通过Western blot法在分子水平上检测细胞凋亡相关蛋白表达量变化。抗凋亡蛋白p-Akt(P=0.0001)、Bcl-2(P=0.0497)表达水平明显下降,促凋亡蛋白Bad(P=0.0018)及cleaved-caspase-3(P=0.0001)表达量逐渐升高,未剪切的caspase-3(P=0.0162)逐渐降低,见图 5A~5B。将人肝癌Huh7细胞预处理Akt抑制剂(HY10249)30 min后,加入30 μmol/L醌茜素处理24 h,再加入Akt抑制剂和Akt抑制剂+醌茜素共同处理组,p-Akt(P=0.0021)和Bcl-2(P=0.0323)蛋白表达量均逐渐减少,Bad(P=0.0015)和cleaved-caspase-3(P=0.0010)表达量均逐渐增加,与对照组(0 h)相比,差异均具有统计学意义,见图 5C~5D。
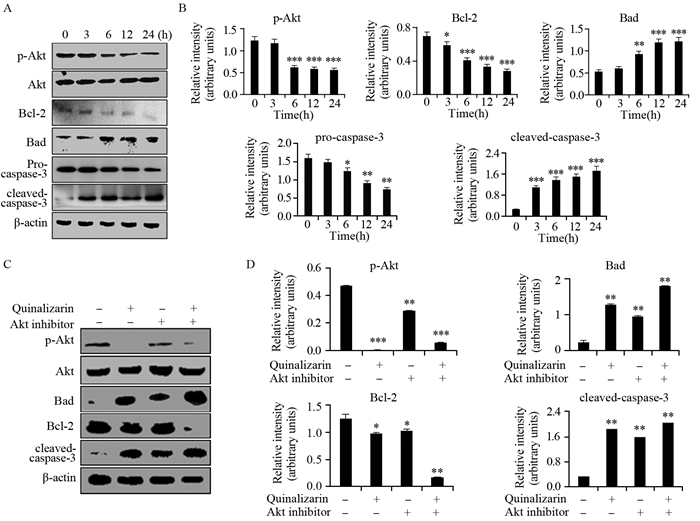
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with control group(0h); A: the expression of apoptosis-related proteins determined by Western blot; B: the quantification of the protein expression levels were normalized to β-actin; C: Huh7 cells were pretreated with or without Akt inhibitor for 30 min and then detected by Western blot; D: the quantification of the protein expression levels were normalized to β-actin 图 5 Western blot法检测醌茜素对Huh7细胞凋亡相关蛋白的影响 Figure 5 Expression levels of apoptosis-related proteins in Huh7 cells treatment with quinalizarin detected by Western blot |
肿瘤的发生是细胞增殖与凋亡失衡的复杂过程,其中细胞凋亡是多基因共同作用的结果,受机体的严格控制。当凋亡相关蛋白及细胞因子精确调控的凋亡受到抑制时会导致肿瘤的发生,因此寻找诱导肿瘤细胞凋亡的药物成为国内外研究的热点之一。本实验通过细胞生物学及分子生物学等方法,探究醌茜素对人肝癌Huh7细胞的促凋亡作用。MTT结果表明,醌茜素浓度依赖性的方式抑制人肝癌Huh7细胞的增殖及存活。通过Annexin V-FITC/PI双染技术,在荧光显微镜下观察到细胞形态的不规则变化,以及凋亡小体的出现。且随着醌茜素处理时间的延长,荧光强度也逐渐增强。同时运用流式细胞仪对人肝癌Huh7细胞凋亡情况进行分析发现醌茜素能够诱导人肝癌Huh7细胞发生凋亡,且随着处理时间的延长细胞凋亡程度逐渐增加,与显微镜下观察的细胞凋亡结果一致。
近年来研究发现,PI3K及其下游分子蛋白激酶B(PKB或Akt)所组成的信号通路与肿瘤的发生有密切联系[10-11]。PI3K/Akt信号通路与肿瘤细胞的增殖、存活及转移起到重要的调控作用,其活性的异常能够导致细胞的恶性转化[12-16]。同时,Akt能抑制caspase-9的活性,阻止caspase家族产生凋亡级联反应[17]。为了进一步探究醌茜素诱导人肝癌Huh7细胞凋亡的分子机制,通过Western blot方法分析了醌茜素对Huh7细胞中凋亡相关蛋白的影响,发现醌茜素通过抑制Akt蛋白的活性,抑制抗凋亡蛋白Bcl-2的表达,促进促凋亡蛋白Bad的表达,进而引起caspase家族的级联反应,诱导细胞凋亡,与之前AKT的研究报道结果相符。同时,加入Akt抑制剂和Akt抑制剂+醌茜素共同处理后,发现p-Akt和Bcl-2的表达逐渐降低,Bad和cleaved-caspase-3表达逐渐升高,说明醌茜素对人肝癌Huh7细胞的杀伤作用和诱导凋亡作用与Akt信号通路相关。
活性氧是真核细胞有氧呼吸的产物,包括超氧阴离子(O2-)、羟自由基(OH)、一氧化氮(NO)、过氧化氢(H2O2)等。活性氧是细胞凋亡的早期信号,能与Apaf-1、caspase-9前体形成凋亡复合体,然后召集并激活caspase-9蛋白酶的活性,剪切caspase-3,使DNA断裂,引起细胞凋亡[18]。本实验流式细胞术结果表明,细胞内活性氧水平随着药物处理时间的延长而增加,说明醌茜素亦能够调节细胞内活性氧的水平诱导细胞凋亡。
综上所述,证明了醌茜素对人肝癌Huh7细胞具有良好的杀伤作用,同时能够通过增加细胞内ROS水平、抑制AKT的活性诱导Huh7细胞发生凋亡,这为肝癌以及其他癌症的治疗与新药开发提供了可靠的理论依据。
| [1] | 吕桂帅, 陈磊, 王红阳. 我国肝癌研究的现状与前景[J]. 生命科学, 2015, 27(3): 237–48. [ Lyu GS, Chen L, Wang HY. Research progress and prospect of liver cancer in China[J]. Sheng Ming Ke Xue, 2015, 27(3): 237–48. ] |
| [2] | 蒋昊, 文颂, 邵国良. 原发性肝癌分子靶向药物临床研究进展[J]. 肿瘤防治研究, 2016, 43(5): 427–34. [ Jiang H, Wen S, Shao GL. Clinical advances of molecular-targeted therapy on primary hepatocellular carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(5): 427–34. ] |
| [3] | 叶胜龙. 2013年肝癌领域新进展[J]. 中华肝脏病杂志, 2014, 22(1): 2–4. [ Ye SL. New advances in liver cancer research: A review of 2013[J]. Zhonghua Gan Zang Bing Za Zhi, 2014, 22(1): 2–4. ] |
| [4] | 张江洲, 龙志雄. 微波消融联合立体定向放疗治疗介入后原发和复发性肝癌的临床研究[J]. 肿瘤防治研究, 2014, 41(6): 649–52. [ Zhang JZ, Long ZX. Microwave ablation combined with stereotactic radiotherapy for primary and recurrent hepatocellular carcinoma after interventional treatment[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(6): 649–52. ] |
| [5] | Cozza G, Mazzorana M, Papinutto E, et al. Quinalizarin as a potent, selective and cell-permeable inhibitor of protein kinase CK2[J]. Biochem J, 2009, 421(3): 387–95. DOI:10.1042/BJ20090069 |
| [6] | Pan X, Meng R, Yu Z, et al. Quinalizarin enhances radiosensitivity of nasopharyngeal carcinoma cells partially by suppressing SHP-1 expression[J]. Int J Oncol, 2016, 48(3): 1073–84. |
| [7] | 孟令旗, 刘畅, 孙虎男, 等. 醌茜素对人肺癌A549细胞增殖、凋亡的影响及初步机制研究[J]. 中国药理学通报, 2016, 32(11): 1625–6. [ Meng LQ, Liu C, Sun HN, et al. Effects of quinalizarin on proliferation and apoptosis of human lung cancer A549 cells and its possible mechanism[J]. Zhongguo Yao Li Xue Tong Bao, 2016, 32(11): 1625–6. DOI:10.3969/j.issn.1001-1978.2016.11.029 ] |
| [8] | 李珂, 周瑜, 张盛, 等. 蛋白激酶CK2抑制剂-醌茜素在非小细胞肺癌中的抗肿瘤作用[J]. 中国医院药学杂志, 2016, 36(17): 1460–5. [ Li K, Zhou Y, Zhang S, et al. Anti-cancer effects of a protein kinase CK2 inhibitor quinalizarin against non-small cell lung cancer[J]. Zhongguo Yi Yuan Yao Xue Za Zhi, 2016, 36(17): 1460–5. ] |
| [9] | 张盛, 李倩雯, 李珂, 等. 蛋白激酶CK2抑制剂对H460细胞内活性氧水平及DNA双链断裂影响[J]. 中华放射肿瘤学杂志, 2016, 25(11): 1261–5. [ Zhang S, Li QW, Li K, et al. Effect of a protein kinase CK2 inhibitor on intracellular levels of reactive oxygen species and DNA double-stand break in H460 cells[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2016, 25(11): 1261–5. DOI:10.3760/cma.j.issn.1004-4221.2016.11.025 ] |
| [10] | 赵静静, 戴小军, 张晓春. Akt介导的信号通路在肿瘤淋巴管生成中的作用[J]. 肿瘤防治研究, 2016, 43(5): 422–6. [ Zhao JJ, Dai XJ, Zhang XC. Role of Akt-mediated signaling pathways in tumor lymphangiogenesis[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(5): 422–6. ] |
| [11] | 张雪群, 高卫, 潘盼, 等. PI3K/AKT及其相关因子在结肠癌中的表达[J]. 山东大学学报(医学版), 2016, 54(1): 52–7. [ Zhang XQ, Gao W, Pan P, et al. The expressions of PI3K/AKT and its related factors in colon cancer[J]. Shandong Da Xue Xue Bao(Yi Xue Ban), 2016, 54(1): 52–7. ] |
| [12] | 刘畅, 罗英花, 蒋雪园, 等. 大黄素对人肝癌Huh7细胞的凋亡作用及机制研究[J]. 药物评价研究, 2016, 39(3): 367–71. [ Liu C, Luo YH, Jiang XY, et al. Effect of emodin on inhibiting proliferation and inducing apoptosis in human hepatoma Huh7 cells and its mechanisms[J]. Yao Wu Ping Jia Yan Jiu, 2016, 39(3): 367–71. ] |
| [13] | Gao H, Wang H, Peng J. Hispidulin induces apoptosis through mitochondrial dysfunction and inhibition of P13k/Akt signaling pathway in HepG2 cancer cells[J]. Cell Biochem Biophys, 2014, 69(1): 27–34. DOI:10.1007/s12013-013-9762-x |
| [14] | Yuan L, Wang J, Xiao H, et al. Isoorientin induces apoptosis through mitochondrial dysfunction and inhibition of PI3K/Akt signaling pathway in HepG2 cancer cells[J]. Toxicol Appl Pharmacol, 2012, 265(1): 83–92. DOI:10.1016/j.taap.2012.09.022 |
| [15] | 张勇, 汤小玉, 李荣清, 等. PTEN、p-Akt在肝癌组织中的表达及其与上皮间质转化的关系[J]. 西南国防医药, 2014, 24(4): 349–52. [ Zhang Y, Tang XY, Li RQ, et al. Expression of PTEN and p-Akt in hepatocelluar carcinoma and their relationship with epithelial-mesenchymal transitions[J]. Xi Nan Guo Fang Yi Yao, 2014, 24(4): 349–52. ] |
| [16] | 张立功, 钱军. PI3K/Akt信号通路在肿瘤发展和治疗中的作用[J]. 安徽医药, 2012, 6(2): 149–51. [ Zhang LG, Qian J. Role of PI3K/Akt signaling pathway in tumor progress and treatment[J]. Anhui Yi Yao, 2012, 6(2): 149–51. ] |
| [17] | Shultz JC, Goehe RW, Wijesinghe DS, et al. Alternative splicing of caspase 9 is modulated by the phosphoinositide 3-kinase/Akt pathway via phosphorylation of SRp30a[J]. Cancer Res, 2010, 70(22): 9185–96. DOI:10.1158/0008-5472.CAN-10-1545 |
| [18] | 张嘉娣. 活性氧的信号传导途径[J]. 安徽农业科学, 2010, 38(16): 8283–5. [ Zhang JD. Reactive Oxygen Species in Signal Transduction Pathway[J]. Anhui Nong Ye Ke Xue, 2010, 38(16): 8283–5. DOI:10.3969/j.issn.0517-6611.2010.16.002 ] |
 2017, Vol. 44
2017, Vol. 44


